Содержание
- 2. Модель Томсона Дж. Томсон в 1898 году предложил модель атома: положительно заряжен-ный шар радиусом 10-10м, в
- 3. Опыт Резерфорда
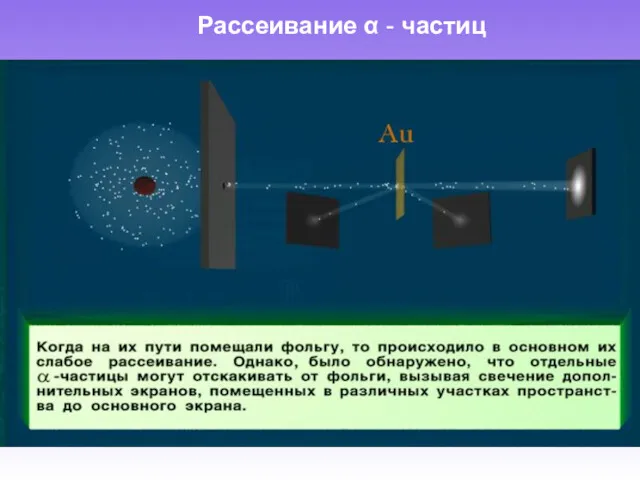
- 4. Рассеивание α - частиц
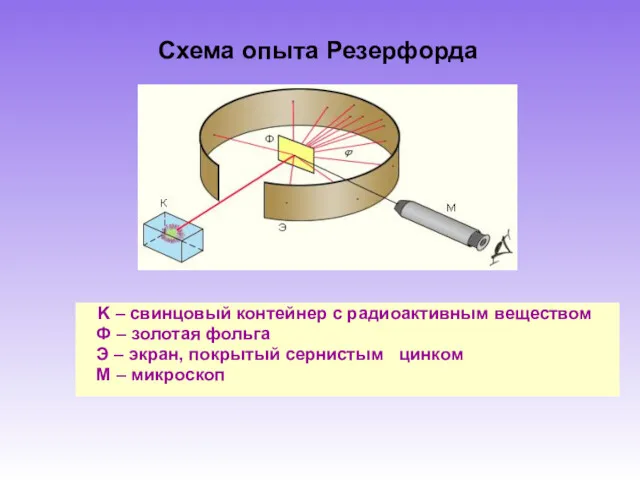
- 5. Схема опыта Резерфорда K – свинцовый контейнер с радиоактивным веществом Ф – золотая фольга Э –
- 6. Рассеяние α-частицы в атоме Томсона и в атоме Резерфорда α Атом Резерфорда Атом Томсона α 1.
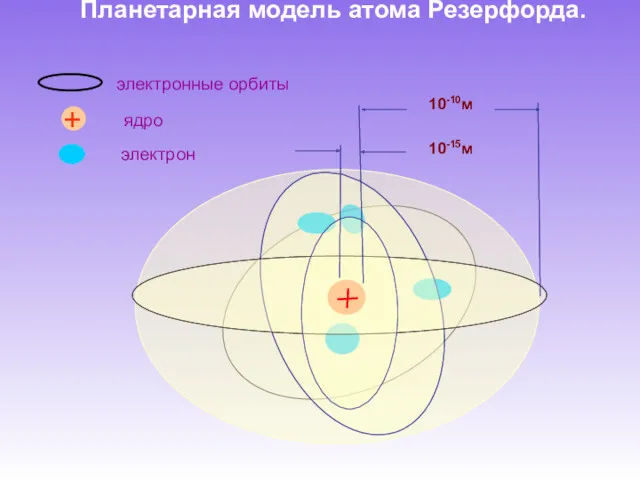
- 7. Планетарная модель атома Резерфорда. 10-10м 10-15м электрон ядро + электронные орбиты
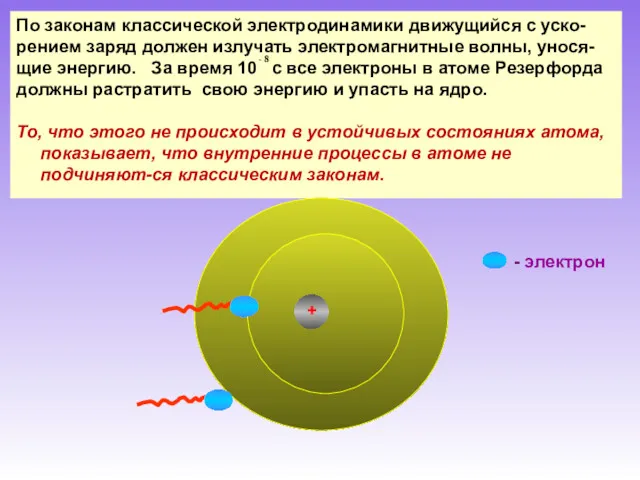
- 8. По законам классической электродинамики движущийся с уско- рением заряд должен излучать электромагнитные волны, унося- щие энергию.
- 9. I ПОСТУЛАТ БОРА Атомная система может находится только в особых стационарных квантовых состояниях, каждому из которых
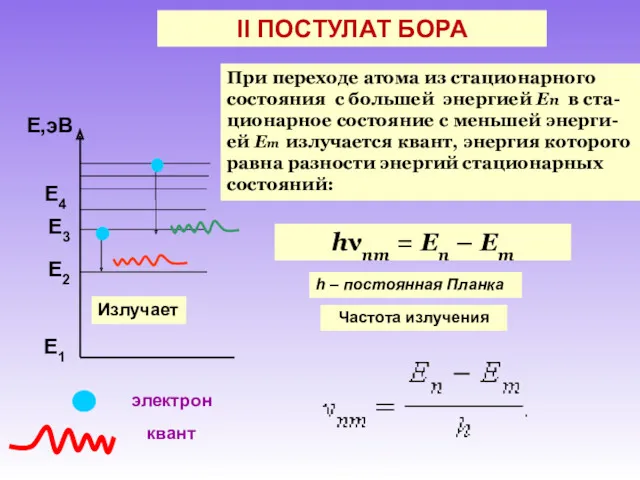
- 10. II ПОСТУЛАТ БОРА При переходе атома из стационарного состояния с большей энергией En в ста-ционарное состояние
- 11. II ПОСТУЛАТ БОРА При переходе атома из стационарного состояния с меньшей энергией En в стационарное состояние
- 12. Правило квантования Бора В стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь дискретные, квантованные
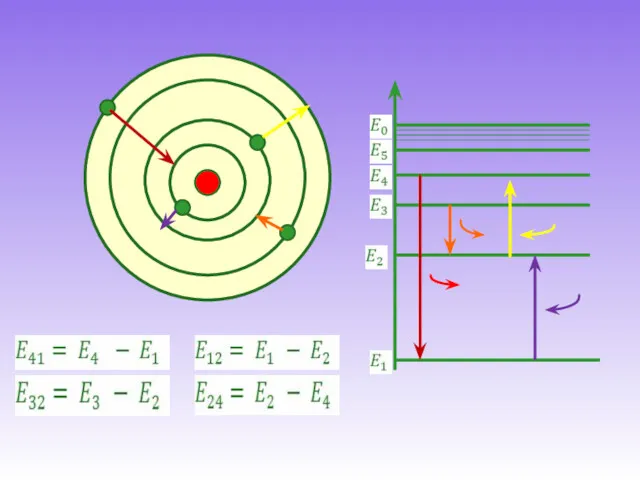
- 13. Энергетические диаграммы Е1 Е2 Е3 Е,эВ Е4 Энергетический уровень (стационарное состояние) Нормальное состояние атома Е1 -
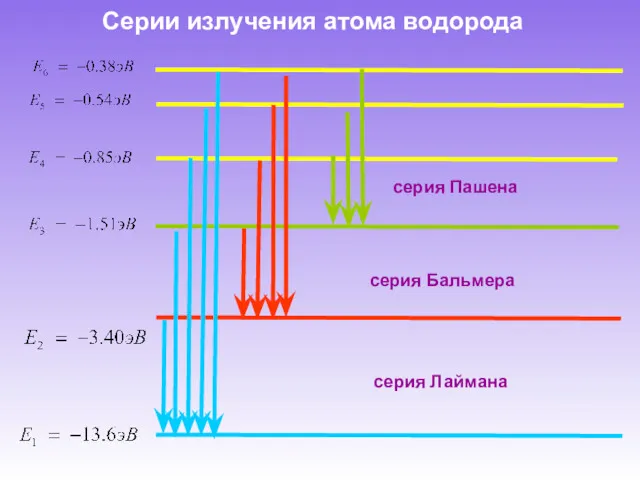
- 15. Серии излучения атома водорода серия Пашена серия Лаймана серия Бальмера
- 16. 4. Уровни энергии электрона в атоме з адаются формулой . При переходе атома из состояния Е
- 17. Излучение атомов Чему равна: длина волны для фотонов, излучаемых при переходе с уровня Е4 на уровень
- 20. Скачать презентацию










 Methods of taper turning
Methods of taper turning Действие магнитного поля на проводник с током
Действие магнитного поля на проводник с током Основы строительной физики
Основы строительной физики Защита сверхпроводящих магнитов. Криогенные и сверхпроводящие электроэнергетические устройства. Лекция 12
Защита сверхпроводящих магнитов. Криогенные и сверхпроводящие электроэнергетические устройства. Лекция 12 Проекция силы на ось и на плоскость
Проекция силы на ось и на плоскость Полупроводниковые материалы. Удельное сопротивление
Полупроводниковые материалы. Удельное сопротивление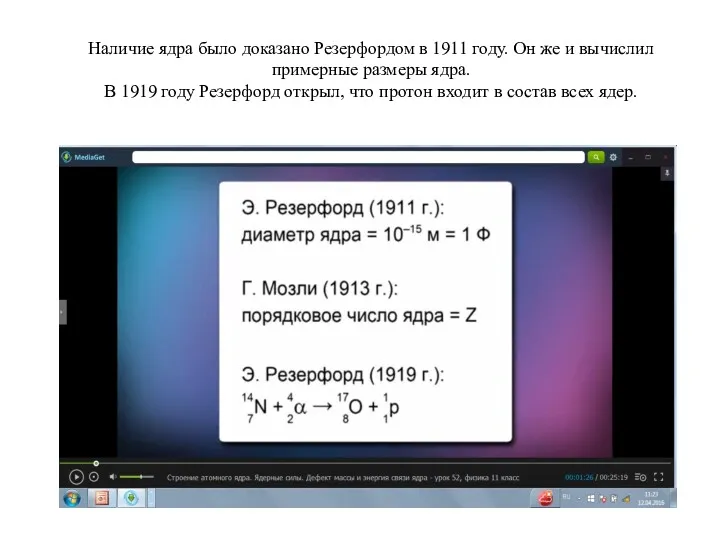 Строение ядра, энергия связи, дефект масс
Строение ядра, энергия связи, дефект масс Динамика материальной точки
Динамика материальной точки Материаловедение и технологии современных и перспективных материалов
Материаловедение и технологии современных и перспективных материалов Температура
Температура Методы электрофизической и электрохимической обработки поверхностей заготовок
Методы электрофизической и электрохимической обработки поверхностей заготовок презентация Тепловые явления
презентация Тепловые явления Основы теплоэнергетики
Основы теплоэнергетики Электромагнитное поле
Электромагнитное поле Тепловые двигатели
Тепловые двигатели Презентация к уроку по физике (8 класс) Импульс тела. Закон сохранения импульса.
Презентация к уроку по физике (8 класс) Импульс тела. Закон сохранения импульса. Компрессорные машины
Компрессорные машины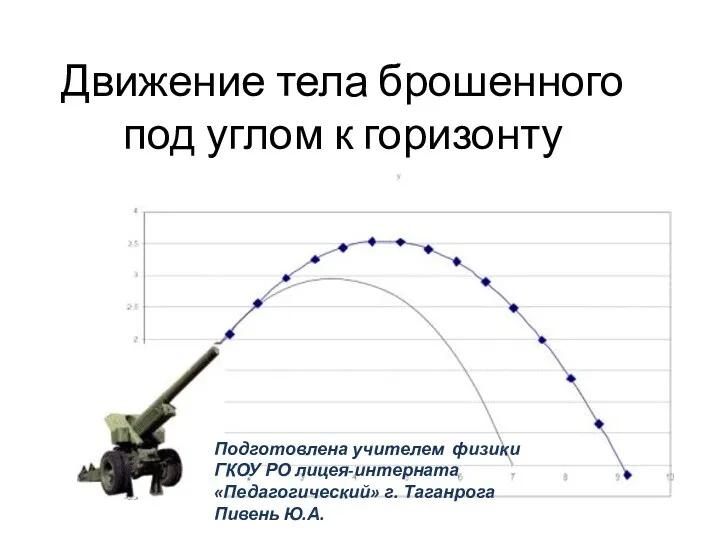 Презентация по физике 10 класс Уравнение движения тела брошенного под углом к горизонту
Презентация по физике 10 класс Уравнение движения тела брошенного под углом к горизонту Закони Ньютона
Закони Ньютона Теорія великого вибуху
Теорія великого вибуху Лекция 29. Тема 6. Атомная физика
Лекция 29. Тема 6. Атомная физика Швартовные операции. Швартовка к причалу
Швартовные операции. Швартовка к причалу Петров презентация
Петров презентация Архимед күші. (7-сынып)
Архимед күші. (7-сынып) Презентация Солнце
Презентация Солнце Перемещение при прямолинейном равномерном движении
Перемещение при прямолинейном равномерном движении Идеальный газ. Основное уравнение МКТ идеального газа
Идеальный газ. Основное уравнение МКТ идеального газа отражение и преломление света
отражение и преломление света