Содержание
- 2. Зачем нужна изотопная геохимия?
- 3. Литература 2006 1989 1986
- 4. Литература 2001 1993 2007
- 5. Литература 2010 2005 2012
- 6. Литература 2008 2005
- 7. Литература 2015 2013
- 8. Литература 1987 1984
- 9. Литература 2006 2010
- 10. Литература 1983 2007
- 11. Периодика
- 12. Периодика geology.spbu.ru/oldsite «лекции on-line» http://ansatte.uit.no/kku000/webgeology/
- 13. Задачи изотопной геохронологии Определение времени и длительности геологических событий Основные задачи изотопной геохимии Оценка отношения материнского
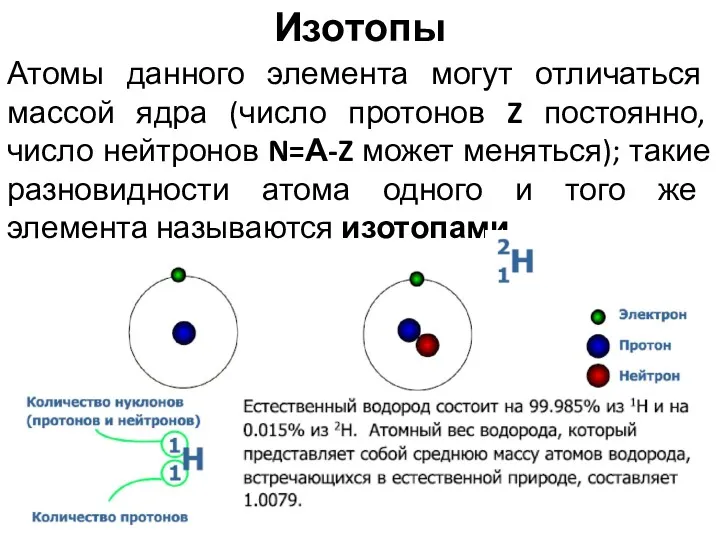
- 14. Атомы данного элемента могут отличаться массой ядра (число протонов Z постоянно, число нейтронов N=А-Z может меняться);
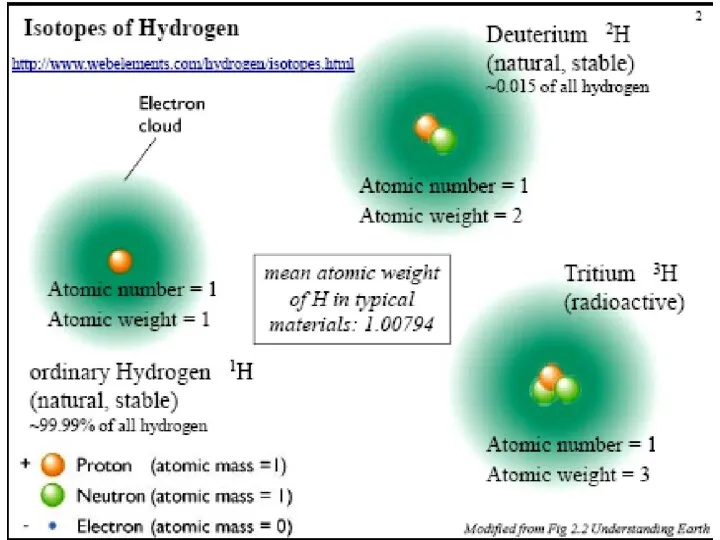
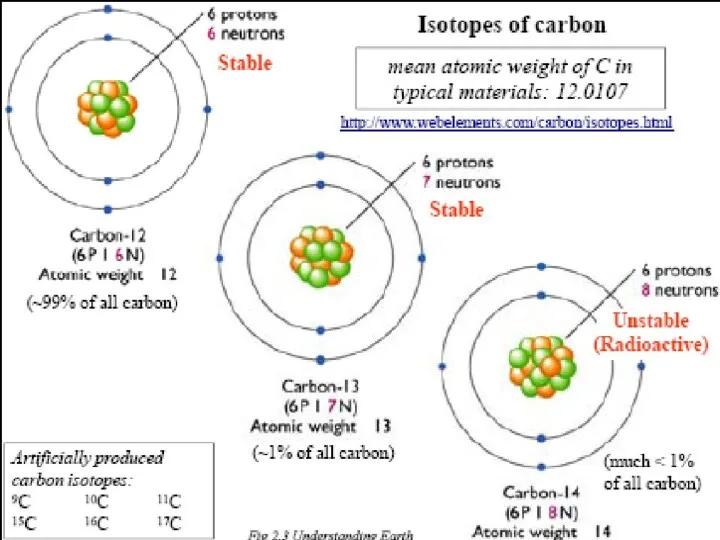
- 15. Изотопы – атомы одного элемента, имеющие в ядрах одинаковое число протонов, но различное число нейтронов. Изотопы
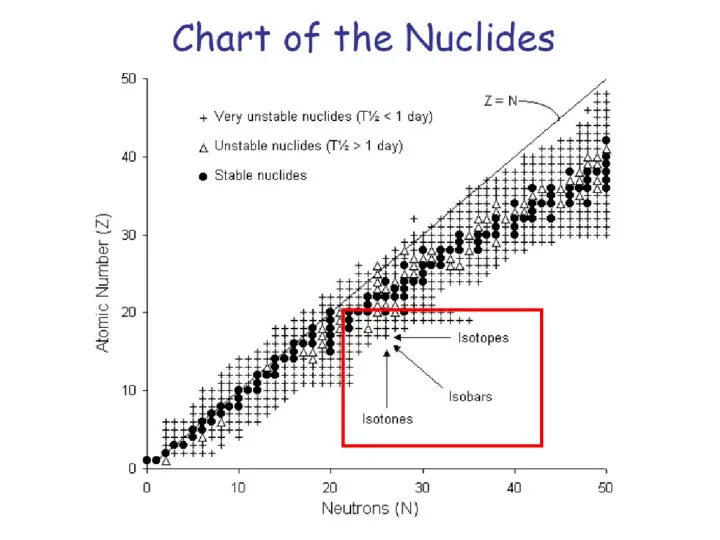
- 18. Изобары – атомы различных элементов, ядра которых содержат одинаковое число нуклонов (протонов и нейтронов в сумме),
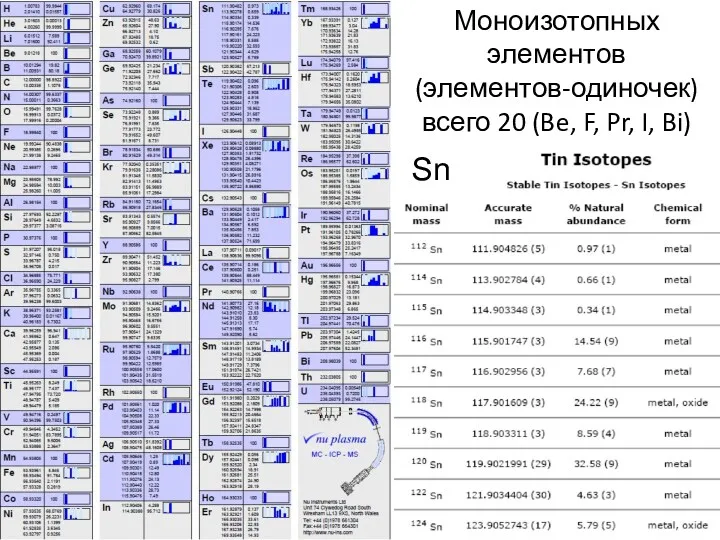
- 20. Моноизотопных элементов (элементов-одиночек) всего 20 (Be, F, Pr, I, Bi) Sn
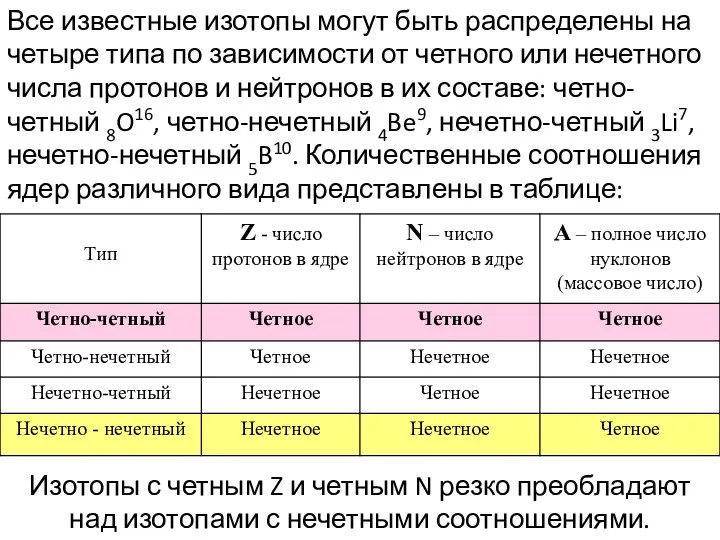
- 21. Все известные изотопы могут быть распределены на четыре типа по зависимости от четного или нечетного числа
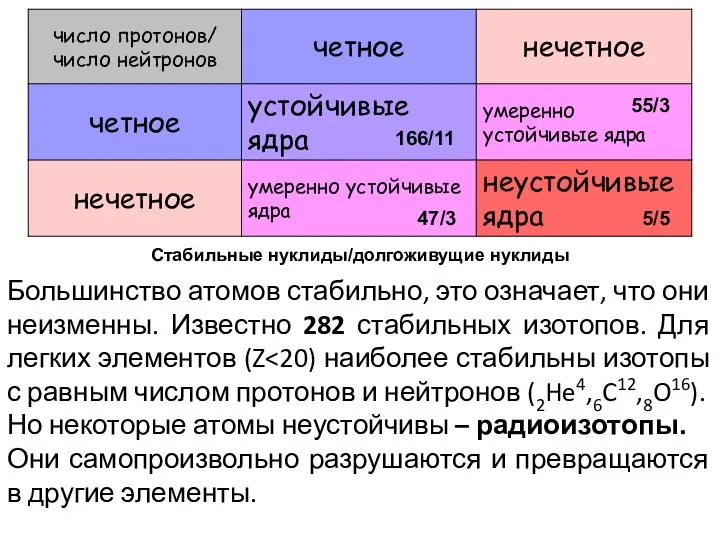
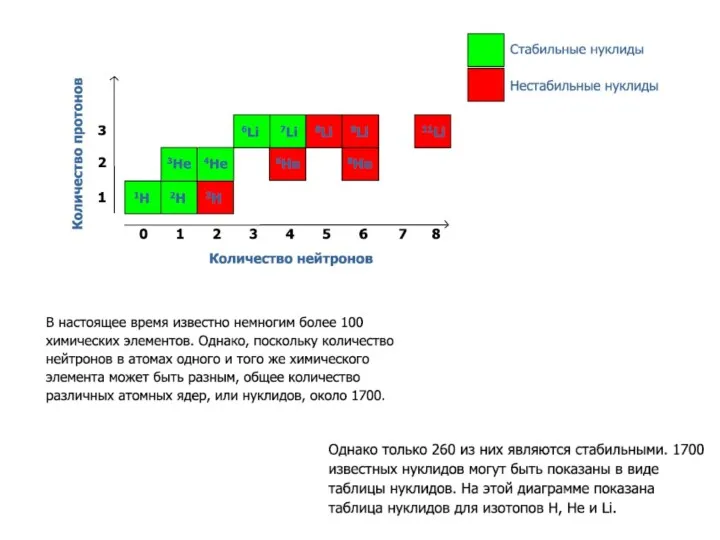
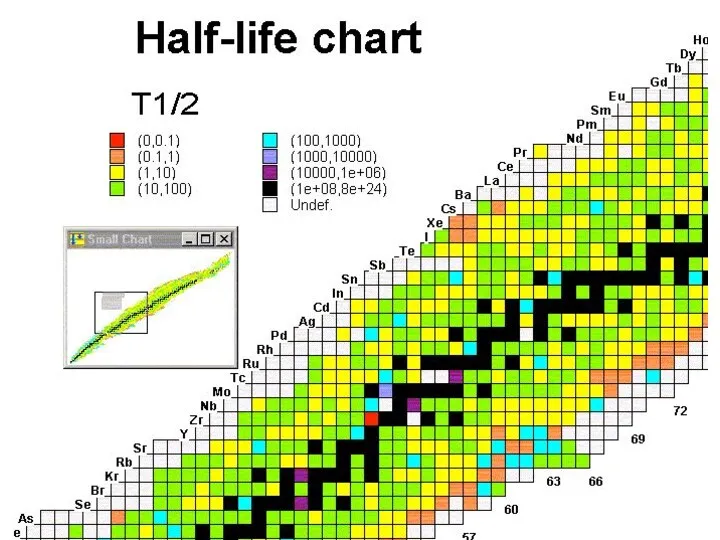
- 22. Большинство атомов стабильно, это означает, что они неизменны. Известно 282 стабильных изотопов. Для легких элементов (Z
- 23. Радиоактивность (от лат. radio-излучаю, radius-луч и activus-действенный), самопроизвольное (спонтанное) превращение неустойчивого изотопа химического элемента в другой
- 24. Хронометр Э. Резерфорда Настуран или U руда, богатая UO2 (Африка) λU ~ 1.5x10-10 U 8α 1
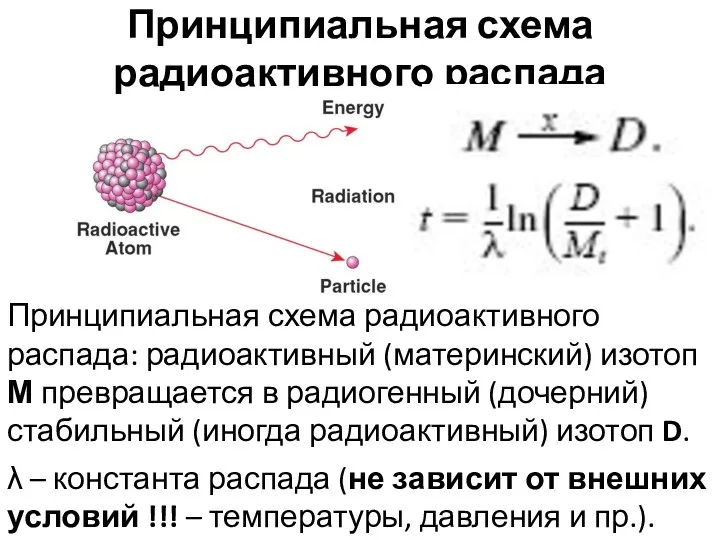
- 25. Принципиальная схема радиоактивного распада λ – константа распада (не зависит от внешних условий !!! – температуры,
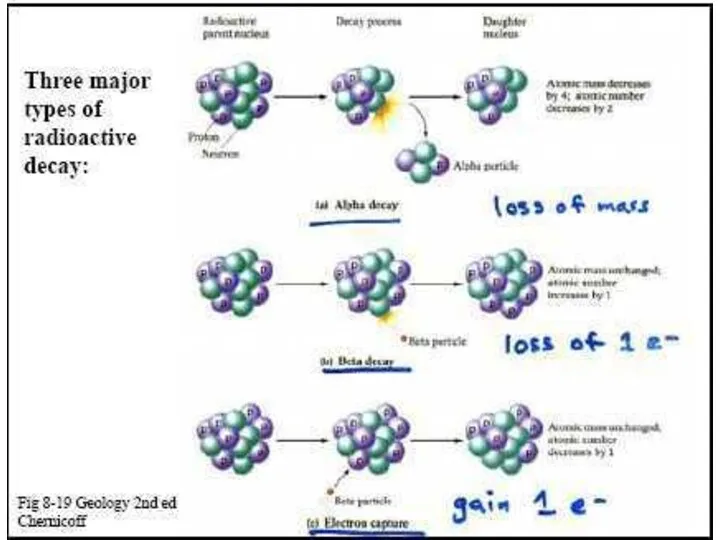
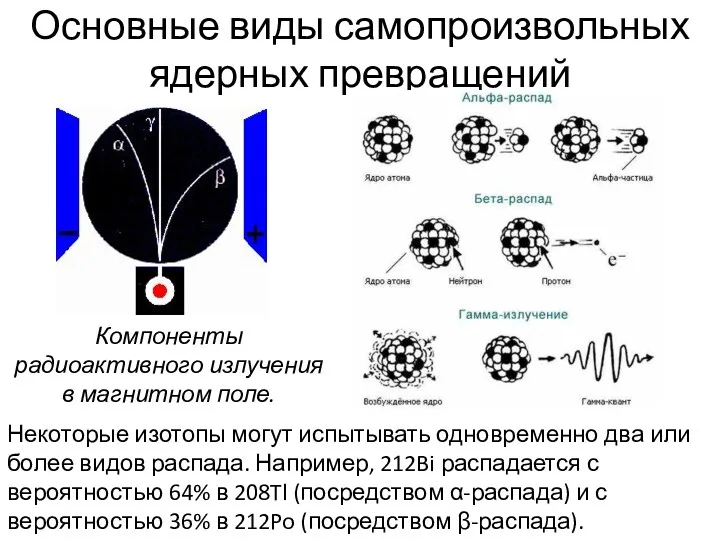
- 27. Компоненты радиоактивного излучения в магнитном поле. Основные виды самопроизвольных ядерных превращений Некоторые изотопы могут испытывать одновременно
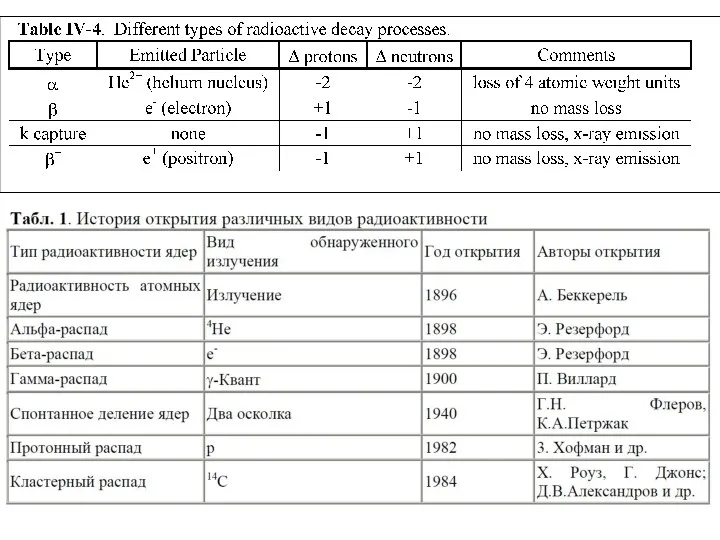
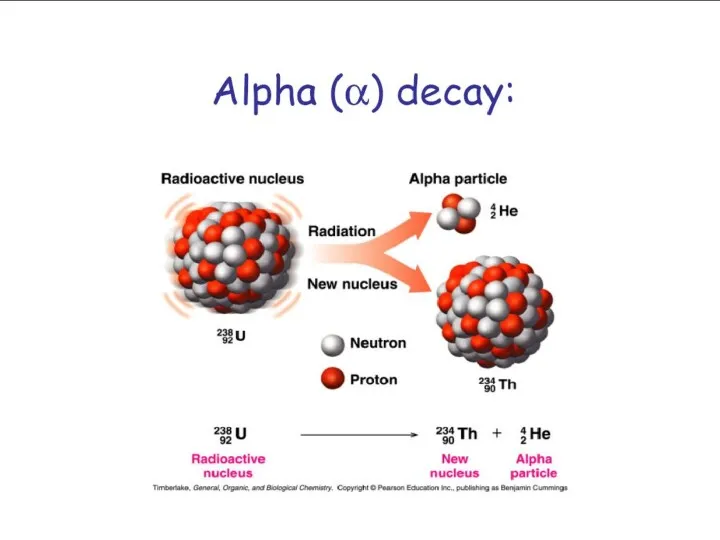
- 29. α-распад Ядро испускает α-частицу, которая представляет собой ядро атома гелия (4He) и состоит из двух протонов
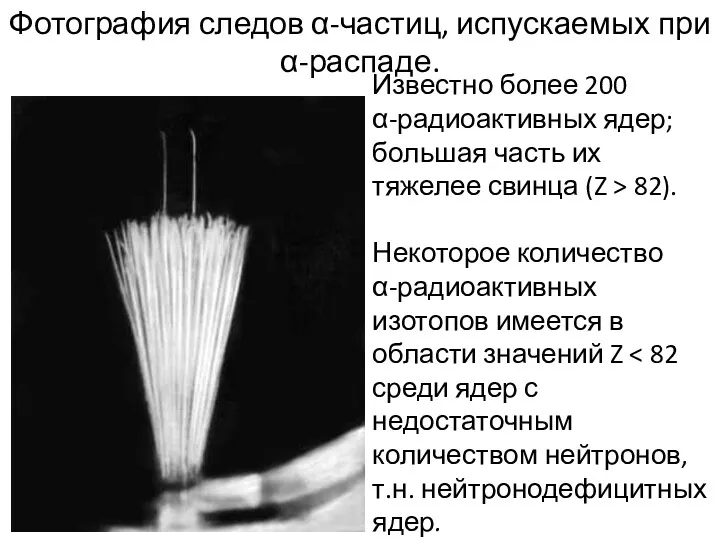
- 31. Фотография следов α-частиц, испускаемых при α-распаде. Известно более 200 α-радиоактивных ядер; большая часть их тяжелее свинца
- 32. Три типа β-распада: 1. β- электронный распад В неустойчивом ядре нейтрон превращается в протон, при этом
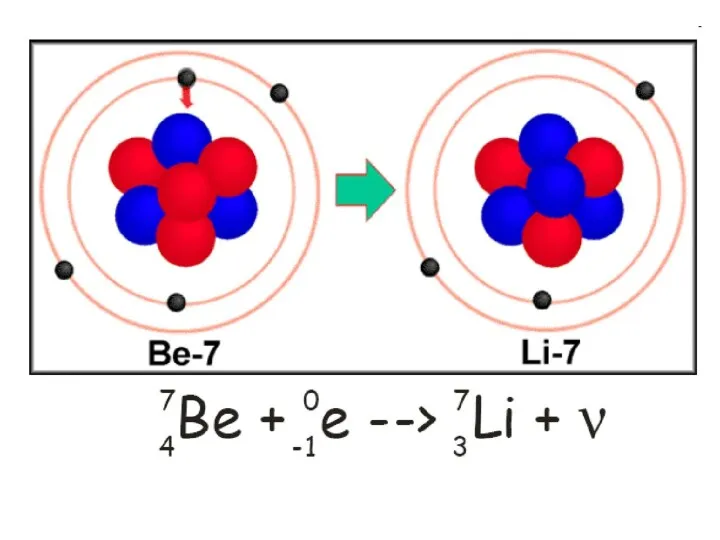
- 34. Явление электронного захвата противоположно β-распаду: электрон с нижнего К-уровня поглощается ядром, то есть протон в ядре
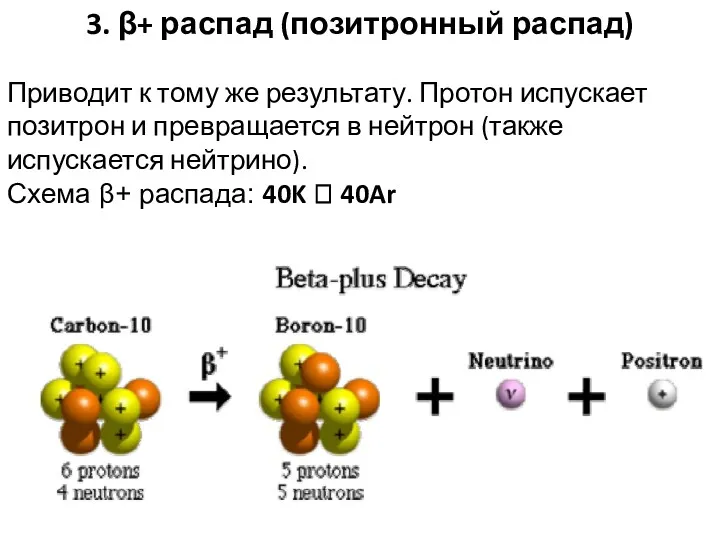
- 36. 3. β+ распад (позитронный распад) Приводит к тому же результату. Протон испускает позитрон и превращается в
- 37. Спонтанное деление (кластерная радиоактивность) Наблюдается только у ядер тяжелых элементов с Z≥90. При этом типе радиоактивности
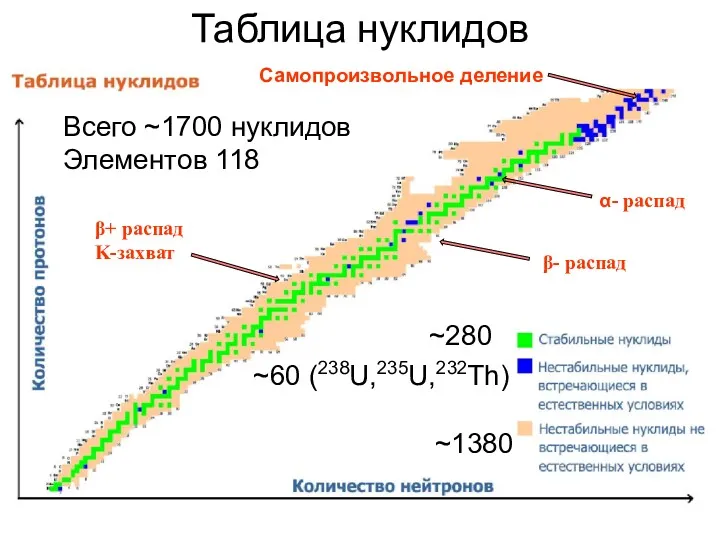
- 39. Таблица нуклидов ~280 ~60 (238U,235U,232Th) ~1380 Всего ~1700 нуклидов Элементов 118 Самопроизвольное деление β- распад β+
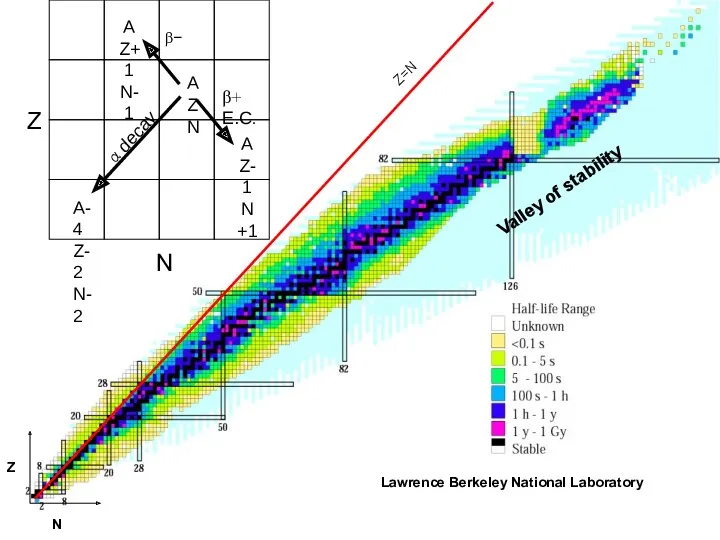
- 40. Valley of stability
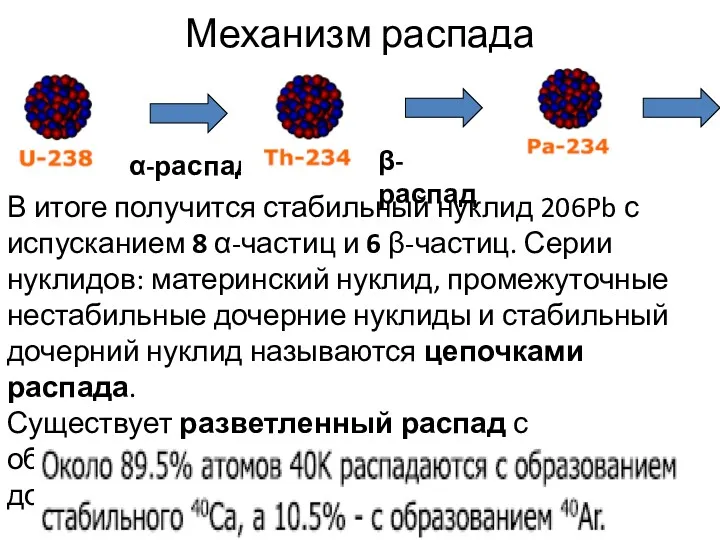
- 41. Механизм распада α-распад β- распад В итоге получится стабильный нуклид 206Pb с испусканием 8 α-частиц и
- 43. Закон радиоактивного распада -dN/dt ~ N, dN/dt – скорость изменения числа атомов родительского нуклида “-” скорость
- 44. Example of exponential decay…. Duration of race: N riders D crashes λ = probability of a
- 45. N – число радиоактивных родительских атомов, которое осталось к моменту времени t от N0 - первоначального
- 46. D*=N0-N => D*=N0-N0e –λt => D*= N0(1-e-λt), где D* - количество радиогенного изотопа. Обычно удобнее сравнивать
- 48. Это справедливо при соблюдении следующих условий: Система должна быть закрытой, то есть минерал или порода не
- 49. Как вычислить возраст минерала (породы)? Вычисленный возраст является истинным, только если минерал (порода) представлял собой все
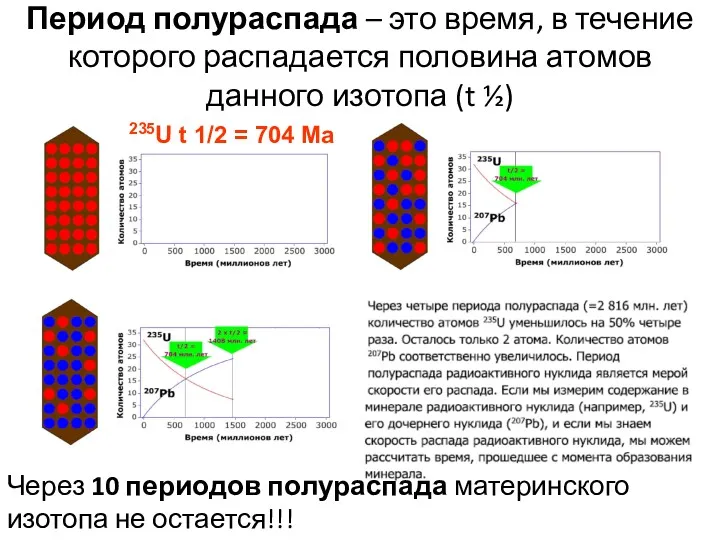
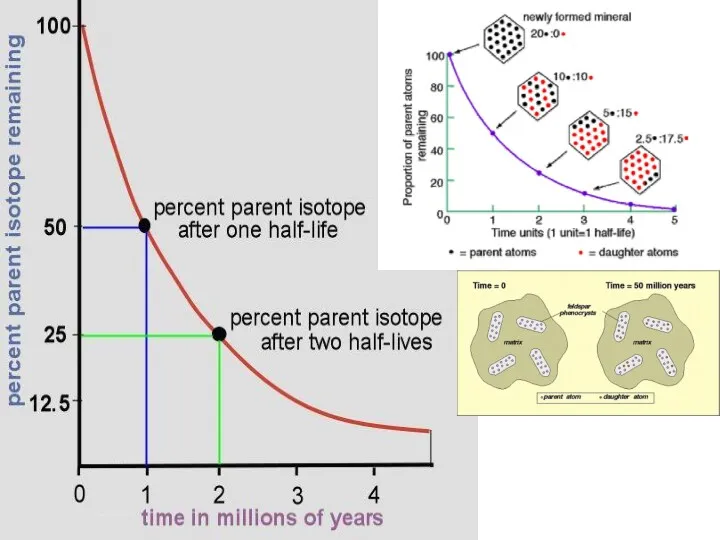
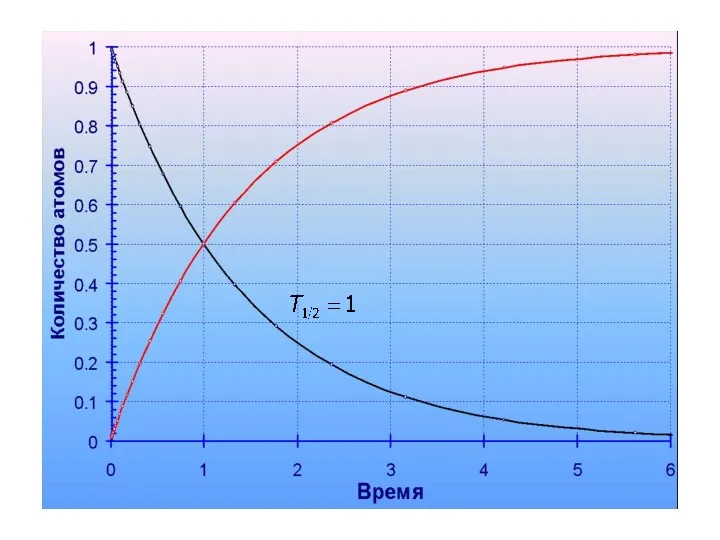
- 50. Период полураспада – это время, в течение которого распадается половина атомов данного изотопа (t ½) 235U
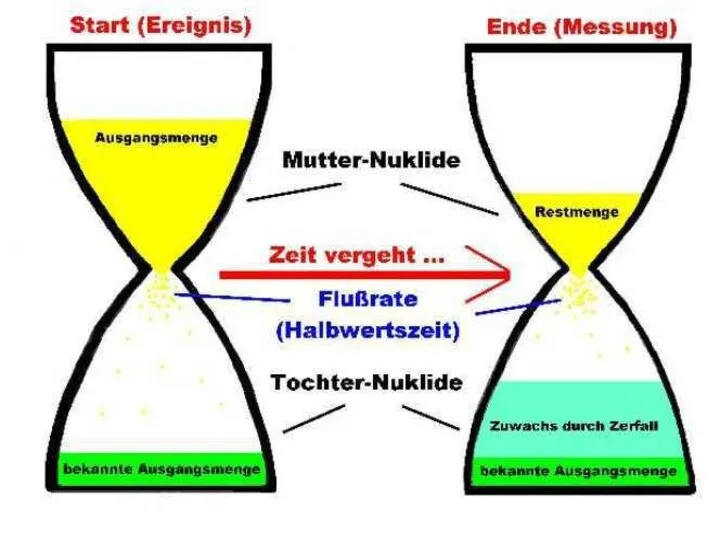
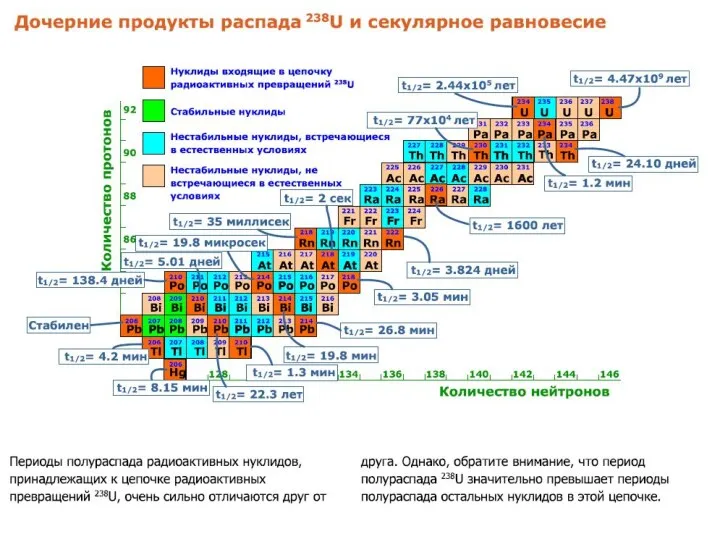
- 54. Цепочки радиоактивных превращений
- 57. Скачать презентацию





























 Решение различных задач по данным ДЗЗ
Решение различных задач по данным ДЗЗ Рельеф Земли. Равнины
Рельеф Земли. Равнины Самые красивые места мира
Самые красивые места мира Республика Перу
Республика Перу Север Европы
Север Европы Схема проезда
Схема проезда Природные зоны планеты
Природные зоны планеты Природные зоны Южной Америки
Природные зоны Южной Америки Озера, подземные воды, ледники, болота
Озера, подземные воды, ледники, болота America. Maintenance
America. Maintenance Агинский район
Агинский район Подземные воды и природные льды
Подземные воды и природные льды Колчеданные месторождения
Колчеданные месторождения Топографическая подготовка туриста
Топографическая подготовка туриста Мировые природные ресурсы
Мировые природные ресурсы Город как среда обитания
Город как среда обитания Табиғи ресурстар
Табиғи ресурстар Метаморфизм. Лекция 8
Метаморфизм. Лекция 8 Португалия
Португалия Что изучает география. Обобщение знаний
Что изучает география. Обобщение знаний Табиғат ресурстары дегеніміз
Табиғат ресурстары дегеніміз Роль международного туризма в мировом хозяйстве
Роль международного туризма в мировом хозяйстве Восточно- Сибирский экономический район
Восточно- Сибирский экономический район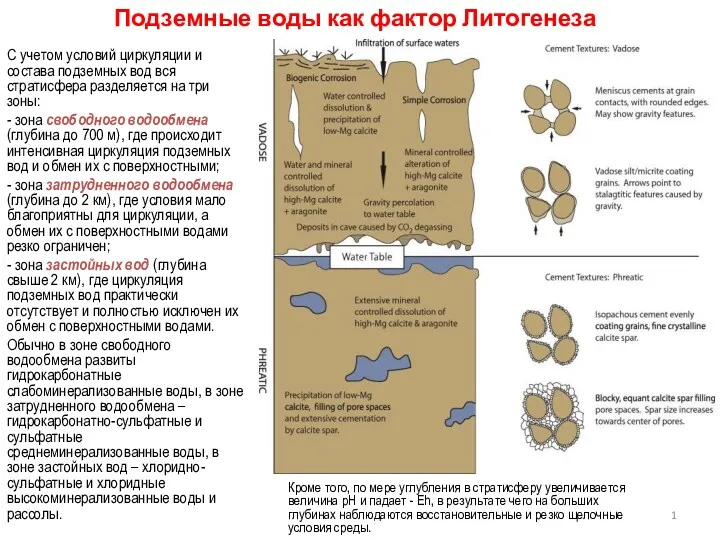 Подземные воды как фактор литогенеза
Подземные воды как фактор литогенеза Разрывные нарушения
Разрывные нарушения География природных ресурсов мира. 10 класс
География природных ресурсов мира. 10 класс Метеорологические приборы
Метеорологические приборы Народы дальнего зарубежья. Национально-психологические особенности
Народы дальнего зарубежья. Национально-психологические особенности