Содержание
- 2. 29.10.2016 Годы жизни Родился в Париже 8 октября 1850 года Умер 17 сентября 1936 Его отец,
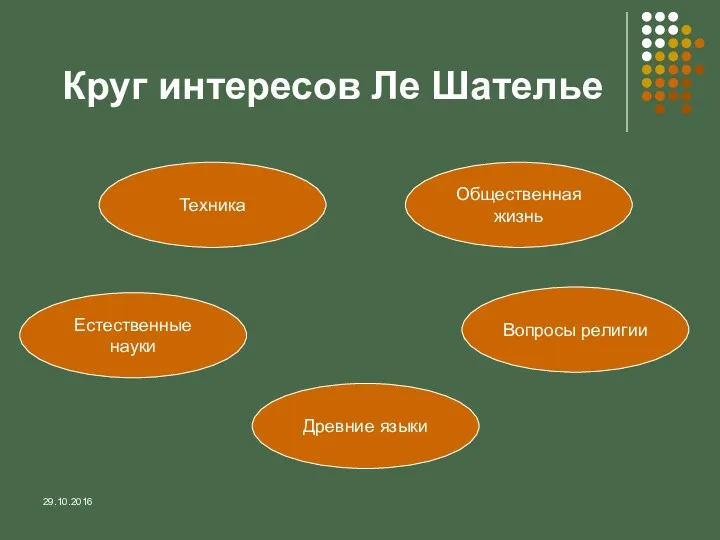
- 3. 29.10.2016 Круг интересов Ле Шателье Техника Естественные науки Древние языки Вопросы религии Общественная жизнь
- 4. 29.10.2016 Преподавательская деятельность С 1877 по 1919г. профессор Парижской Высшей горной школы, где преподавал общую и
- 5. 29.10.2016 Научная деятельность При активном участии Ле Шателье физическая химия и химическая технология превратились в самостоятельные,
- 6. 29.10.2016 1880г Ле Шателье занимался проблемой обжига и затвердевания цемента; имевшиеся к тому времени исследования не
- 7. 29.10.2016 Колба Ле Шателье. Для определения удельного веса гидравлического цемента и извести
- 8. 29.10.2016 Кольцо Ле Шателье Для определения равномерности изменения объема цемента и гашеной извести.
- 9. 29.10.2016 1881г Совместно с М. Бертло и Ф. Малларом он занялся исследованиям процессов воспламенения, горения и
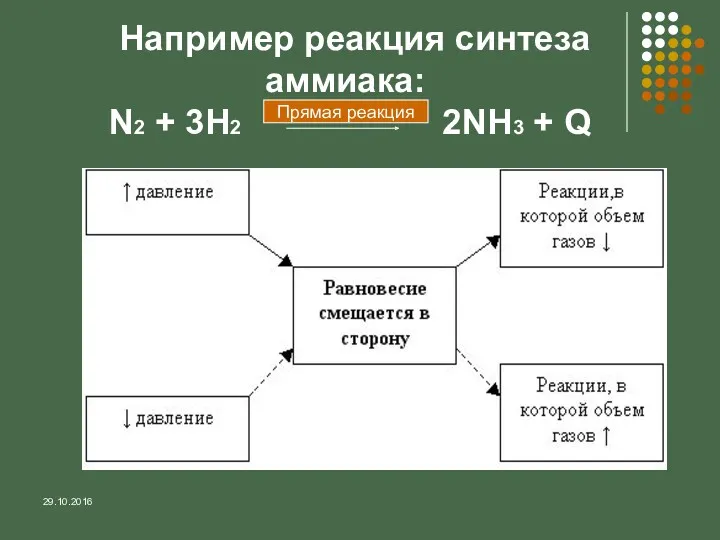
- 10. 29.10.2016 1884 Сформулировал общий закон смещения химического равновесия в зависимости от внешних факторов: Внешнее воздействие, которое
- 11. 29.10.2016 Принцип Ле Шателье если на систему, находящуюся в равновесии, оказывается внешнее воздействие (изменяется концентрация, температура,
- 12. 29.10.2016 Например реакция синтеза аммиака: N2 + 3H2 2NH3 + Q Прямая реакция
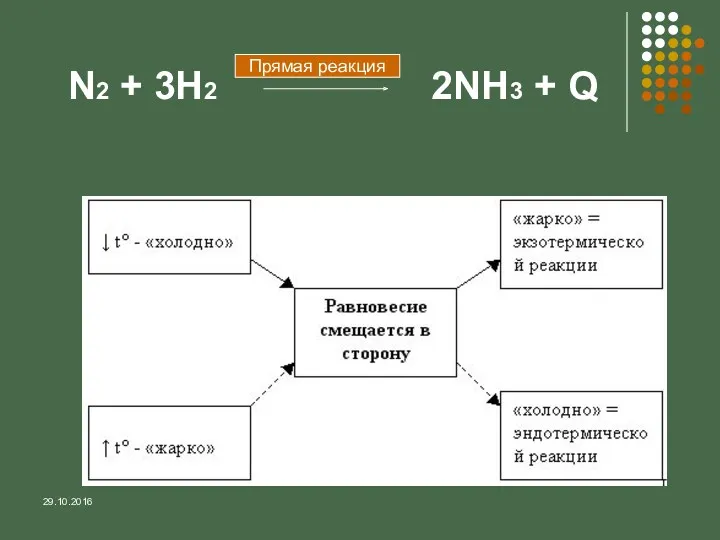
- 13. 29.10.2016 N2 + 3H2 2NH3 + Q Прямая реакция
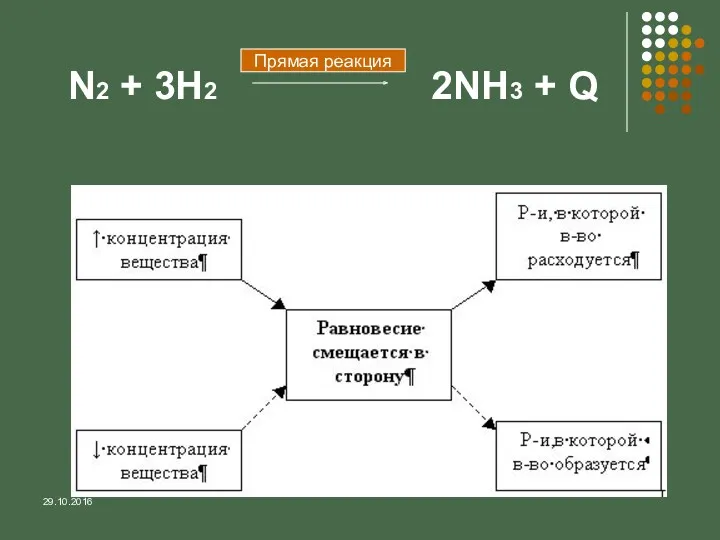
- 14. 29.10.2016 N2 + 3H2 2NH3 + Q Прямая реакция
- 15. 29.10.2016 Выводы: При повышении концентрации реагирующих веществ равновесие смещается в сторону образования продуктов; При повышении концентрации
- 16. 29.10.2016 1886г Разработал пирометр – оптический прибор, измеряющий температуру раскалённых тел по их цвету. Усовершенствовал методику
- 17. 29.10.2016 1897 Создал металлографический микроскоп , с помощью которого можно было изучать строение непрозрачных объектов. Современный
- 18. 29.10.2016 1894г Вывел уравнение, устанавливающие зависимость между растворимостью, температурой процесса и теплотой плавления вещества. Независимо от
- 19. 29.10.2016 Награды: в 1886г кавалер ордена Почётного легиона 1916г. медаль Дэви Лондонского королевского общества
- 21. Скачать презентацию














 Виртуальная выставка современной художественной литературы на английском языке
Виртуальная выставка современной художественной литературы на английском языке Викторина по повести - сказке Л. Лагина Старик Хоттабыч
Викторина по повести - сказке Л. Лагина Старик Хоттабыч Автор в художественном произведении
Автор в художественном произведении Бунин Иван Алексеевич
Бунин Иван Алексеевич Марк Твен (1838-1910)
Марк Твен (1838-1910) Биография Лермонтова М.Ю.
Биография Лермонтова М.Ю. Кто хочет стать пятионером? Литературная игра по сказкам М.Е. Салтыкова-Щедрина
Кто хочет стать пятионером? Литературная игра по сказкам М.Е. Салтыкова-Щедрина Звук [И ] и буква и
Звук [И ] и буква и Сонет как форма лирической поэзии. Сонеты Шекспира. 8 класс
Сонет как форма лирической поэзии. Сонеты Шекспира. 8 класс Поэма Мёртвые души. Замысел, история создания. Особенности жанра и композиции
Поэма Мёртвые души. Замысел, история создания. Особенности жанра и композиции Сельма Оттилия Ловиса Лагерлёф (1858—1940)
Сельма Оттилия Ловиса Лагерлёф (1858—1940) Рыгор Барадулін
Рыгор Барадулін Без слова немає мови, а без мови – книги…
Без слова немає мови, а без мови – книги… Сценарий игры сто к одному по родному языку (бурятский язык как государственный)
Сценарий игры сто к одному по родному языку (бурятский язык как государственный) Уральский писатель Дмитрий Наркисович Мамин-Сибиряк
Уральский писатель Дмитрий Наркисович Мамин-Сибиряк Образ няни в произведениях русской литературы.
Образ няни в произведениях русской литературы. Михаил Сергеевич Горбачёв
Михаил Сергеевич Горбачёв Рафаель Санті (1483 -1520)
Рафаель Санті (1483 -1520) Презентация Развитие живописи и музыки в 60-е годы. 11 класс
Презентация Развитие живописи и музыки в 60-е годы. 11 класс Проект: Весёлая азбука. Буква Л.
Проект: Весёлая азбука. Буква Л. Жанр. Заметка
Жанр. Заметка С.А.Есенин. Лебёдушка.
С.А.Есенин. Лебёдушка. ОГЭ. Работаем над заданиями. Части 3 (15.1, 15.2, 15.3)
ОГЭ. Работаем над заданиями. Части 3 (15.1, 15.2, 15.3) Любовная лирика Александра Сергеевича Пушкина
Любовная лирика Александра Сергеевича Пушкина Урок-игра по роману А.С.Пушкина Дубровский
Урок-игра по роману А.С.Пушкина Дубровский Патриарх Кирилл
Патриарх Кирилл Наполеон Орда
Наполеон Орда Владимир Иванович Даль
Владимир Иванович Даль