Содержание
- 2. ОСНОВНІ ХІМІЧНІ ПОНЯТТЯ ТА СТЕХІОМЕТРИЧНІ ЗАКОНИ ХІМІЇ Старший викладач кафедри харчової хімії Чебаненко Христина Володимирівна email:
- 3. ЗМІСТ 1. ПРЕДМЕТ ХІМІЇ. 2. РЕЧОВИНИ, ЇХ КЛАСИФІКАЦІЯ 3. СКЛАД РЕЧОВИНИ 4. ХІМІЧНИЙ ЕЛЕМЕНТ 5. ВАЛЕНТНІСТЬ
- 4. Що вивчає хімія Хімія – це природнича наука про склад, властивості і будову речовин, про їхні
- 5. ПРЕДМЕТ ХІМІЇ Будову речовин вивчає структурна хімія і, зокрема : стереохімія - вивчає просторову будову молекул
- 6. СКІЛЬКИ ХІМІЙ НА СВІТІ? Загальна хімія - вивчає загальнотеоретичні питання хімії Неорганічна хімія - займається вивченням
- 7. Фізична хімія використовує фізичні методи для вивчення хімічних систем. Важливе місце в ній займають питання енергетики
- 8. Біохімія вивчає складні хімічні процеси, що протікають в живих організмах Харчова хімія - розділ дослідної хімії,
- 9. ПРЕДМЕТ ХІМІЇ Речовина – це будь-який вид матерії, що володіє власною масою (масою спокою). Такі речовини
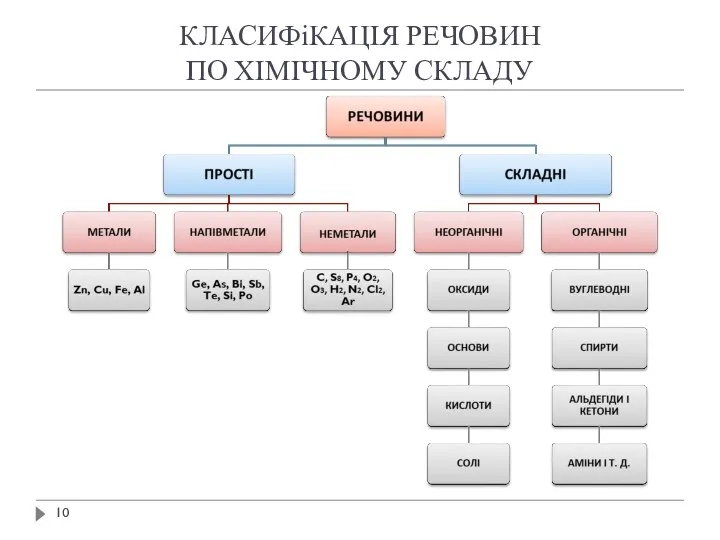
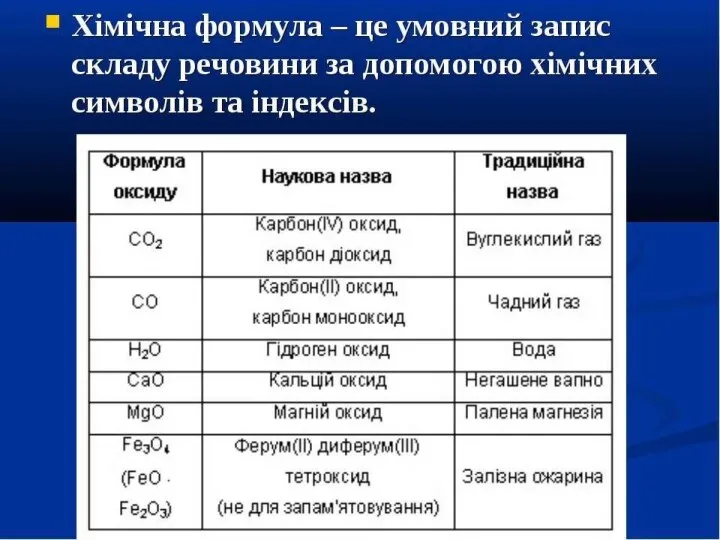
- 10. КЛАСИФіКАЦІЯ РЕЧОВИН ПО ХІМІЧНОМУ СКЛАДУ
- 11. ПРОСТІ ТА СКЛАДНІ РЕЧОВИНИ Прості речовини утворені атомами одного хімічного елемента і тому є формою його
- 12. Проста речовина гентриаконтацикло-[29.29.0.02,14. 03,12.04,59.05,10. 06,58.07,55.08,53. 09,21.011,20.013,18. 015,30.016,28.017,25. 019,24.022,52.023,50. 026,49.027,47.029,45. 032,44.033,60.034,57. 035,43.036,56.037,41. 038,54.039,51.040,48. 042,46]-гексаконта-1,3,5(10),6,8,11, 13(18),14,16,19, 21,23,25,27,29(45), 30,32(44),33,35(43),
- 13. Прості та складні речовини Агрегатний стан
- 14. АТОМНО-МОЛЕКУЛЯРНА ТЕОРІЯ Згідно з атомно-молекулярною теорією: 1. Речовини мають дискретну будову. Вони складаються із частинок (структурних
- 15. ТЕОРІЯ ДЖ. ДАЛЬТОНА (1808) 4. МІЖ СКЛАДОВИМИ ЧАСТИНКАМИ РЕЧОВИНИ Є ВІДСТАНІ. 5. МОЛЕКУЛИ СКЛАДАЮТЬСЯ З АТОМІВ.
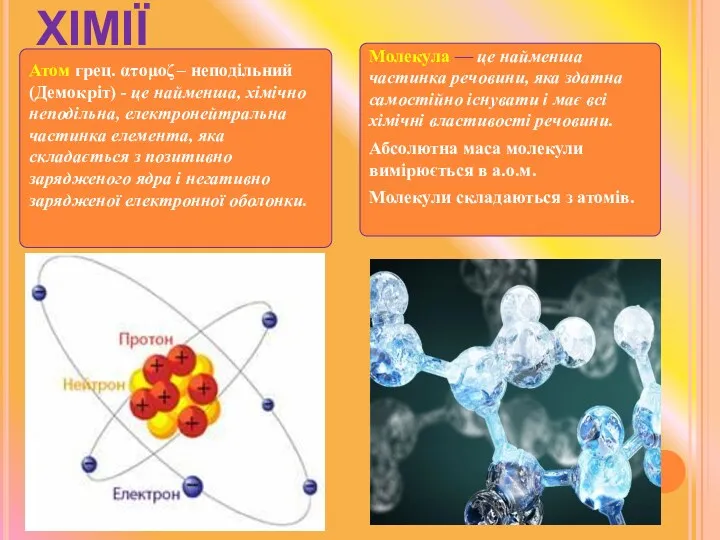
- 16. ОСНОВНІ ПОНЯТТЯ ХІМІЇ Атом грец. ατομοζ – неподільний (Демокріт) - це найменша, хімічно неподільна, електронейтральна частинка
- 17. Маса атомів і молекул дуже мала, 10-24 – 10-23 г Наприклад, маса атома Гідрогену m(H) =
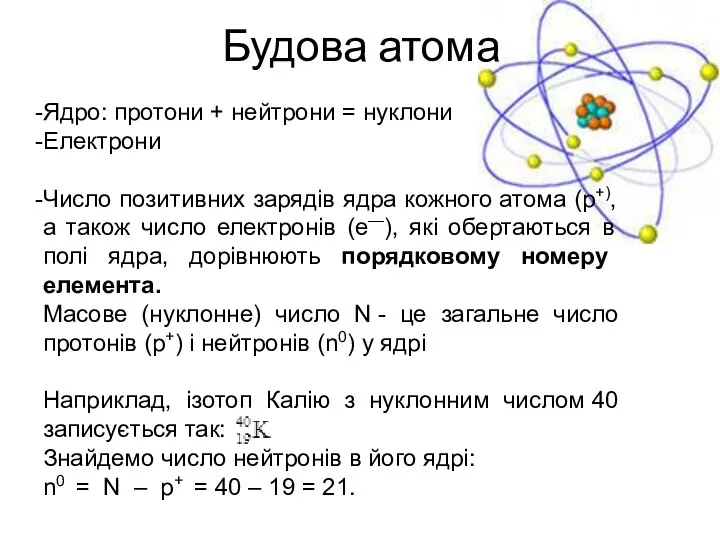
- 18. Будова атома Ядро: протони + нейтрони = нуклони Електрони Число позитивних зарядів ядра кожного атома (p+),
- 19. Види атомів Хімічний елемент (лат. elementum – частина чогось) – це вид атомів з однаковим зарядом
- 20. Іон – позитивно або негативно заряджена частинка, утворена при відаванні або приєднанні атомом або групою атомів
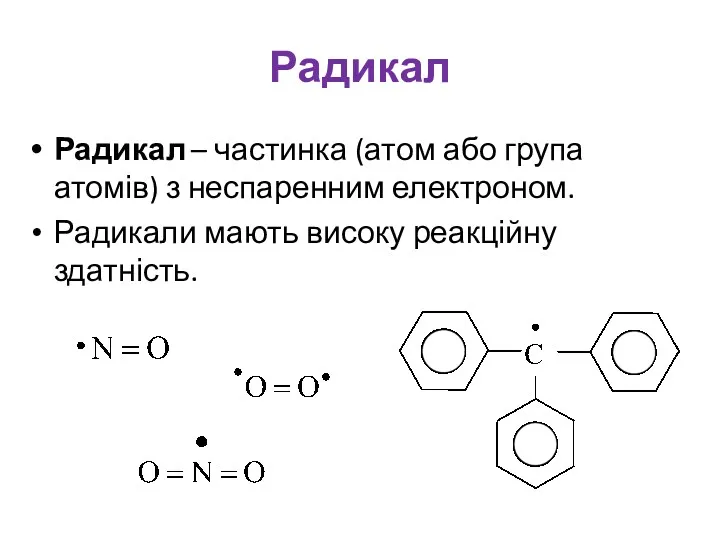
- 21. Радикал Радикал – частинка (атом або група атомів) з неспаренним електроном. Радикали мають високу реакційну здатність.
- 23. Валентність Валентність - це властивість атомів хімічного елемента з'єднуватися з певним числом атомів того самого або
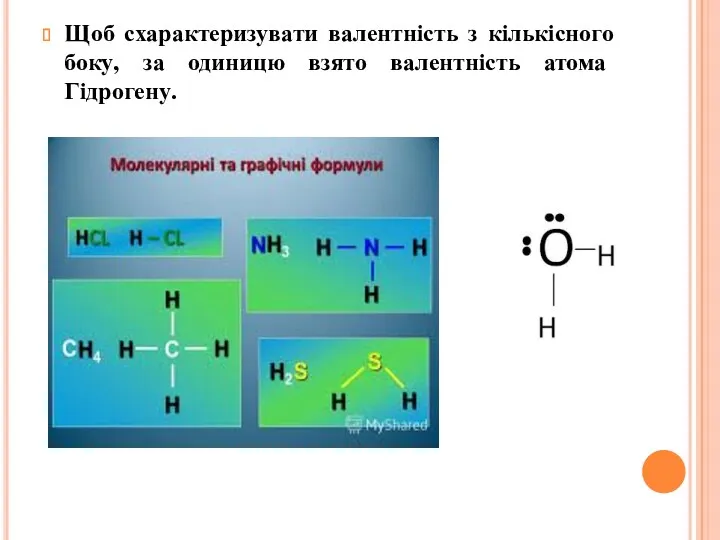
- 24. Щоб схарактеризувати валентність з кількісного боку, за одиницю взято валентність атома Гідрогену.
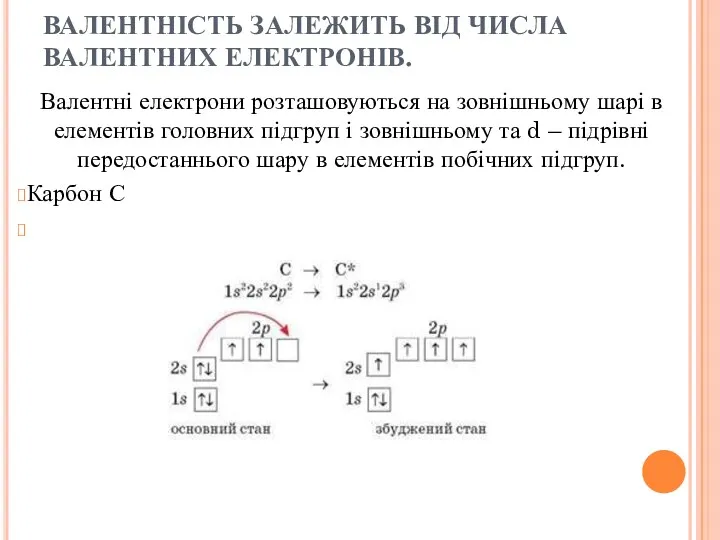
- 25. ВАЛЕНТНІСТЬ ЗАЛЕЖИТЬ ВІД ЧИСЛА ВАЛЕНТНИХ ЕЛЕКТРОНІВ. Валентні електрони розташовуються на зовнішньому шарі в елементів головних підгруп
- 26. Вища (максимальна) валентність здебільшого збігається з номером групи хімічного елемента. Мінімальну валентність неметалів можна визначити по
- 27. ВАЛЕНТНОСТІ АТОМІВ ХІМІЧНИХ ЕЛЕМЕНТІВ
- 28. 4. Визначити і записати найменше спільне кратне валентностей для двох елементів 5. Розрахувати валентність невідомого елемента
- 29. АЛОТРОПІЯ Алотропія – явище здатності хімічного елемента утворювати декілька простих речовини, які відрізняються кількістю атомів в
- 30. Алотропні модифікації Станума: α-Sn (сіре олово, напівпровідник із структурою алмаза) і β-Sn (звичайне біле олово, типовий
- 31. Алотропні модифікації фосфора Р: білий (жовтий), червоний, чорний фосфор
- 32. Алотропні модифікації Сульфуру (S): ромбічна, моноклінна и пластична (аморфна) сірка Алотропні модифікації Оксигена (О): молекулярний кисень
- 33. Ar показує у скільки разів маса атома даного елемента більша 1/12 частини маси ізотопа 12С 1
- 34. Відносна молекулярна маса Мr – це маса молекули, виражена в атомних одиницях маси. Молярна маса (М)
- 35. КІЛЬКІСТЬ РЕЧОВИНИ Кількість речовини - це фізична величина, що визначається числом частинок – структурних елементів речовини:
- 36. Моль – це кількість речовини, що містить стільки частинок – структурних елементів речовини (молекул, атомів, іонів),
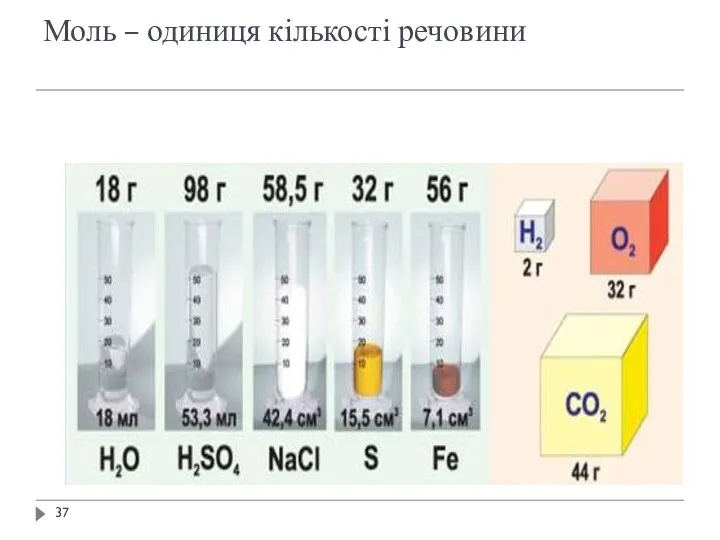
- 37. Моль – одиниця кількості речовини
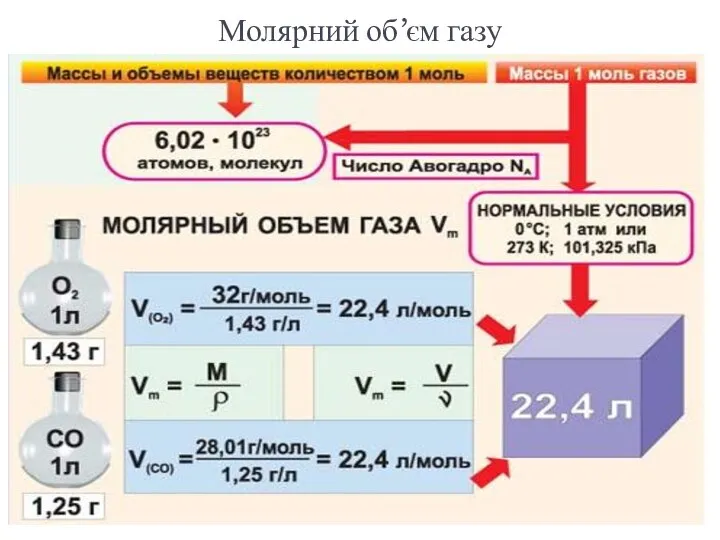
- 38. 1 моль це: 6,02•1023 частинок маса речовини в грамах, яка чисельно дорівнює молярній масі речовини 22,4
- 39. Молярний об’єм газу
- 40. Основні величини
- 41. ЗАСТОСУВАННЯ Ця фізична величина використовується для вимірювання макроскопічних кількостей речовин в тих випадках, коли для чисельного
- 42. ПРИ ОПИСІ ХІМІЧНИХ РЕАКЦІЙ, КІЛЬКІСТЬ РЕЧОВИНИ Є ЗРУЧНІШОЮ ВЕЛИЧИНОЮ, НІЖ МАСА, ТАК ЯК МОЛЕКУЛИ ВЗАЄМОДІЮТЬ НЕЗАЛЕЖНО
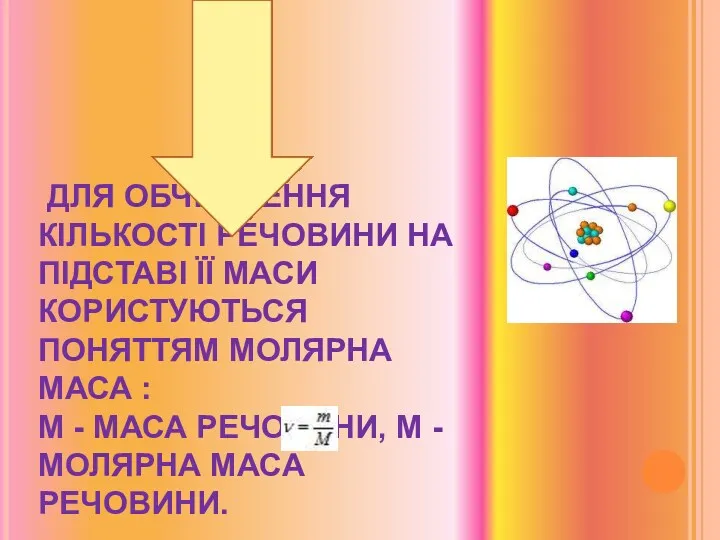
- 43. ДЛЯ ОБЧИСЛЕННЯ КІЛЬКОСТІ РЕЧОВИНИ НА ПІДСТАВІ ЇЇ МАСИ КОРИСТУЮТЬСЯ ПОНЯТТЯМ МОЛЯРНА МАСА : M - МАСА
- 44. Фізичні властивості – ознаки речовин, які можна визначити з допомогою органів відчуттів або приладів (колір, запах,
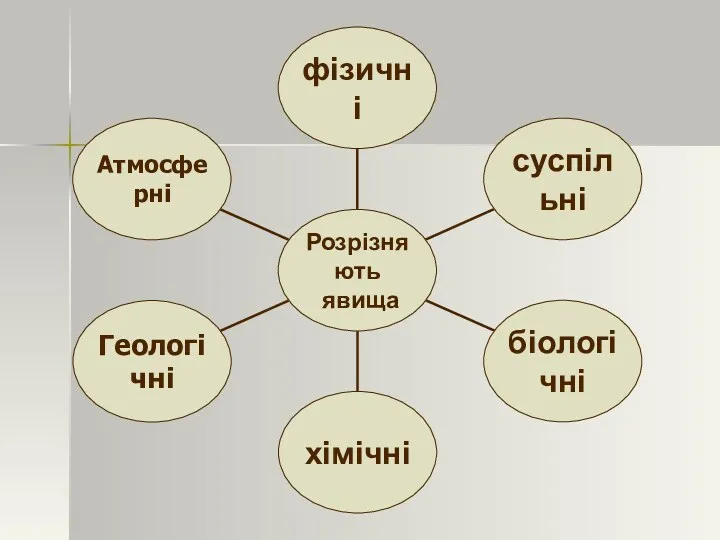
- 45. Будь-які зміни, що відбуваються у світі, називаються явищами.
- 47. Різні науки вивчають різні явища. З речовинами, які вивчає хімія, можуть відбуватися як фізичні, так і
- 49. Скачать презентацию


































 Использование межпредметных связей в преподавании русского языка и литературы
Использование межпредметных связей в преподавании русского языка и литературы Подготовка к написанию отзыва
Подготовка к написанию отзыва Дмитрий Дмитриевич Шостакович. Симфонией № 7
Дмитрий Дмитриевич Шостакович. Симфонией № 7 Роман Л.Н.Толстого Война и мир - проблематика, образы, жанр
Роман Л.Н.Толстого Война и мир - проблематика, образы, жанр Нравственные уроки. Притчи
Нравственные уроки. Притчи Бернард Шоу Пигмалион
Бернард Шоу Пигмалион И.А.Бунин Речной трактир
И.А.Бунин Речной трактир Рылеев Кондратий Фёдорович
Рылеев Кондратий Фёдорович Краткая биография Гавриила Романовича Державина (1743-1816)
Краткая биография Гавриила Романовича Державина (1743-1816) Александр Иванович Куприн
Александр Иванович Куприн Итоговое сочинение в 11 классе 2014 – 2015
Итоговое сочинение в 11 классе 2014 – 2015 Пугачев и народное восстание в романе и историческом труде Пушкина. Народное восстание в авторской оценке
Пугачев и народное восстание в романе и историческом труде Пушкина. Народное восстание в авторской оценке Презентация к работе Детское речевое творчество
Презентация к работе Детское речевое творчество Кроссворд по рассказу Н. Носова Метро
Кроссворд по рассказу Н. Носова Метро Подготовка к итоговому сочинению.
Подготовка к итоговому сочинению. Татар әдәбиятыннан тест.8 нче сыйныф.
Татар әдәбиятыннан тест.8 нче сыйныф. Презентация урока по теме: Сказка Петушок и бобовое зёрнышко. (2 класс)
Презентация урока по теме: Сказка Петушок и бобовое зёрнышко. (2 класс) устное народное творчество
устное народное творчество Что читают мои одноклассники? Проект
Что читают мои одноклассники? Проект Культура Индии
Культура Индии Проект Litkomi. Международный день поэзии
Проект Litkomi. Международный день поэзии Человек во времени. Ян Сатуновский
Человек во времени. Ян Сатуновский Сочинение – описание картины И.Э.Грабаря Февральская лазурь
Сочинение – описание картины И.Э.Грабаря Февральская лазурь Ф.М. Достоевский и мир великих романов
Ф.М. Достоевский и мир великих романов Русские народные песни
Русские народные песни Стихи И.П. Токмаковой
Стихи И.П. Токмаковой Презентация по внеклассному чтению Волшебный мир Френсис Бернет
Презентация по внеклассному чтению Волшебный мир Френсис Бернет Жизнь и творчество А.А. Фета
Жизнь и творчество А.А. Фета