Содержание
- 2. аГУС Хроническое системное заболевание генетической природы, в основе которого лежит неконтролируемая активация альтернативного пути комплемента, ведущая
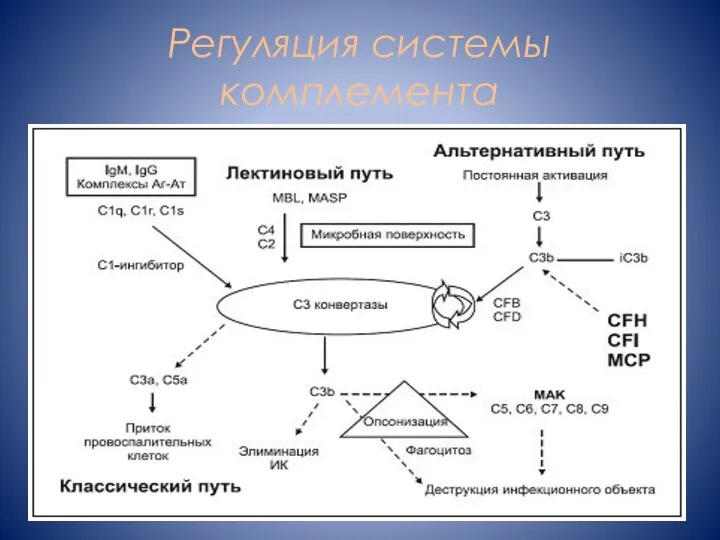
- 3. Регуляция системы комплемента
- 4. Плазменные протеины, регулирующие альтернативный путь CFH MCP THBD CFI
- 5. Фактор комплемента H основной регуляторный фактор альтернативного пути активации комплемента Блокирует образование С3-конвертазы Ускоряет распад С3-конвертазы
- 6. Локальная инактивация альтернативного пути N-концевая часть Регуляция амплификации C-концевая часть Нарушение способности С3b фиксироваться на поверхности
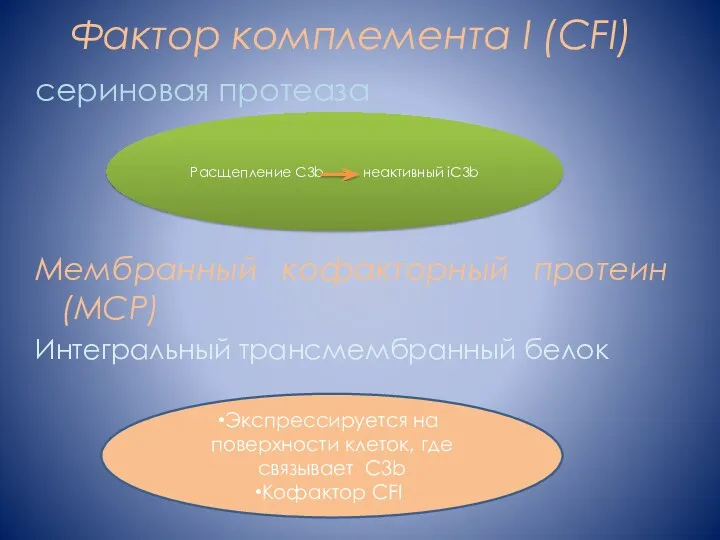
- 7. Фактор комплемента I (CFI) сериновая протеаза Мембранный кофакторный протеин (MCP) Интегральный трансмембранный белок Расщепление C3b неактивный
- 8. Тромбомодулин (thrombomodulin, THBD) эндотелиальный гликопротеин Антикоагулянтное действие Противовоспалительное действие Цитопротективное действие Ускорение инактивации С3b CFI в
- 9. Тромбообразование повреждение с обнажениемсубэндотелиального матрикса, трансформацией атромботического фенотипав протромботический Усиление образования МАК Нарушение защиты эндотелиальных клеток
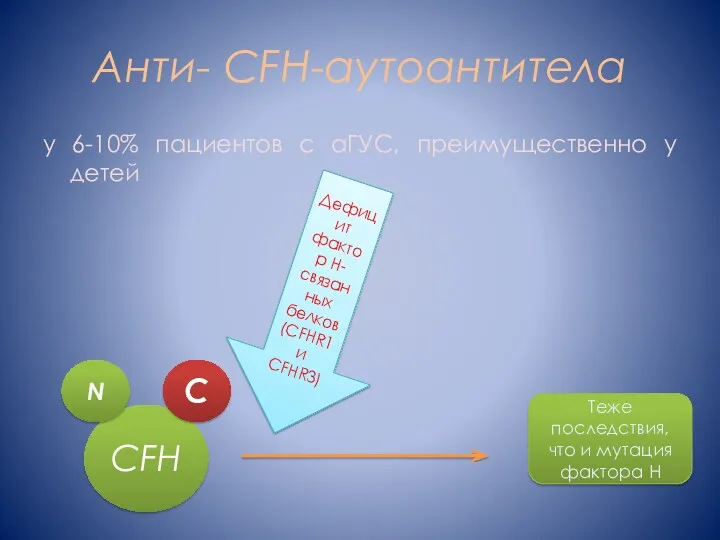
- 10. Анти- CFH-аутоантитела у 6-10% пациентов с аГУС, преимущественно у детей CFH N C Дефицит фактор Н-связанных
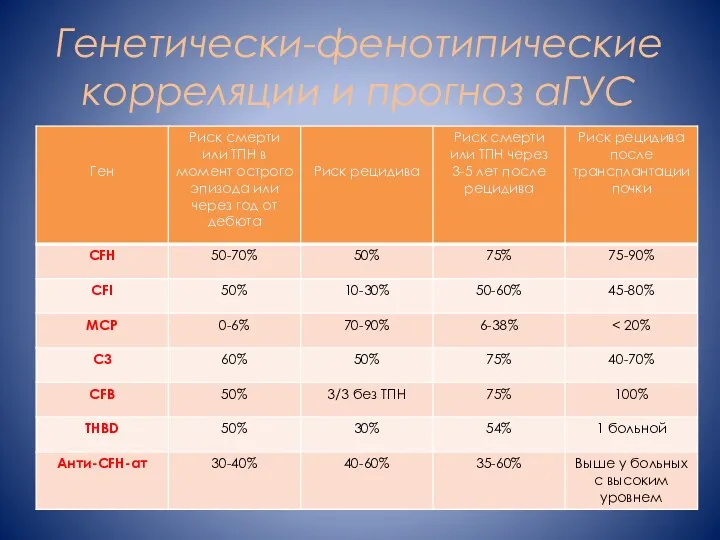
- 11. Генетически-фенотипические корреляции и прогноз аГУС
- 12. Триггерные факторы Инфекции дыхательных путей (ВДП-18%, H1N1, ветряная оспа; ЖКТ (STEC, диарея -23-30% Беременность – 7%
- 13. Классификация аГУС Семейный (диагностируемый по крайней мере у двух членов семьи) 10 - 20% Спорадический (отсутствует
- 14. Клиническая картина Астено-вегетативный синдром (слабость, утомляемость, общее недомогание) Артериальная гипертензия (вследствие перегрузки объемом при наличии олиго/анурии
- 15. Поражение ЖКТ (диарея, тошнота, рвота, адоминальный болевой синдром, колит, гастроэнетрит, развитие острого панкреатита, вплоть до панкреонекроза,
- 16. Диагностика аГУС Диагностика ТМА основана на наличии тромбоцитопении и микроангиопатического гемолиза (МАГА) в сочетании с признаками
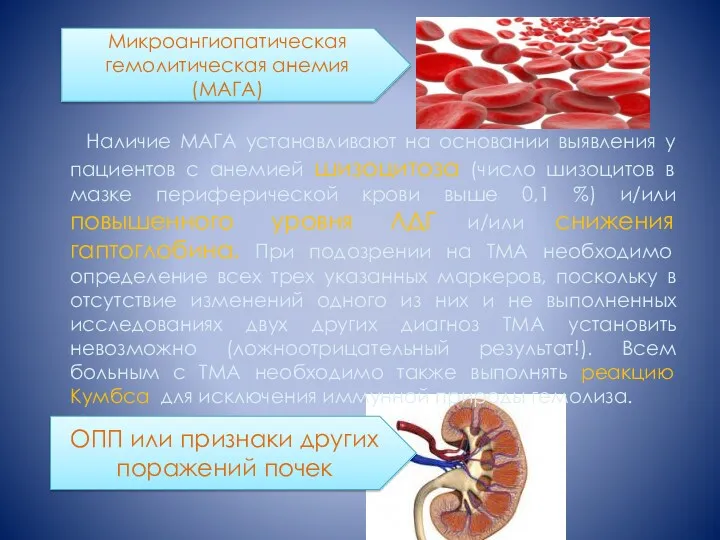
- 17. Наличие МАГА устанавливают на основании выявления у пациентов с анемией шизоцитоза (число шизоцитов в мазке периферической
- 18. В случае констатации ТМА диагноз аГУС можно верифицировать,только исключив STEC-ГУС и ТТП. Диагноз STEC-ГУС может быть
- 19. Всем пациентам с вновь выявленной ТМА необходимо исследовать кровь на содержание С3 и С4 компонентов комплемента.
- 20. Лечение взрослых пациентов с аГУС Все больные с признаками ТМА должны быть госпитализированы в многопрофильные стационары
- 21. Сеансы ПО следует продолжить до нормализации числа тромбоцитов, прекращения гемолиза и улучшения функции почек. В связи
- 22. При отсутствии выраженной тромбоцитопении и кровоточивости у больных аГУС ПТ следует сочетать с назначением гепаринотерапии. Во
- 24. Скачать презентацию
















 Нейротропные средства
Нейротропные средства Заикание. Типы заикания. Диагностика. Лечение
Заикание. Типы заикания. Диагностика. Лечение Раны. Раневой процесс. Лечение ран
Раны. Раневой процесс. Лечение ран Организация питания пациентов в стационаре
Организация питания пациентов в стационаре Дене биомеханикасы туралы түсінік
Дене биомеханикасы туралы түсінік Жүрек-тамыр жүйесі зақымдануларындағы өмірге қауіп кезін анықтау мен жедел жәрдем көрсету
Жүрек-тамыр жүйесі зақымдануларындағы өмірге қауіп кезін анықтау мен жедел жәрдем көрсету Средства, влияющие на функции органов пищеварения
Средства, влияющие на функции органов пищеварения Орталық жүйке жүйесінің электорлық белсенділігі. Электроэнцефалография
Орталық жүйке жүйесінің электорлық белсенділігі. Электроэнцефалография Күйістілерді ценуроз бен эхинококкозға аллергиялық зерттеу
Күйістілерді ценуроз бен эхинококкозға аллергиялық зерттеу Припасовка металлического каркаса мостовидного протеза во рту. Подбор цвета облицовочного материала
Припасовка металлического каркаса мостовидного протеза во рту. Подбор цвета облицовочного материала Блокады сердца
Блокады сердца Стоматологическое материаловедение
Стоматологическое материаловедение Видеотрансляция операции Лабиринт IIIB
Видеотрансляция операции Лабиринт IIIB Гуморальная регуляция (1)
Гуморальная регуляция (1) Острая дыхательная недостаточность
Острая дыхательная недостаточность Relationship of ontogenesis and phylogenesis
Relationship of ontogenesis and phylogenesis SAM иммобилизация таза II
SAM иммобилизация таза II Тұқымқуалайтын ауруларда дәрі-дәрмектер тек симптомдарды жоюға ғана әсер етеді.Ген дефекті сақталады
Тұқымқуалайтын ауруларда дәрі-дәрмектер тек симптомдарды жоюға ғана әсер етеді.Ген дефекті сақталады Bases physiques de l’échographie EPG. Theme 15
Bases physiques de l’échographie EPG. Theme 15 Организмнің бейарнамалы қорғаныш факторлары, сыртқы және ішкі тосқауылдары
Организмнің бейарнамалы қорғаныш факторлары, сыртқы және ішкі тосқауылдары Участие медицинской сестры в работе Школы здоровья для больных ишемической болезнью сердца
Участие медицинской сестры в работе Школы здоровья для больных ишемической болезнью сердца Система крови
Система крови Оборудование в медицинской реабилитции
Оборудование в медицинской реабилитции Физическая и психопрофилактическая подготовка к родам
Физическая и психопрофилактическая подготовка к родам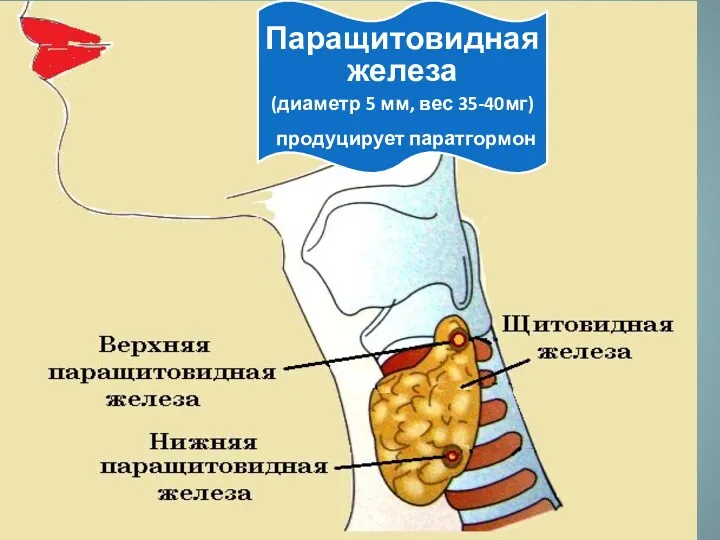 Паращитовидная железа
Паращитовидная железа Сальмонеллез. Этиология
Сальмонеллез. Этиология Проверка зубных паст
Проверка зубных паст Виды перевязок
Виды перевязок