Содержание
- 2. ЛЕКЦИЯ № 3 КЛИНИЧЕСКАЯ ЭНЗИМОЛОГИЯ
- 3. Актуальность темы Широкое использование ферментов в медицинской практике – диагностике и терапии, - диктует необходимость изучения
- 4. План лекции Применение ферментов как реагентов в диагностике Применение ферментов в качестве лекарственных препаратов Исследование активности
- 5. Цель лекции Знать: пути использования ферментов в медицинской практике (примеры) ферменты, используемые в энзимодиагностике, и сущность
- 6. Ферменты как реагенты ПРИМЕРЫ: Глюкозооксидаза грибов (аэробная дегидрогеназа ) – FAD-содержащий специфический фермент для определения глюкозы
- 7. Ферменты как реагенты Определение лактата в крови для оценки тяжести шока, гипоксических состояний, сахарного диабета с
- 8. Ферменты как реагенты Рестриктазы бактерий (специфические эндонуклеазы) используются для исследования генома, например, в пренатальном скрининге наследственных
- 9. Энзимотерапия Применение ферментов (гидролазы) в качестве лекарственных препаратов Заместительная терапия – использование ферментов в случае их
- 10. Энзимотерапия Комплексная терапия – применение ферментов в качестве дополнительного терапевтического средства ПРИМЕРЫ: фитогидролазы: бромелаин, папаин (широкая
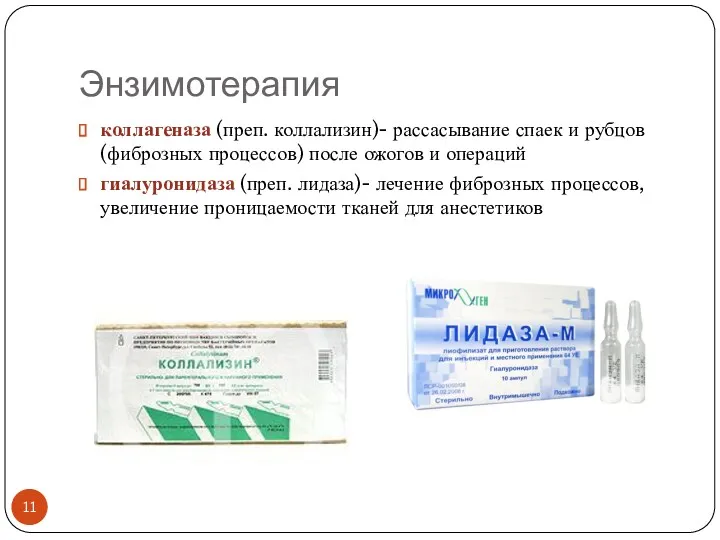
- 11. Энзимотерапия коллагеназа (преп. коллализин)- рассасывание спаек и рубцов (фиброзных процессов) после ожогов и операций гиалуронидаза (преп.
- 12. Энзимотерапия трипсин, химотрипсин – лечение гнойно-некротических ран, эмфиземы легких, бронхита фибринолизин (плазмин)– разрушение тромба при тромбозах
- 13. Энзимотерапия аспарагиназа, глутаминаза – лечение лейкозов Лейкозные клетки не способны синтезировать асн и глн – аминокислоты,
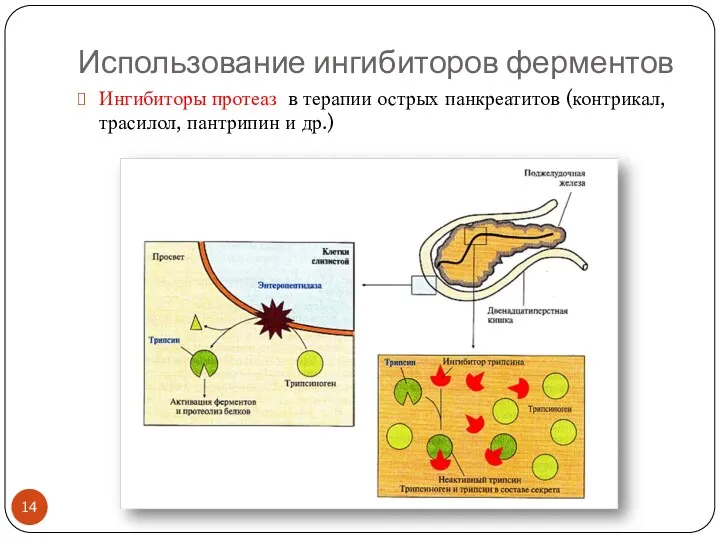
- 14. Использование ингибиторов ферментов Ингибиторы протеаз в терапии острых панкреатитов (контрикал, трасилол, пантрипин и др.)
- 15. Использование ингибиторов ферментов Ингибиторы протеаз в терапии HCV инфекции - новый класс препаратов для лечения гепатита
- 16. Использование ингибиторов ферментов Ингибиторы ангиотензин-превращающего фермента – лечение гипертонии (берлиприл, вазолонг и др.) Ингибиторы ксантиноксидазы –
- 17. Трудности энзимотерапии нестабильность ферментов антигенные свойства трудности доставки к пораженным органам ПРИМЕР: действие фибринолизина не является
- 18. Иммобилизованные ферменты Иммобилизация (лат. immobilis – неподвижный) – связывание молекул ферментов с носителем Преимущества: устойчивость, нерастворимость
- 19. Иммобилизованние ферменты: примеры Иммобилизация протеолитических ферментов на целлюлозе: повязки, тампоны для обработки и лечения ран (см.
- 20. Энзимодиагностика Постановка диагноза на основе определения активности ферментов в биологических жидкостях человека Используются ферменты, которые по
- 21. Секреторные (функциональные) ферменты синтезируются в печени «работают» в крови (субстрат фермента находится в крови) активность в
- 22. Внутриклеточные ферменты: цитоплазматические: лактатдегидрогеназа (ЛДГ), аланин (аспартат) аминотрансфераза (АЛТ, АСТ), креатинкиназа (КК) митохондриальные: АСТ лизосомные: кислая
- 23. Экскреторные ферменты синтезируются в экзокринных железах «работают» в полости органов активность в крови незначительная и обусловлена
- 24. «Требования» к ферментам энзимодиагностики Органоспецифичность (тканеспецифичность) фермента или его изоформ: преимущественная или абсолютная локализация в определенных
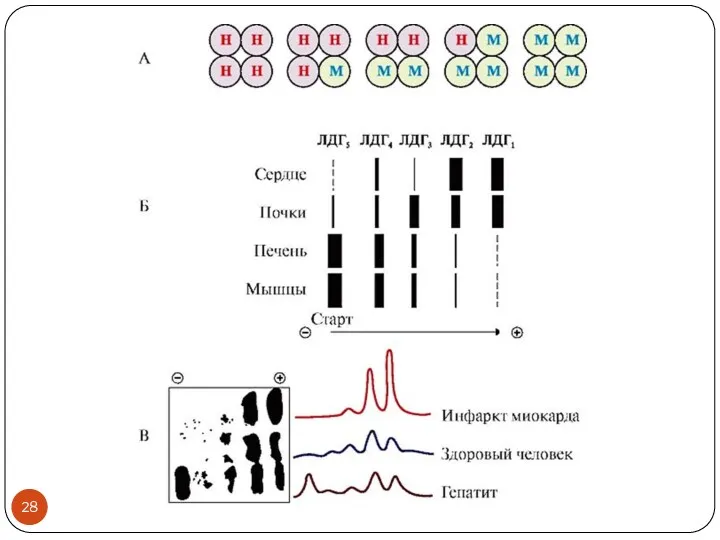
- 25. Изоферменты Множественные формы одного фермента, обусловленные различиями в структуре генов катализируют одну и ту же реакцию
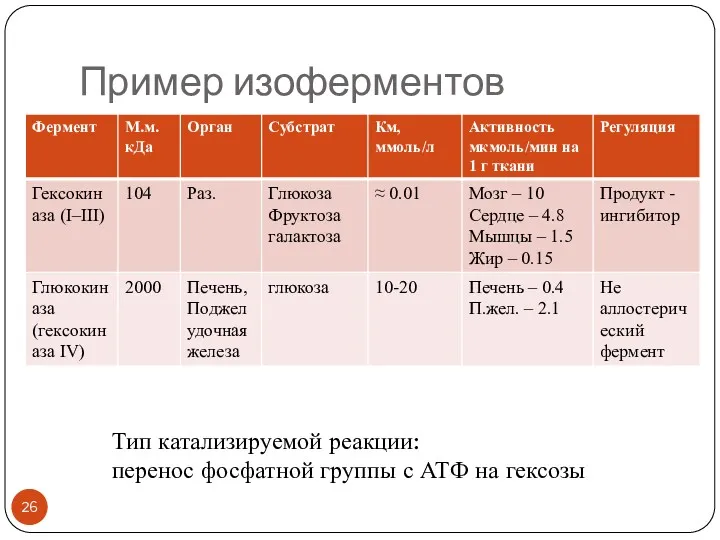
- 26. Пример изоферментов Тип катализируемой реакции: перенос фосфатной группы с АТФ на гексозы
- 27. Изоформы в диагностике Лактатдегидрогеназа (ЛДГ) пируват + NADH ↔ лактат + NAD+ Назовите класс фермента! Диагностика
- 29. Изоформы в диагностике Креатинкиназа (КК) креатин + АТФ → креатинфосфат + АДФ Назовите класс фермента! Креатинфосфат
- 30. КК-ММ (скелетная мышца) – диагностика повреждений скелетных мышц КК-МВ (сердечная мышца) – диагностика инфаркта миокарда КК-ВВ
- 31. Почему важно определять изоферментный состав, а не просто суммарную активность фермента? Суммарная активность фермента не предоставляет
- 32. Основные ферменты энзимодиагностики патологии сердца, сопровождающейся цитолизом, некрозом (инфаркт миокарда) АСТ (аспартатаминотрансфераза) АЛТ (аланинаминотрансфераза) АСТ /
- 33. Основные ферменты энзимодиагностики патологии печени Воспаление, цитолиз, некроз (например, гепатит, цирроз) АЛТ, АСТ Коэффициент де Ритиса
- 34. Основные ферменты энзимодиагностики острого панкреатита Амилаза в крови или диастаза мочи Липаза
- 35. Энзимопатии Патологические процессы, основанные на нарушении ферментативного катализа первичные (наследственные) нарушается образование конечного продукта ПРИМЕР: дефект
- 36. Задание № 1 для самостоятельной работы В современной клинической лабораторной диагностике широко используется метод иммуноферментного анализа
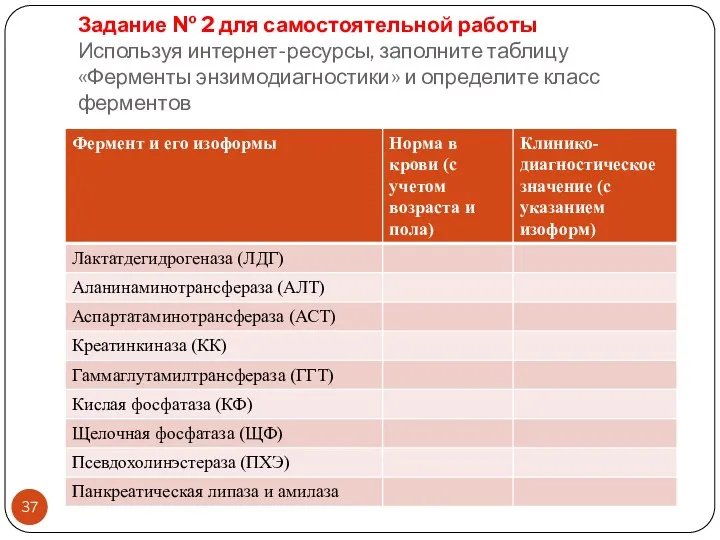
- 37. Задание № 2 для самостоятельной работы Используя интернет-ресурсы, заполните таблицу «Ферменты энзимодиагностики» и определите класс ферментов
- 38. Заключение Ферменты используются в диагностике заболеваний как специфические реагенты Препараты ферментов используются в заместительной и комплексной
- 40. Скачать презентацию































 Офтальмология. Патология вспомогательного аппарата глаза
Офтальмология. Патология вспомогательного аппарата глаза Техника транспортной иммобилизации верхней конечности
Техника транспортной иммобилизации верхней конечности Догоспитальный этап экстренной помощи детям при отеке легких, отеке мозга, отравлении
Догоспитальный этап экстренной помощи детям при отеке легких, отеке мозга, отравлении Гормональные нарушения и хроническая венозная недостаточность
Гормональные нарушения и хроническая венозная недостаточность Классификация звуков
Классификация звуков Профессиональная интоксикация пестицидами
Профессиональная интоксикация пестицидами Инфекции, передающиеся половым путем
Инфекции, передающиеся половым путем Деятельность медицинской сестры в организации ухода за пациентами с повреждениями нижних конечностей
Деятельность медицинской сестры в организации ухода за пациентами с повреждениями нижних конечностей Організація надання медичної допомоги населенню в умовах надзвичайних ситуацій
Організація надання медичної допомоги населенню в умовах надзвичайних ситуацій Утопление и погружение в воду
Утопление и погружение в воду Транспортная иммобилизация
Транспортная иммобилизация Вирусные инфекции. Задачи
Вирусные инфекции. Задачи Гигиена труда в металлургической промышленности. Основные профессиональные группы. Основные неблагоприятные факторы
Гигиена труда в металлургической промышленности. Основные профессиональные группы. Основные неблагоприятные факторы Тері физиологиясы
Тері физиологиясы Аллергия. Классификация аллергических процессов
Аллергия. Классификация аллергических процессов Патологические изменения кожи
Патологические изменения кожи Клиническая фармакология психотропных средств Часть 1. Антипсихотики (нейролептики)
Клиническая фармакология психотропных средств Часть 1. Антипсихотики (нейролептики) Почки. Синдромы
Почки. Синдромы Фармацевтическая опека при травматических и инфекционных повреждениях кожи
Фармацевтическая опека при травматических и инфекционных повреждениях кожи Прием у детского гинеколога. Методы исследования
Прием у детского гинеколога. Методы исследования Бинокулярное зрение. Косоглазие
Бинокулярное зрение. Косоглазие Нейросенсорная тугоухость
Нейросенсорная тугоухость Виды и стадии голодания. Изменения обмена веществ и функции организма при голодании
Виды и стадии голодания. Изменения обмена веществ и функции организма при голодании Правила чистки зубов
Правила чистки зубов Иерсинии - псевдотуберкулезный микроб. Микробиология
Иерсинии - псевдотуберкулезный микроб. Микробиология ҰлпАның қабынбалы аурулары
ҰлпАның қабынбалы аурулары Расстройства сознания
Расстройства сознания Питание человека и долголетие
Питание человека и долголетие