Слайд 2

Введение
Фармаконадзор является жизненно важной функцией системы здравоохранения, поскольку имеет своей целью
быстрое выявление и реагирование на потенциальные угрозы безопасности, связанные с использованием лекарственных препарата.
Слайд 3

Государственная регистрация ЛП осуществляется на основании положительного на момент регистрации соотношения
польза-риск ЛП для определенный целевой группы пациентов, в пределах одобренного(-ых) показания(-ий) и рекомендаций по применению. Однако не все риски могут быть выявлены к моменту первоначальной регистрации, некоторые риски выявляются на пострегистрационном этапе при широком применении ЛП на протяжении всего жизненного цикла ЛП
Слайд 4

Для обеспечения возможности выполнения контроля безопасности ЛП пропорционально уровню риска, сопряженному
с их применением, целесообразным является формирование перечня ЛП, требующих расширенного сбора данных по безопасности после их регистрации, что означает введение концепции дополнительного мониторинга в отношении некоторых лекарственных препаратов.
Слайд 5

Регуляторными органами государств-членов создается, поддерживается в актуальном состоянии и публикуется единый
список лекарственных препаратов, подлежащих дополнительному мониторингу на территории государств-членов ЕАЭС.
Слайд 6

Данные лекарственные препараты в инструкции по медицинскому применению и листке-вкладыше обозначаются
перевернутым черным равнобедренным треугольником , который сопровождается следующей пояснительной надписью: «Данный лекарственный препарат подлежит дополнительному мониторингу. Это позволит быстро выявить новую информацию по безопасности. Мы обращаемся к работникам системы здравоохранения с просьбой сообщать о любых подозреваемых нежелательных реакциях».
Слайд 7

Структуры и процессы
Регистрация всех ЛП осуществляется на основании признания соотношения польза-риск
положительным с учетом имеющихся на момент регистрации сведений (данных клинических исследований/испытаний, которые проводились при разработке лекарственного препарата).
Слайд 8

Однако нежелательные реакции, которые возникают редко, либо развиваются при длительном применении,
могут стать очевидными только после применения лекарственного препарата более широким кругом пациентов и/или после длительного приема. Кроме того, преимущества и риски, связанные с лекарственным препаратом, возможно, оценивались в условиях, отличающихся от условий повседневной медицинской практики, например, клинические исследования/испытания могут исключать определенные типы пациентов с множественными сопутствующими заболеваниями или сопутствующими лекарственными препаратами.
Слайд 9

Таким образом, после выхода лекарственного препарата на рынок, его использование различными
популяционными группами требует постоянного мониторинга. Держатели регистрационного удостоверения и регуляторные органы осуществляют постоянный мониторинг лекарственных препаратов для получения появляющейся информации по безопасности, а также выполняют оценку ее влияния на соотношение польза-риск лекарственного препарата.
Слайд 10

Однако некоторые лекарственные препараты требуют выполнения более интенсивного сбора данных по
безопасности после прохождения государственной регистрации с тем, чтобы максимально быстро выявлять любые новые значимые проблемы по безопасности и немедленно предпринимать надлежащие меры.
Слайд 11

Для повышения эффективности мониторинга безопасности определенных лекарственных препаратов и для стимулирования
более интенсивного представления спонтанных сообщений о выявленных нежелательных реакциях, введена концепция дополнительного мониторинга.
Слайд 12

Статус дополнительного мониторинга может присваиваться лекарственному препарату во время выдачи удостоверения
о государственной регистрации или на более поздних этапах жизненного цикла лекарственного препарата при выявлении в процессе пострегистрационного мониторинга новой проблемы, связанной с безопасностью.
Слайд 13

В частности, статус дополнительного мониторинга важен при выдаче регистрационных удостоверений на
лекарственные препарата, содержащие новое действующее вещество, для всех лекарственных препаратов биологического происхождения, которые являются приоритетами для осуществления фармаконадзора. Регуляторные органы могут также потребовать введение статуса дополнительного мониторинга для лекарственного препарата при определенных обстоятельствах, например, по результатам проведения пострегистрационного исследования безопасности (ПРИБ) или ограничений в отношении безопасного и эффективного использования лекарственного препарата.
Слайд 14

Общедоступный список лекарственных препаратов со статусом дополнительного мониторинга должен постоянно обновляться
национальным регуляторным органом. Кроме того, работники системы здравоохранения и пациенты должны иметь возможность легко распознавать эти продукты по их маркировке.
Слайд 15

Критерии включения лекарственного препарата в список дополнительного мониторинга
Слайд 16

В список лекарственных препаратов, подлежащих дополнительному мониторингу, включаются следующие категории лекарственных
препаратов:
Лекарственные препараты, регистрируемые на территории государства-члена ЕАЭС, содержащие новое действующее вещество. Которое до вступления в силу данных Правил не было зарегистрировано ни в одном из государств-членов ЕАЭС в составе какого-либо лекарственного препарата;















 Кардиогенді шок: себептері, механизмдері, патофизиологиялық сатылары
Кардиогенді шок: себептері, механизмдері, патофизиологиялық сатылары Pneumonia
Pneumonia Наследственные и врожденные заболевания и заболевания передаваемые половым путем
Наследственные и врожденные заболевания и заболевания передаваемые половым путем The COVID-19 in China
The COVID-19 in China Рациональное питание детей и подростков
Рациональное питание детей и подростков Дыхательная недостаточность
Дыхательная недостаточность Воспалительные заболевания органов малого таза
Воспалительные заболевания органов малого таза Sistemul circulator limfatic organele hematopoietice
Sistemul circulator limfatic organele hematopoietice Красота, молодость и здоровье с Алоэ Вера
Красота, молодость и здоровье с Алоэ Вера Ішек инвагинациясы
Ішек инвагинациясы Жыныс жүйесі. Эмбриондық даму көзі және барысы. Жыныстық дифференцияланудың факторлары
Жыныс жүйесі. Эмбриондық даму көзі және барысы. Жыныстық дифференцияланудың факторлары Система выделения. Строение и функции выделительной системы
Система выделения. Строение и функции выделительной системы Патология кровообращения и лимфообращения
Патология кровообращения и лимфообращения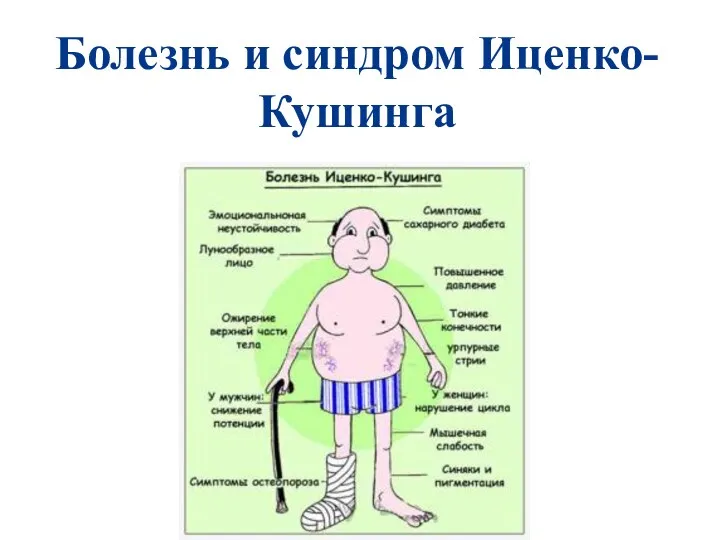 Болезнь и синдром Иценко-Кушинга
Болезнь и синдром Иценко-Кушинга Сестринская помощь при проведении обследования пациентов с заболеваниями глаз. Методы исследования
Сестринская помощь при проведении обследования пациентов с заболеваниями глаз. Методы исследования Твердые лекарственные формы
Твердые лекарственные формы Сальмонеллез. Клиника. Лечение
Сальмонеллез. Клиника. Лечение Поверхностные образования на зубах
Поверхностные образования на зубах Денсаулық сақтау саласында сапаны бақылаудың ,жоспарлаудың ғылыми негізі
Денсаулық сақтау саласында сапаны бақылаудың ,жоспарлаудың ғылыми негізі Особенности синдрома гипертермии у детей
Особенности синдрома гипертермии у детей Бронхиальды тал құрылысы
Бронхиальды тал құрылысы Травма. Травматический токсикоз. Повреждения головы, груди, живота
Травма. Травматический токсикоз. Повреждения головы, груди, живота Иммунитет. Микробиология
Иммунитет. Микробиология Препараты гормонов (1 часть)
Препараты гормонов (1 часть) Адам психикалық функцияларының ерекшеліктері
Адам психикалық функцияларының ерекшеліктері Препарат для лечения заболеваний печени Гептронг
Препарат для лечения заболеваний печени Гептронг Алопеция. Алопеция туралы жалпы түсінік
Алопеция. Алопеция туралы жалпы түсінік Заболеваемость, состояние и тенденции
Заболеваемость, состояние и тенденции