Содержание
- 2. Актуальность исследования Диагностика бычьего аденовируса затруднена из-за большого количества симптомов. Для обнаружения вируса применяют различные методы,
- 3. Учитывая широкую распространенность респираторных и желудочно-кишечных болезней молодняка сельскохозяйственных животных в Республике Казахстан, разработка современных экспресс
- 4. Цель диссертации: получение штаммов E.coli, продуцирующих рекомбинантный гексон бычьего аденовируса 3-го типа. Для достижения цели научной
- 5. Материалы и методы исследования В работе использованы штаммы Е. coli DH5cc, BL21(DE3), плазмидный вектор pGEM-TEasy (Promega,
- 6. Трансформация клеток E.coli. Определение нуклеотидной последовательности ДНК по методу Сэнгера. Трансформация компетентных клеток плазмидными векторами рЕТ-28
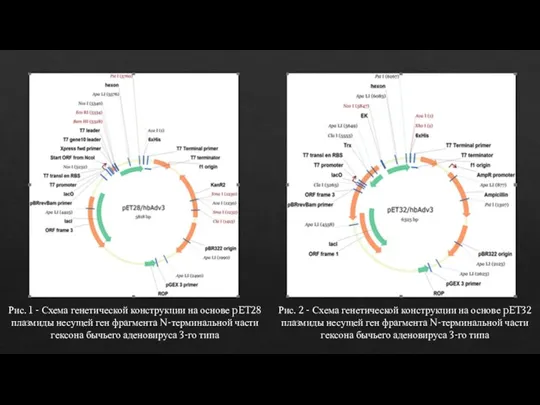
- 7. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ Дизайн и синтез генетической конструкции, несущей ген фрагмента N-терминальной части гексона
- 8. Рис. 2 - Схема генетической конструкции на основе pET32 плазмиды несущей ген фрагмента N-терминальной части гексона
- 9. Получение генетической конструкции на основе вектора pET28 и рЕТ32, несущей ген фрагмента N-терминальной части гексона бычьего
- 10. Рис. 3 - Электрофорез продуктов полимеразной цепной реакции: 1 – продукт первого раунда полимеразной цепной реакции;
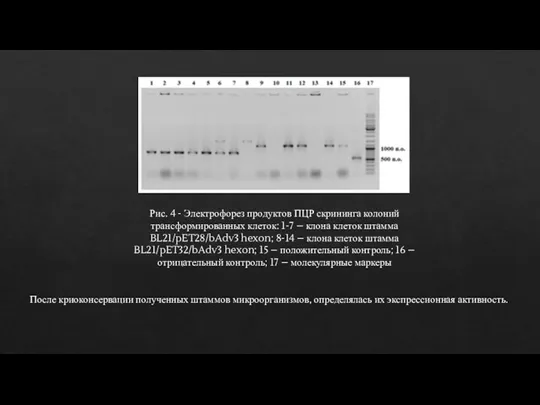
- 11. Трансформация генетической конструкции и получение стабильных штаммов микроорганизмов, продуцентов рекомбинантного гена фрагмента N-терминальной части гексона аденовируса.
- 12. Рис. 4 - Электрофорез продуктов ПЦР скрининга колоний трансформированных клеток: 1-7 – клона клеток штамма BL21/pET28/bAdv3
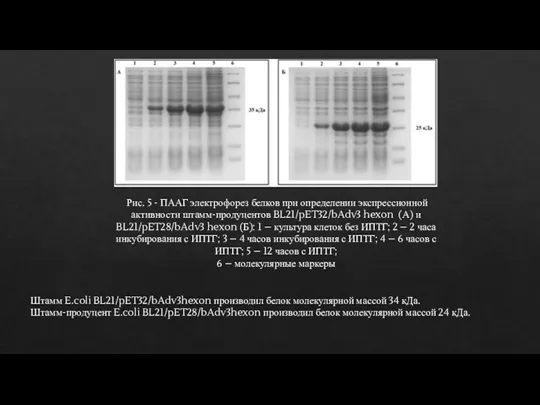
- 13. Рис. 5 - ПААГ электрофорез белков при определении экспрессионной активности штамм-продуцентов BL21/pET32/bAdv3 hexon (А) и BL21/pET28/bAdv3
- 14. Выделение и очистка рекомбинантного гексона бычьего аденовируса Для оптимизации выделения и очистки рекомбинантного гексона штаммы-продуценты культивировались
- 15. Как следует из приведенных данных, для всех выбранных для дальнейшей работы штаммов-продуцентов максимальная продукция рекомбинантных белков
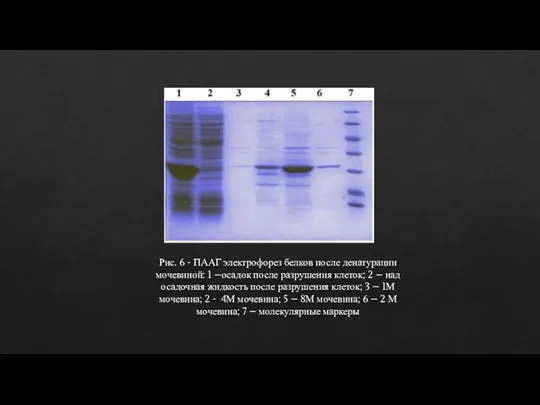
- 16. Рис. 6 - ПААГ электрофорез белков после денатурации мочевиной: 1 –осадок после разрушения клеток; 2 –
- 17. В результате отработки параметров выделения и очистки рекомбинантных белков были получены очищенные препараты антигенов. Для очистки
- 18. Качественная идентификация гексона бычьего аденовируса методом масс-спектрометрии. В результате программой Mascot были представлены 43 наиболее вероятных
- 20. Скачать презентацию













 Ушибы и сотрясение, сдавление грудной клетки и
Ушибы и сотрясение, сдавление грудной клетки и Паращитовидные железы
Паращитовидные железы Артериальная гипертония: как правильно измерить уровень артериального давления?
Артериальная гипертония: как правильно измерить уровень артериального давления? Сердечно - сосудистые лекарственные растения
Сердечно - сосудистые лекарственные растения Легионеллез кезінде алдын алу және эпидемияға қарсы шараларды ұйымдастыру
Легионеллез кезінде алдын алу және эпидемияға қарсы шараларды ұйымдастыру Исследование гемостаза. Гемостазиограмма
Исследование гемостаза. Гемостазиограмма Врожденные пороки развития дыхательных путей у детей
Врожденные пороки развития дыхательных путей у детей Социально-правовые аспекты оказания психиатрической помощи. Проблема стигматизации
Социально-правовые аспекты оказания психиатрической помощи. Проблема стигматизации Біофармація – теоретична основа виробництва лікарських засобів
Біофармація – теоретична основа виробництва лікарських засобів Иммуноглобулины. Понятие об антителах
Иммуноглобулины. Понятие об антителах Лейкоплакия. Формы. Этиология. Лечение
Лейкоплакия. Формы. Этиология. Лечение Антиаритмические препараты
Антиаритмические препараты Участие медицинской сестры в мониторинге пациентов в раннем послеоперационном периоде
Участие медицинской сестры в мониторинге пациентов в раннем послеоперационном периоде Отбасын жоспарлау репродуктивтік денсаулық
Отбасын жоспарлау репродуктивтік денсаулық Третичный период сифилиса
Третичный период сифилиса Созылмалы гастрит және дуоденит
Созылмалы гастрит және дуоденит Туберкулезный спондилит
Туберкулезный спондилит Гравидограмма интерпритациясы
Гравидограмма интерпритациясы Скрининг воспалительных заболеваний кишечника: роль терапевта
Скрининг воспалительных заболеваний кишечника: роль терапевта Первая помощь
Первая помощь Основы ЛФК
Основы ЛФК Искусство успешной презентации (для медиков)
Искусство успешной презентации (для медиков) Лейкозы у детей
Лейкозы у детей Бруцеллез
Бруцеллез Науқастың емдеуге деген ынтасын көтеру жолдары. Науқастың емделуге деген ынтасын, ұмтылысын көтерудегі дәрігердің рөлі
Науқастың емдеуге деген ынтасын көтеру жолдары. Науқастың емделуге деген ынтасын, ұмтылысын көтерудегі дәрігердің рөлі Көпіртәрізді протездер
Көпіртәрізді протездер Некоронарогенные заболевания миокарда
Некоронарогенные заболевания миокарда Хирургические инструменты
Хирургические инструменты