Содержание
- 2. Прикладная иммунология Иммунодиагностика Иммунопрофилактика Иммунотерапия
- 3. Иммунодиагностика – это использование иммунологических реакций для диагностики инфекционных и неинфекционных заболеваний. Иммунологические реакции – это
- 4. 1) Простые - участвуют два компонента (антиген и антитело); 2) Сложные - участвуют три и более
- 5. Механизмы иммунологических реакций Реакция агглютинации Реакция преципитации Реакция связывания комплемента (РСК) Реакции с участием меченых антигенов
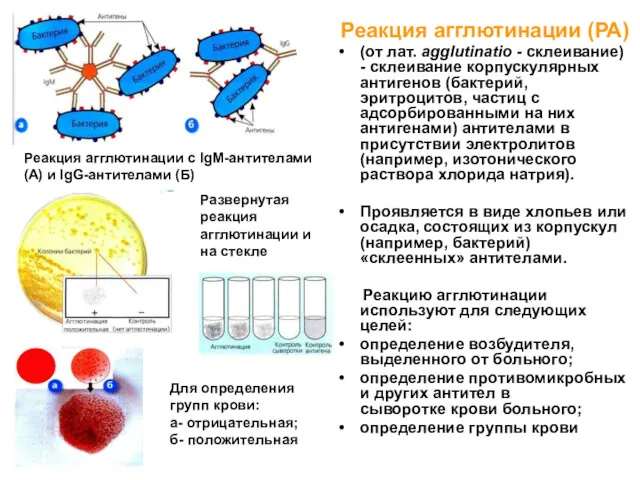
- 6. Реакции агглютинации РА на стекле (по Груберу) – для определения антигенных свойств при идентификации чистой культуры
- 7. Реакция агглютинации (РА) (от лат. agglutinatio - склеивание) - склеивание корпускулярных антигенов (бактерий, эритроцитов, частиц с
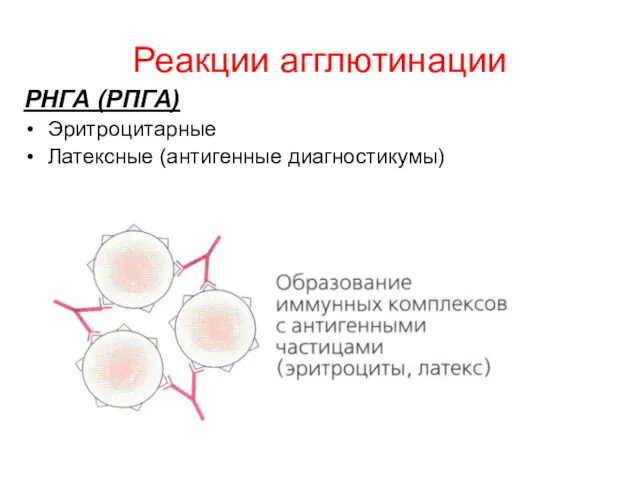
- 8. Реакции агглютинации РНГА (РПГА) Эритроцитарные Латексные (антигенные диагностикумы)
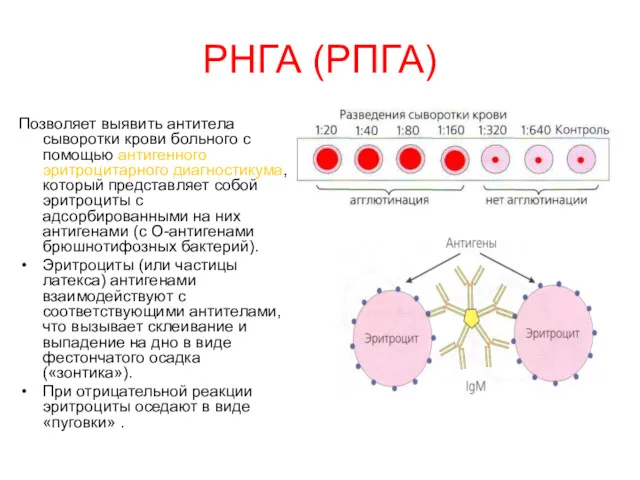
- 9. РНГА (РПГА) Позволяет выявить антитела сыворотки крови больного с помощью антигенного эритроцитарного диагностикума, который представляет собой
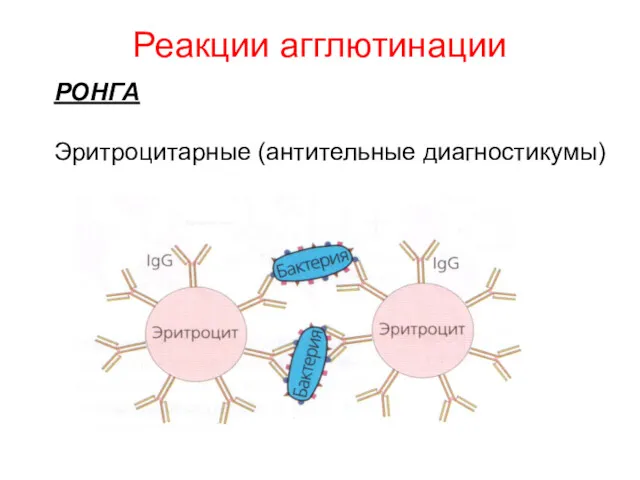
- 10. Реакции агглютинации РОНГА Эритроцитарные (антительные диагностикумы)
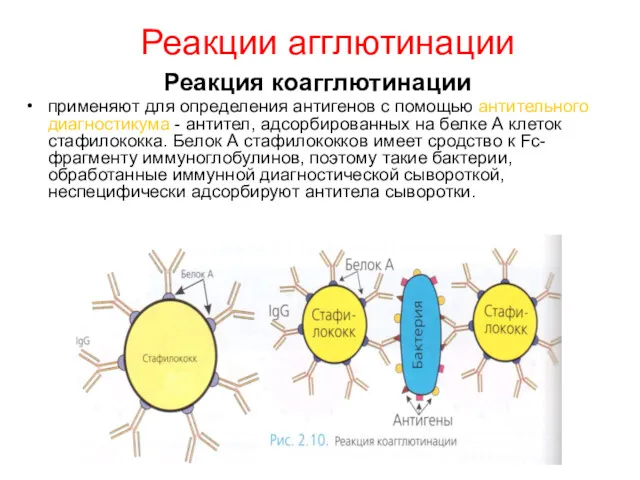
- 11. Реакции агглютинации Реакция коагглютинации применяют для определения антигенов с помощью антительного диагностикума - антител, адсорбированных на
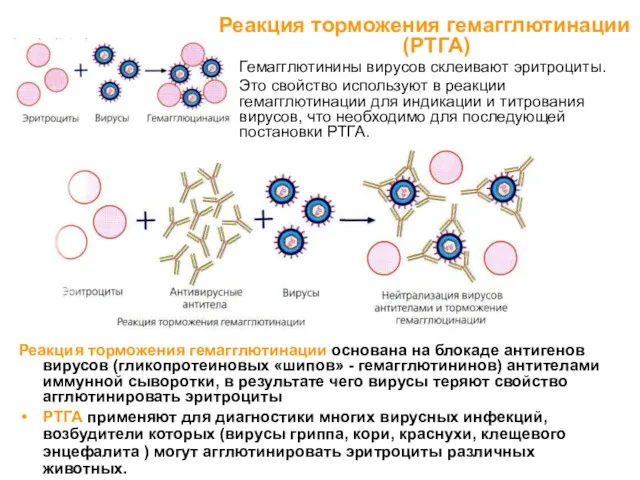
- 12. Реакция торможения гемагглютинации (РТГА) Гемагглютинины вирусов склеивают эритроциты. Это свойство используют в реакции гемагглютинации для индикации
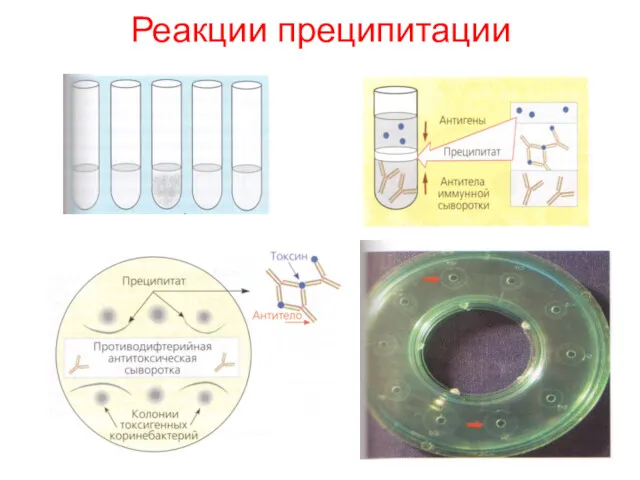
- 13. Реакции преципитации (от лат. praecipito - осаждать) - это формирование и осаждение комплекса растворимого молекулярного антигена
- 14. Реакции преципитации
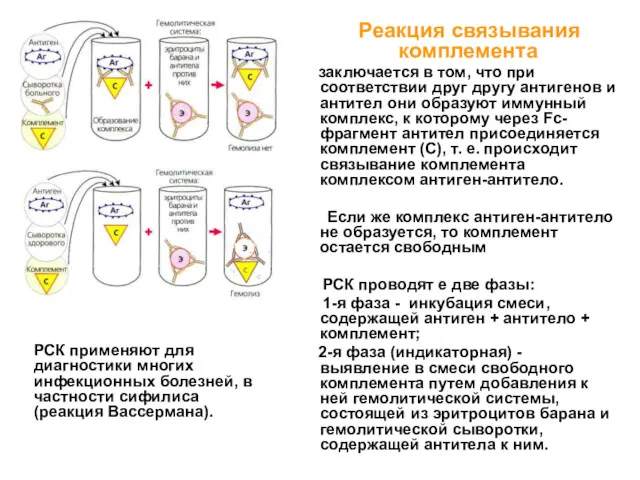
- 15. Реакция связывания комплемента заключается в том, что при соответствии друг другу антигенов и антител они образуют
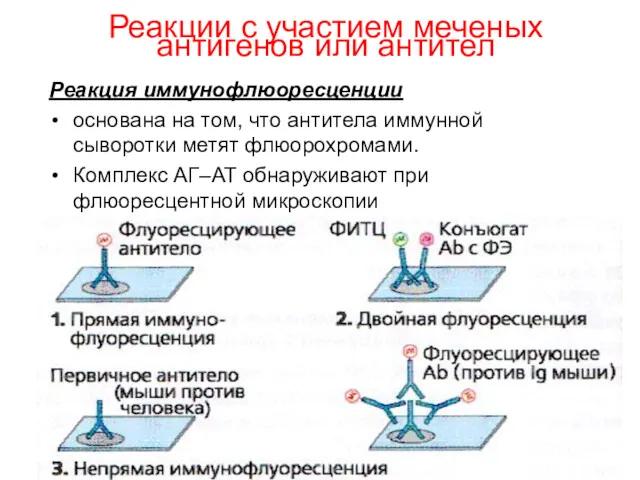
- 16. Реакции с участием меченых антигенов или антител Реакция иммунофлюоресценции основана на том, что антитела иммунной сыворотки
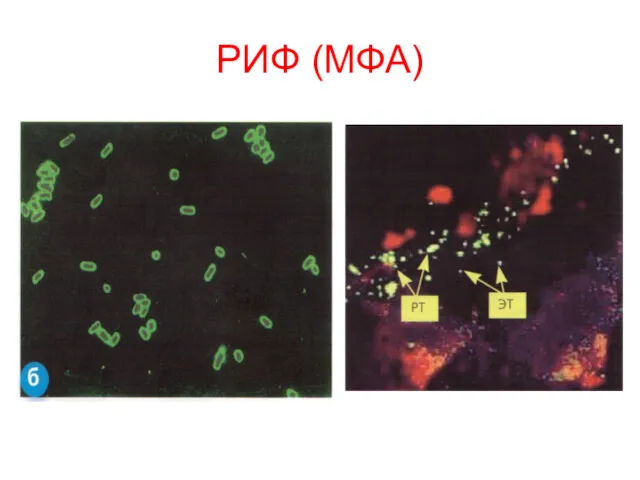
- 17. РИФ (МФА)
- 18. Реакции с участием меченых антигенов или антител Радиоиммунный анализ (РИА) основан на использовании антител, меченных радиоактивным
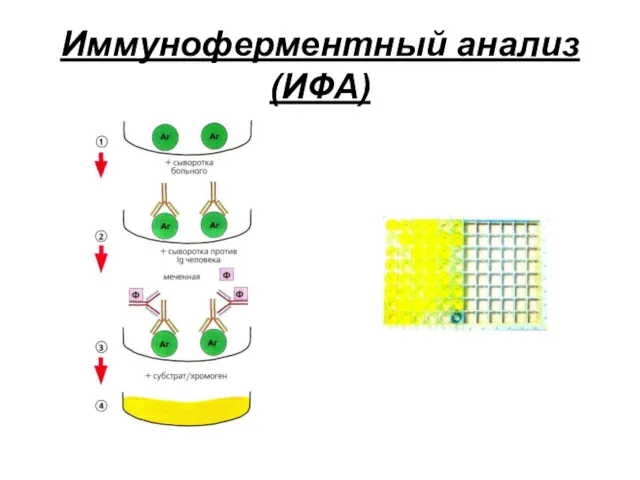
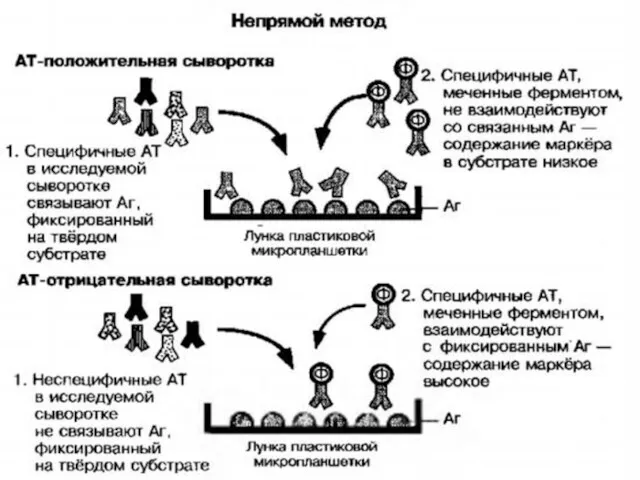
- 19. Реакции с участием меченых антигенов или антител Иммуноферментный анализ (ИФА) Используется конъюгат: антитела, связанные с ферментом
- 20. Иммуноферментный анализ (ИФА)
- 23. ИФА применяют для диагностики вирусных, бактериальных и паразитарных болезней, в частности для диагностики ВИЧ-инфекции, гепатитов В
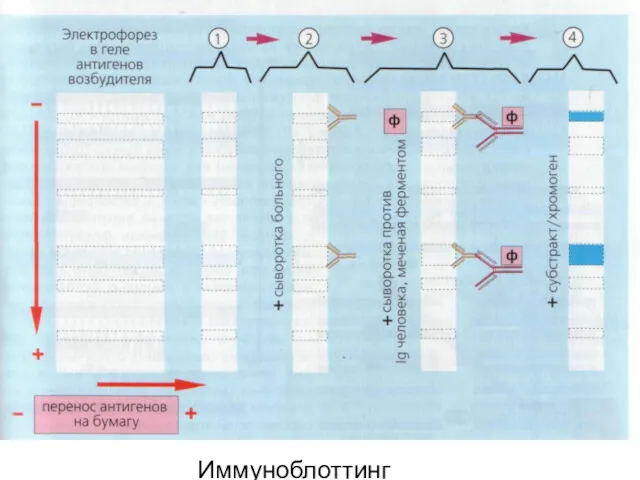
- 24. Иммуноблоттинг (или вестернблоттинг) – высокочувствительный метод выявления белков, основанный на сочетании электрофореза и ИФА. ИБ используют
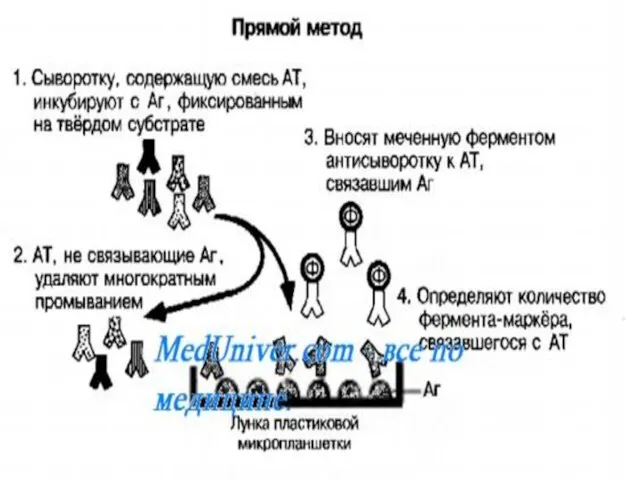
- 25. Антигены возбудителя разделяют с помощью электрофореза в полиакриламидном геле, затем переносят их (блоттинг- от англ. blot
- 26. Фирмы выпускают такие полоски с «блотами» антигенов*. На эти полоски (стрипы) наносят сыворотку больного (2). Затем,
- 27. Образовавшийся на полоске комплекс (антиген + антитело больного + антитело против Ig человека) выявляют добавлением хромогенного
- 28. Иммуноблоттинг
- 29. * Метод переноса пятен ДНК первоначально разработал в 1975 г. Саузерн (фамилия Southern в переводе означает
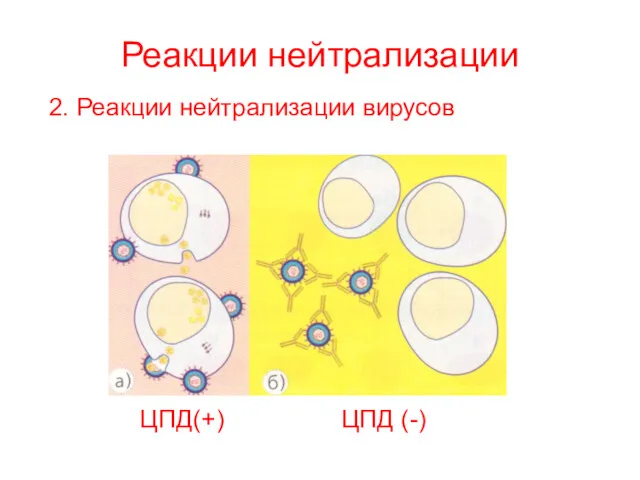
- 30. Реакции нейтрализации Реакция нейтрализации токсина для определения типа токсина возбудителя смесь токсина (исследуемого материала) и антитоксической
- 31. Реакции нейтрализации 2. Реакции нейтрализации вирусов ЦПД(+) ЦПД (-)
- 32. Проточная цитометрия – технология, позволяющая измерять физические и/или химические характеристики клеток (частиц)
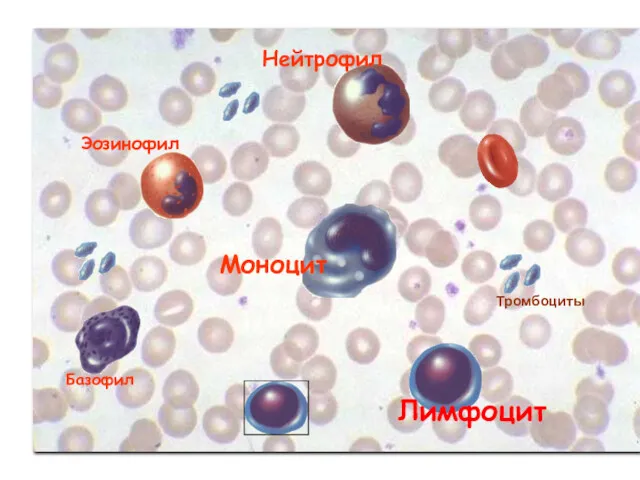
- 33. Проточная цитометрия Клетки крови можно дифференцировать на основе лазерной цитофлюорометрии. Искомые клетки, точнее их маркеры –
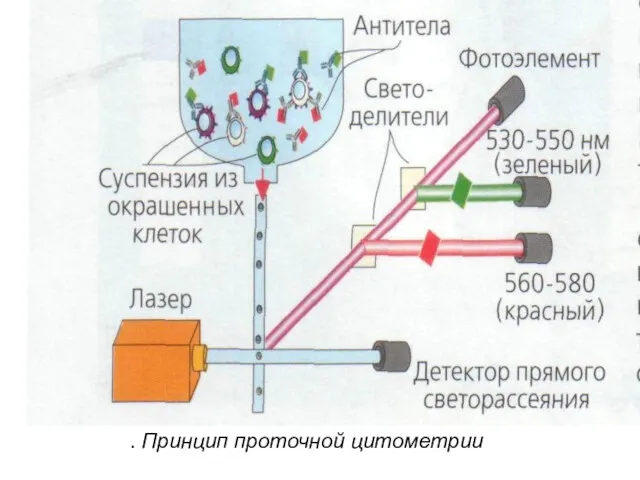
- 34. Образец крови после обработки меченными моноклональными антителами пропускают через тонкую трубку. Через исследуемый образец пропускают лазерный
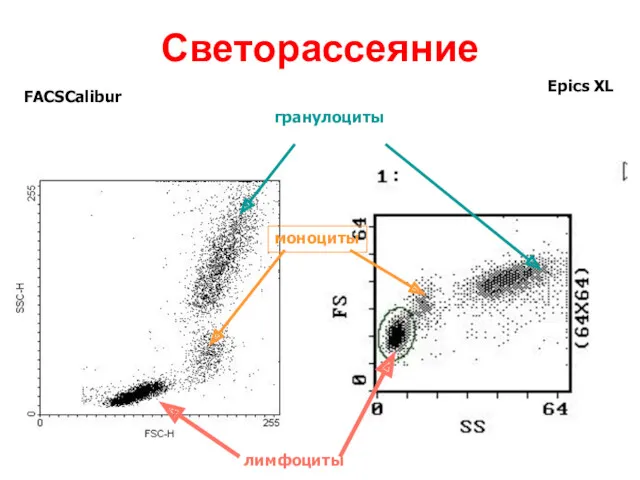
- 35. Фотоумножитель улавливает светорассеивание, по которому анализируется размер, гранулярность клетки, и регистрирует флюоресценцию, свидетельствующую о количестве меченых
- 36. . Принцип проточной цитометрии
- 37. Светорассеяние FACSCalibur Epics XL лимфоциты моноциты гранулоциты
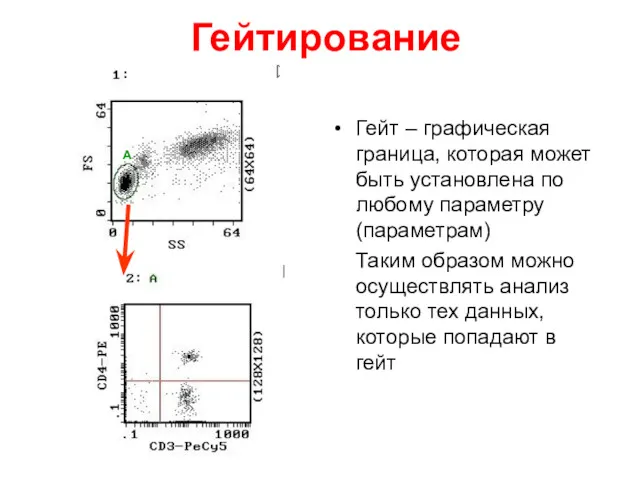
- 38. Гейтирование Гейт – графическая граница, которая может быть установлена по любому параметру (параметрам) Таким образом можно
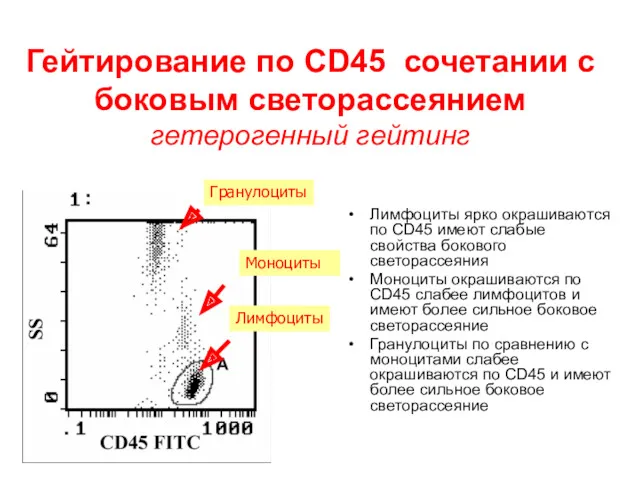
- 39. Гейтирование по CD45 сочетании с боковым светорассеянием гетерогенный гейтинг Лимфоциты ярко окрашиваются по CD45 имеют слабые
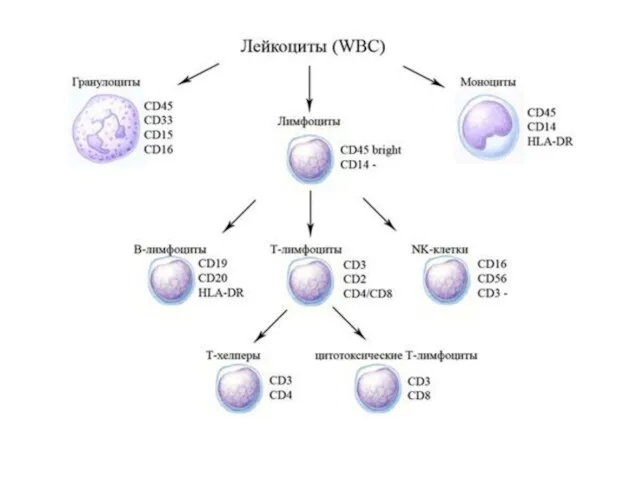
- 40. Проточная цитометрия Иммунофенотипирование – определение CD-макеров лимфоцитов - диагностика иммунодефицитов - диагностика лейкозов Определение функциональной активности
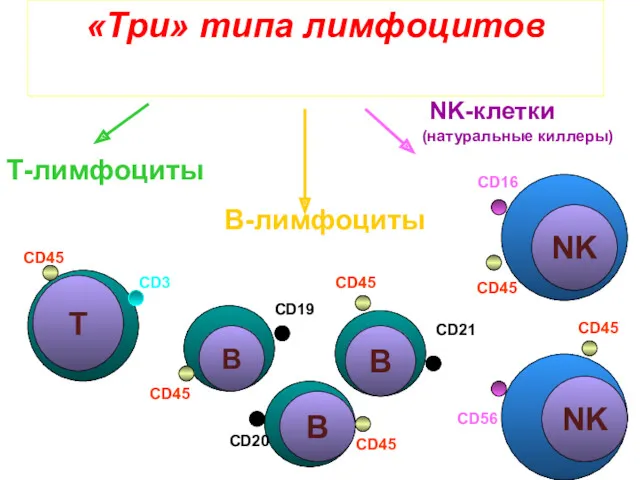
- 42. «Три» типа лимфоцитов Т-лимфоциты В-лимфоциты NK-клетки (натуральные киллеры) CD45 CD3 B B B Т B B
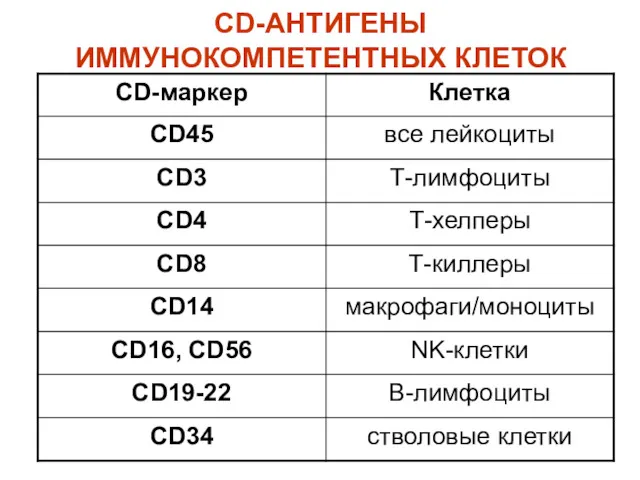
- 43. CD-АНТИГЕНЫ CD – Cell Differentiation Antigens or Claster Definition; Система групповых мембранных антигенов (более 300); Гликопротеины
- 44. CD-АНТИГЕНЫ ИММУНОКОМПЕТЕНТНЫХ КЛЕТОК
- 46. До 1986 года - розеткообразование 1986 - октябрь1987 - флуоресцентная микроскопия С октября 1987 - проточная
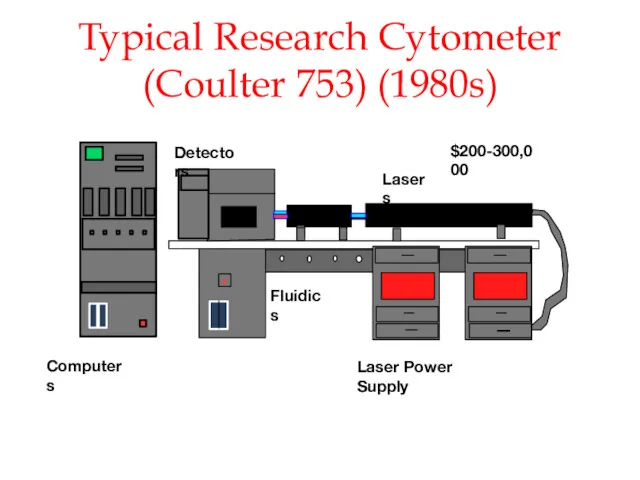
- 47. Typical Research Cytometer (Coulter 753) (1980s) Lasers Fluidics Computers Detectors Laser Power Supply $200-300,000
- 48. Typical Clinical Cytometer $90-120,000 Computer System Detector & Mechanical Fluidics
- 49. Проточные цитометры FACSCalibur “Becton Dickinson” EPICS XL “BECMAN COULTER”
- 50. Компактные проточные цитометры
- 51. Этапы определения количества CD-маркеров лимфоцитов 1-преаналитический этап -подготовка пациента -влияние различных факторов -выбор антикоагулянтов -процедура забора
- 52. СИСТЕМЫ VACUTAINER TM ДЛЯ ВЗЯТИЯ ПРОБ
- 53. Функциональные тесты. 1. Спонтанная реакция бластной трансформации лимфоцитов (РБТЛ) – способность лимфоцитов к трансформации без стимуляции
- 54. 2.Стимулированная бластная трансформация с митогенами фитогемагглютинином (ФГА) или конканавалином (Кон А) характеризует функциональную способность Т-лимфоцитов к
- 55. О функциональной активности В-лимфоцитов судят по бластной трансформации в ответ на стимуляцию митогеном лаканоса и другими
- 56. Заболевания и состояния, при которых изменяется спонтанная бластная трансформация лимфоцитов
- 57. Фагоцитарная активность нейтрофилов Изучение показателей фагоцитоза имеет значение в комплексном анализе и диагностике иммунодефицитных состояний: часто
- 58. В связи с тем, что фагоциты участвует в элиминации иммунных комплексов и активность фагоцитоза тесно связана
- 59. Наиболее информативными для оценки активности фагоцитоза считают: Фагоцитарное число (ФЧ) – среднее количество микробных или дрожжевых
- 60. Заболевания и состояния, при которых изменяется фагоцитарная активность нейтрофилов
- 61. НСТ-тест в крови Спонтанный тест с НСТ (нитросиний тетразолий) позволяет оценить степень антигенной раздраженности неактивированных in
- 62. Повышение спонтанного теста с НСТ отмечается при антигеном раздражении вследствие бактериального воспаления (продромальный период, период острого
- 63. Снижение спонтанного теста с НСТ характерно для хронизации воспалительного процесса, врожденных дефектов фагоцитарной системы, вторичных и
- 64. Активированный тест с НСТ в крови Позволяет оценить функциональный резерв кислородзависимого механизма бактерицидности фагоцитов. При сохраненной
- 65. Определение уровня ЦИК в сыворотке. Циркулирующие иммунные комплексы (ЦИК) – это комплексы, состоящие из антигена, антител
- 66. Патологические реакции на иммунные комплексы могут быть обусловлены повышением скорости их образования над скоростью элиминации, дефицитом
- 67. Принцип метода определения уровня ЦИК в сыворотке основан на изменении величины светового рассеивания раствора полиэтиленгликоля вследствие
- 68. Основным принципом оценки результатов комплексного исследования иммунного статуса у больного является количественное и функциональное определение всех
- 70. Скачать презентацию










































 Проблема вкусовой привлекательности рациона при ХБП и способы ее повышения
Проблема вкусовой привлекательности рациона при ХБП и способы ее повышения БМСК жағдайында көмек көрсету қағидалары
БМСК жағдайында көмек көрсету қағидалары Становление теоретической и клинической медицины Нового времени. Научные революции в медицине. Лекция 7
Становление теоретической и клинической медицины Нового времени. Научные революции в медицине. Лекция 7 Атопический дерматит
Атопический дерматит Лабораторные методы исследования системы крови
Лабораторные методы исследования системы крови Осторожно: грипп и орви
Осторожно: грипп и орви Вакцина против полиомиелита
Вакцина против полиомиелита Әйелдердегі маскүнемдік
Әйелдердегі маскүнемдік Медико-соціальна експертиза при захворюваннях органів дихання
Медико-соціальна експертиза при захворюваннях органів дихання Идиопатические заболевания пародонта
Идиопатические заболевания пародонта Семинар по классификации в Бочча
Семинар по классификации в Бочча ВКР: Течение и лечение катаральных (альвеолярных) маститов в ООО РУСЬ
ВКР: Течение и лечение катаральных (альвеолярных) маститов в ООО РУСЬ Тактика медперсонала при выявлении у пациентов факторов риска или клинических симптомов наркологического заболевания
Тактика медперсонала при выявлении у пациентов факторов риска или клинических симптомов наркологического заболевания Созылмалы бүйрек шамасыздығы
Созылмалы бүйрек шамасыздығы Предмет и задачи психиатрии
Предмет и задачи психиатрии Детская городская клиническая больница имени Н.Ф. Филатова
Детская городская клиническая больница имени Н.Ф. Филатова Электрокардиография при нарушениях ритма сердца
Электрокардиография при нарушениях ритма сердца Шап жарығы
Шап жарығы Нагноительные заболевания легких. Заболевания плевры
Нагноительные заболевания легких. Заболевания плевры Деформация зубных рядов. Зубочелюстная аномалия
Деформация зубных рядов. Зубочелюстная аномалия Харчування дітей старше року
Харчування дітей старше року Физиология крови. Лейкоциты
Физиология крови. Лейкоциты Виразково-некротичний гінгівіт
Виразково-некротичний гінгівіт Современная антимикробная терапия
Современная антимикробная терапия Современные подходы к образованию обучающихся с ОВЗ
Современные подходы к образованию обучающихся с ОВЗ Анаэробная инфекция
Анаэробная инфекция Противоопухолевый иммунитет
Противоопухолевый иммунитет Физиолечение флегмоны кисти
Физиолечение флегмоны кисти