Содержание
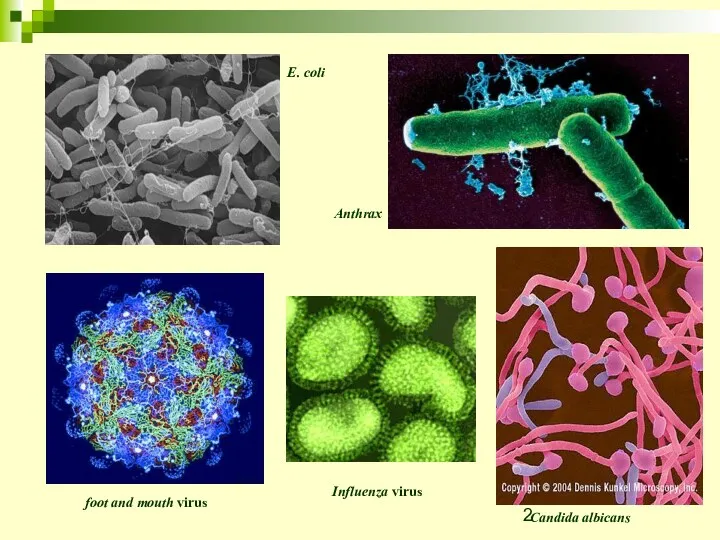
- 2. foot and mouth virus Influenza virus E. coli Anthrax Candida albicans
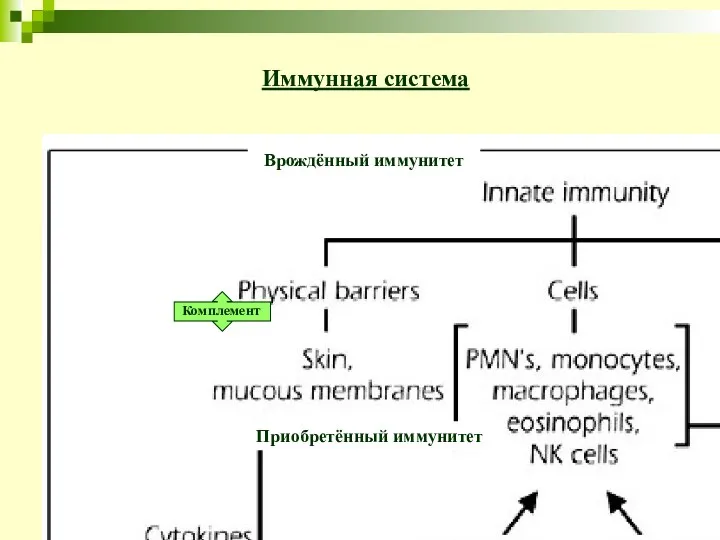
- 3. Комплемент Иммунная система Врождённый иммунитет Приобретённый иммунитет
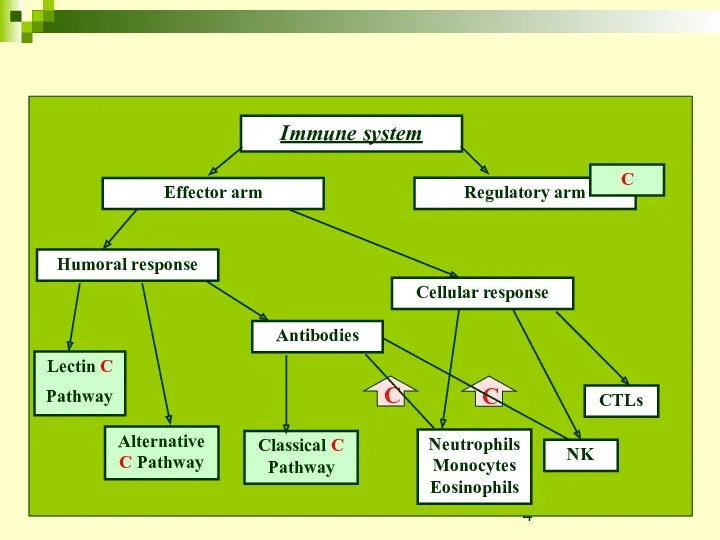
- 4. Immune system Effector arm Regulatory arm Humoral response Cellular response Antibodies Lectin C Pathway Alternative C
- 5. Система комплемента Впервые была обнаружена в 1889 г. как составляющая нормальной сыворотки, чувствительная к высоким температурам
- 6. Система комплемента Функции: Лизис: клеток, бактерий (грам-негативных), паразитов, вирусов Опсонизация комплексов антиген-антитело с помощью продуктов расщепления
- 7. Что делает комплемент?
- 8. Компоненты комплемента Протеины и гликопротеины, составляющие систему комплемента, синтезируются в основном гепатоцитами печени, а также кровяными
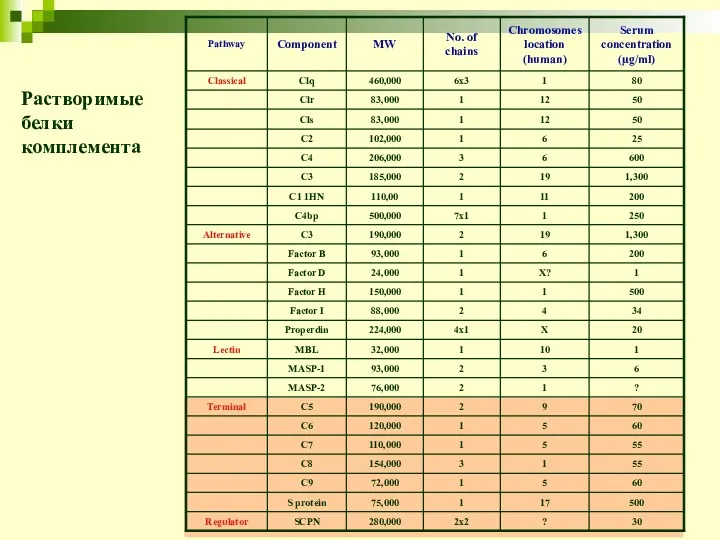
- 9. Растворимые белки комплемента
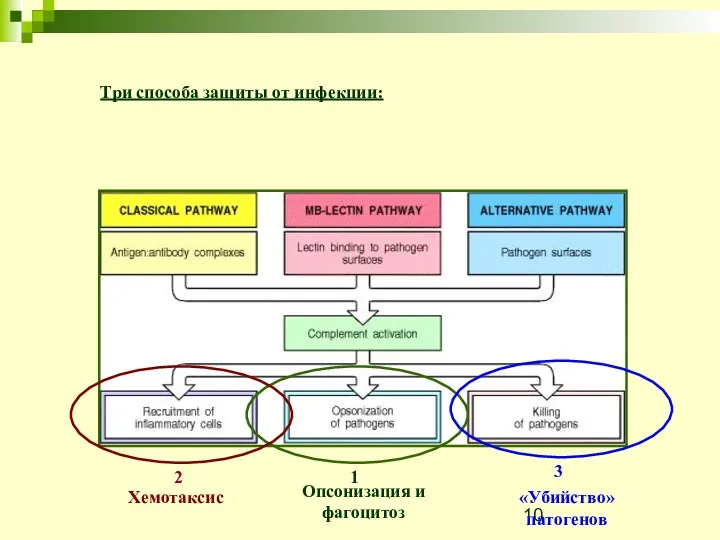
- 10. Три способа защиты от инфекции:
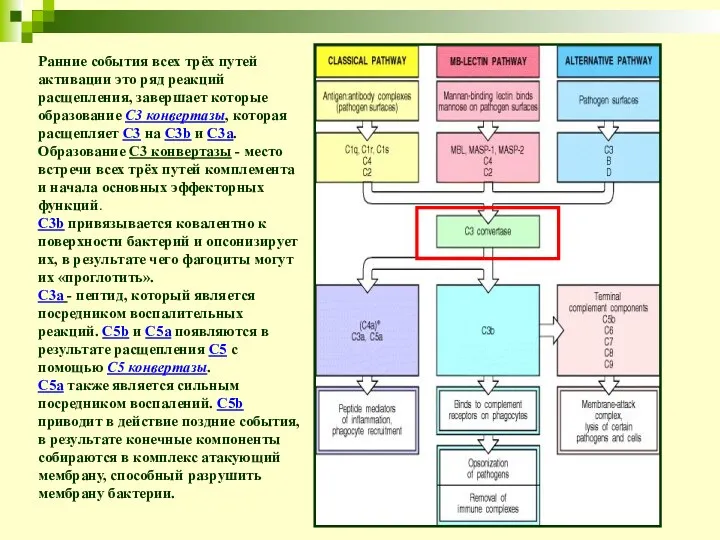
- 11. Ранние события всех трёх путей активации это ряд реакций расщепления, завершает которые образование С3 конвертазы, которая
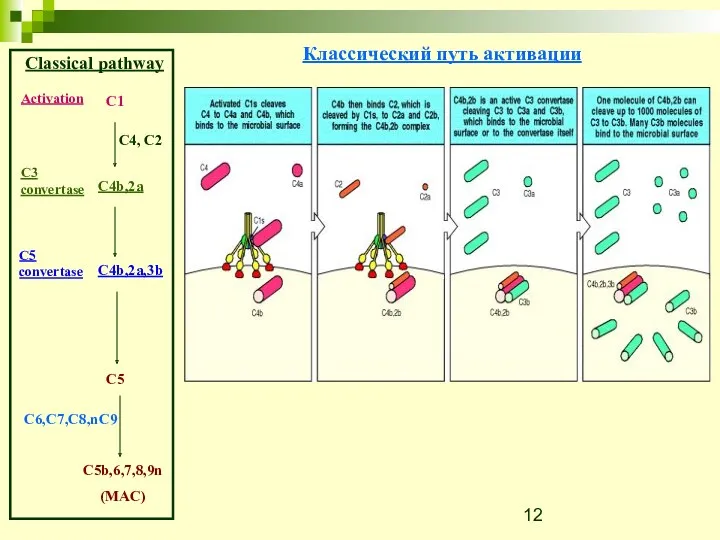
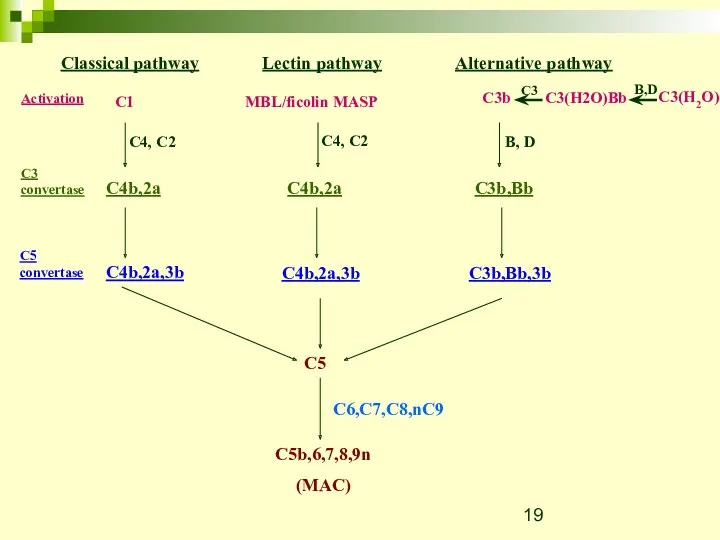
- 12. Classical pathway C1 C4, C2 Activation C3 convertase C4b,2a C4b,2a,3b C5 convertase C5 C5b,6,7,8,9n (MAC) C6,C7,C8,nC9
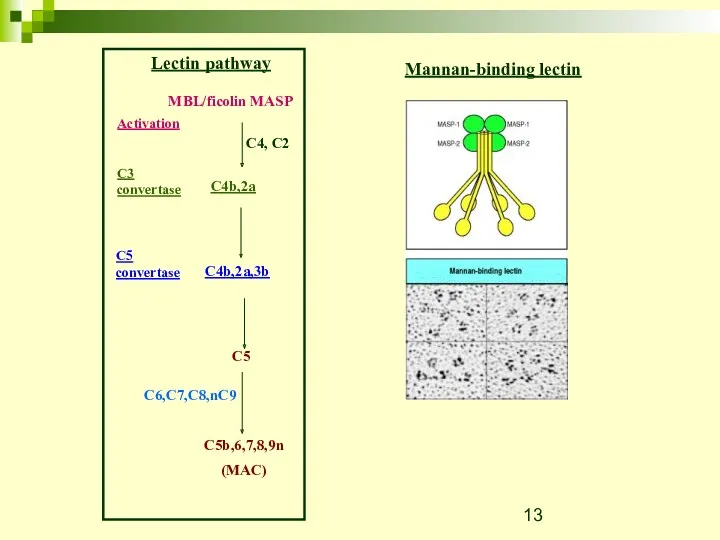
- 13. Mannan-binding lectin
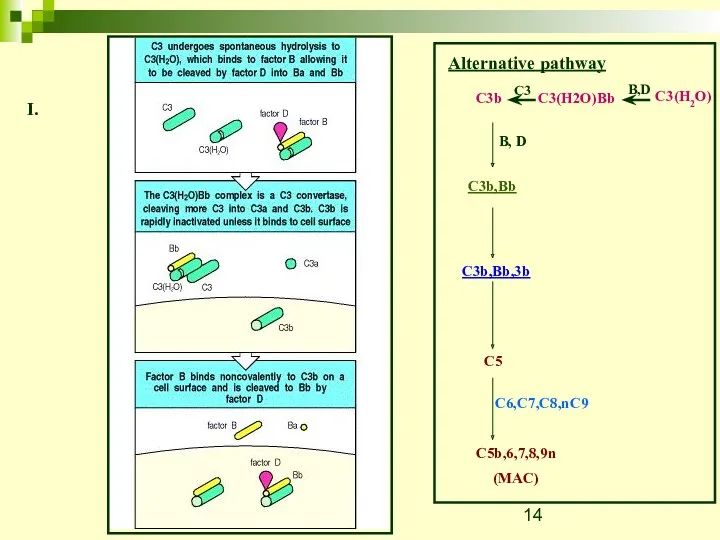
- 14. Alternative pathway C3(H2O) B,D C3(H2O)Bb C3 C3b B, D C3b,Bb C3b,Bb,3b C5 C5b,6,7,8,9n (MAC) C6,C7,C8,nC9 I.
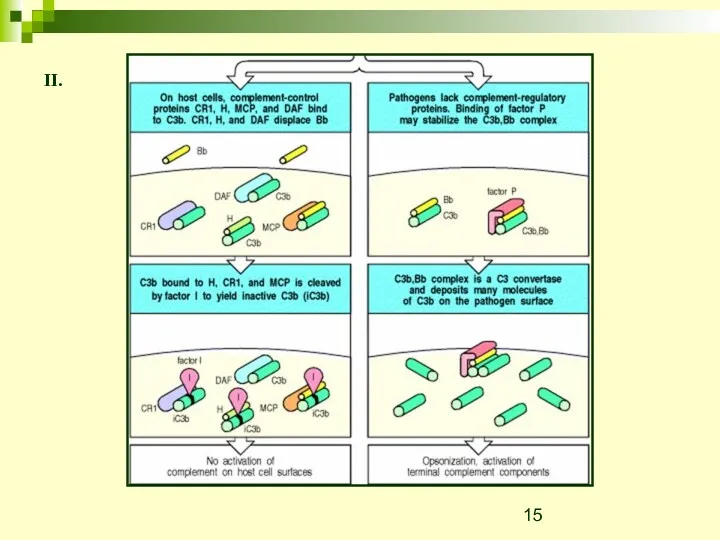
- 15. II.
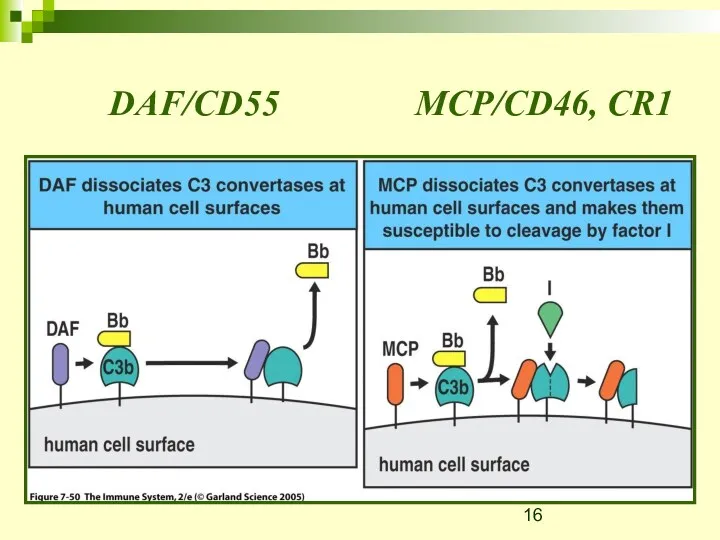
- 16. DAF/CD55 MCP/CD46, CR1
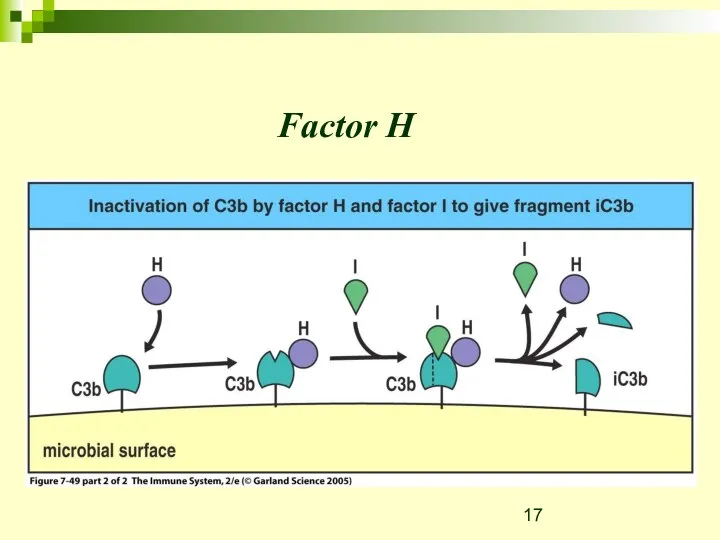
- 17. Factor H
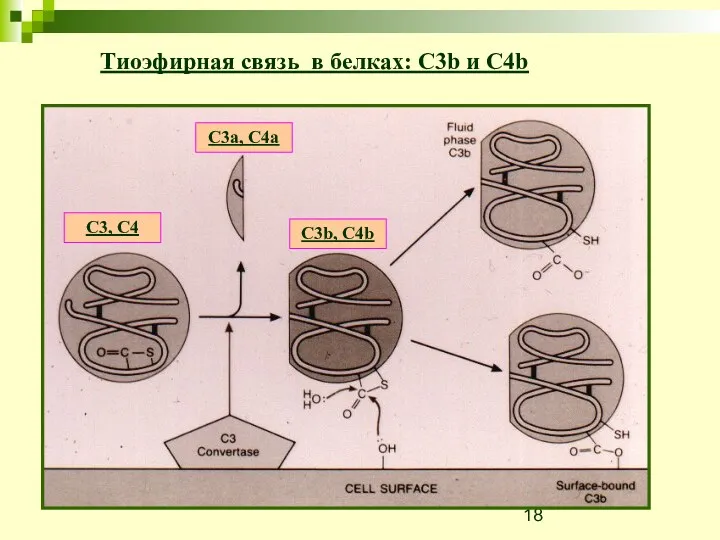
- 18. Тиоэфирная связь в белках: C3b и C4b C3, C4 C3a, C4a C3b, C4b
- 19. Classical pathway Lectin pathway C1 MBL/ficolin MASP C4, C2 C4, C2 Activation C3 convertase C4b,2a C4b,2a
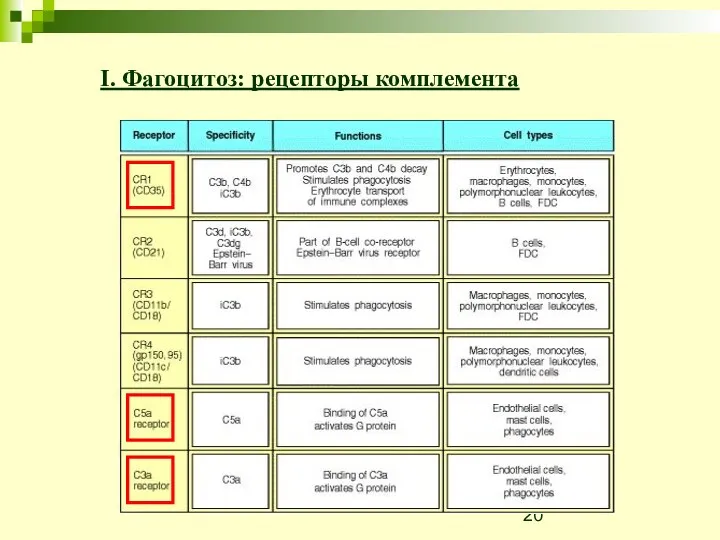
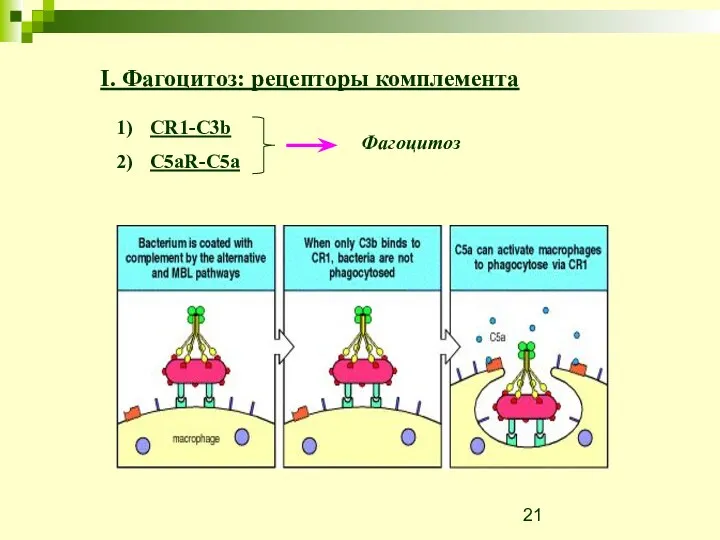
- 20. I. Фагоцитоз: рецепторы комплемента
- 21. CR1-C3b C5aR-C5a Фагоцитоз I. Фагоцитоз: рецепторы комплемента
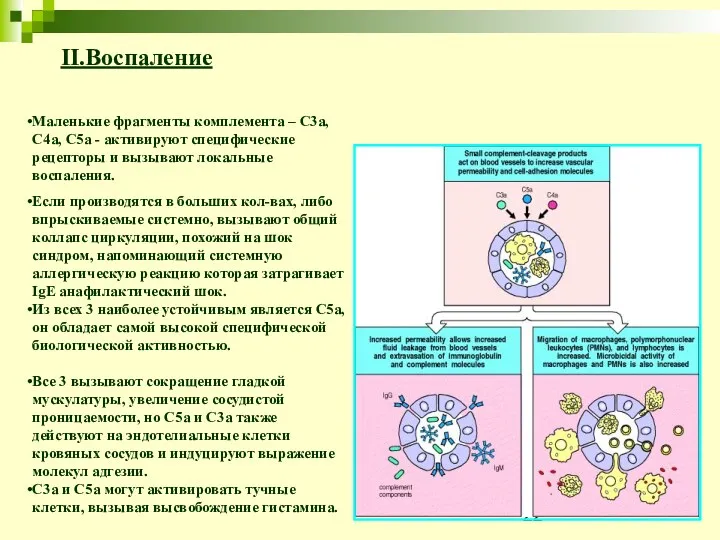
- 22. II.Воспаление Маленькие фрагменты комплемента – C3a, C4a, C5a - активируют специфические рецепторы и вызывают локальные воспаления.
- 23. III. МАК - Конечные белки комплемента
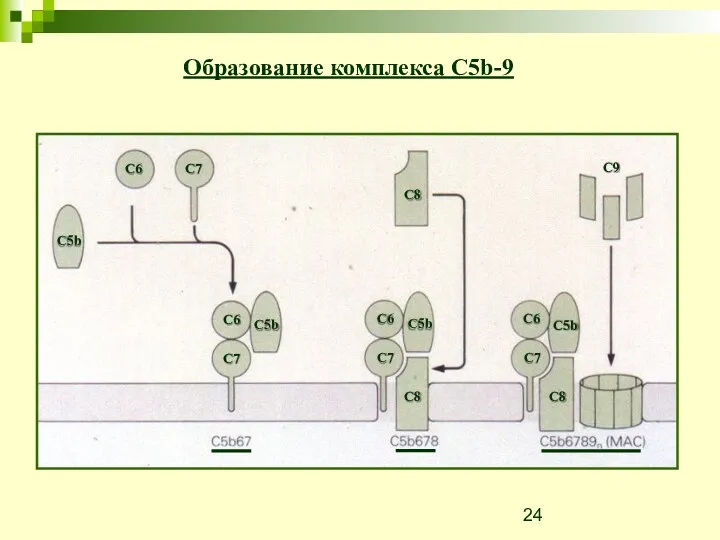
- 24. Образование комплекса C5b-9 C5b C6 C7 C6 C5b C5b C5b C6 C6 C7 C7 C7 C8
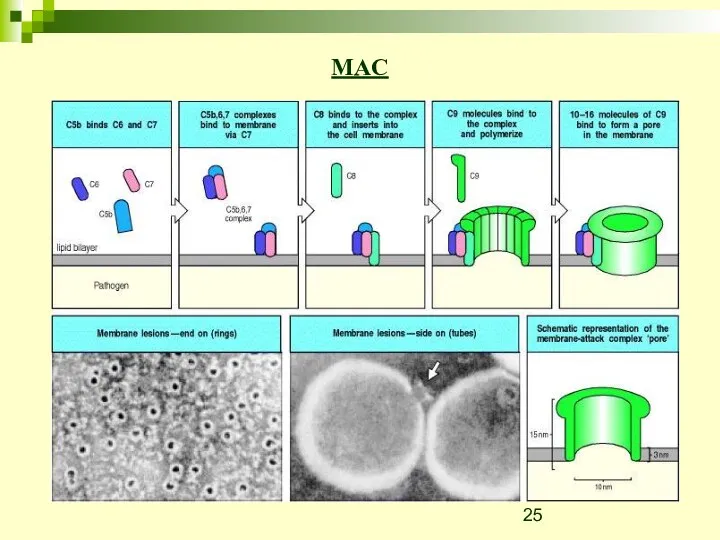
- 25. MAC
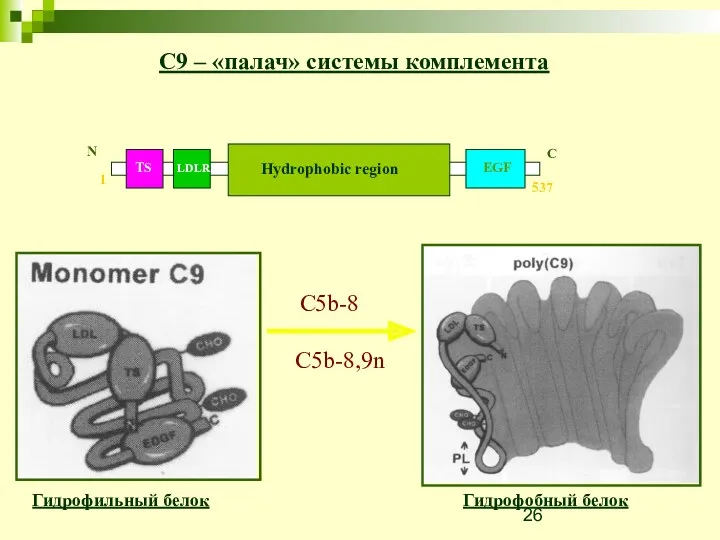
- 26. C9 – «палач» системы комплемента Гидрофильный белок Гидрофобный белок
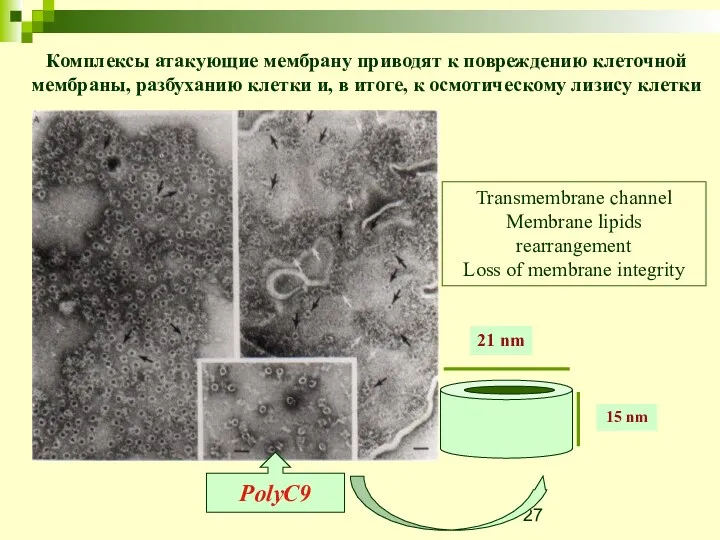
- 27. PolyC9 21 nm 15 nm Transmembrane channel Membrane lipids rearrangement Loss of membrane integrity Комплексы атакующие
- 28. Necrosis MACs Sodium influx Penetration of water Cell death
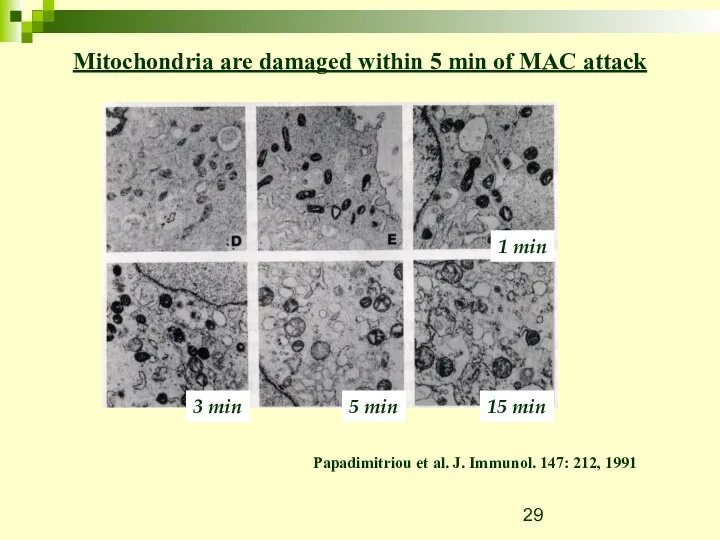
- 29. Mitochondria are damaged within 5 min of MAC attack Papadimitriou et al. J. Immunol. 147: 212,
- 30. Complement in pathogenesis Alzheimer’s disease (Rogers et al., 1992) Allotransplantation (Pruitt and Bollinger, 1991) Asthma (Regal
- 31. Complement in pathogenesis
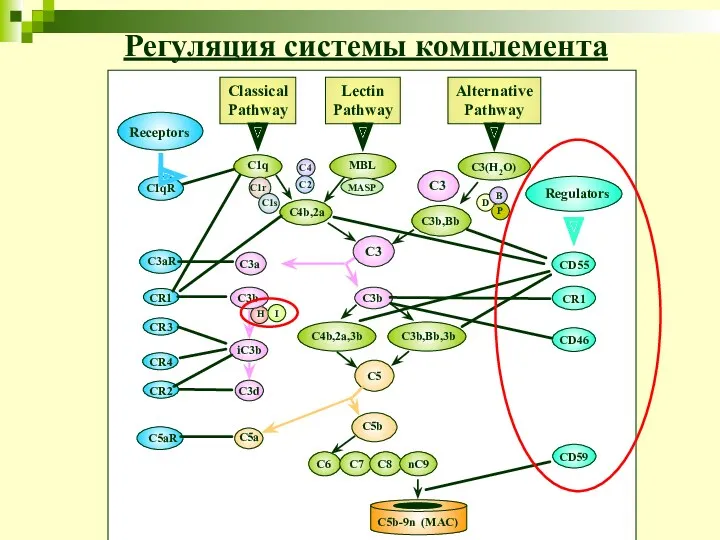
- 32. Регуляция системы комплемента
- 33. Soluble complement regulatory proteins: Factor H, Factor I, C4bp, Properdin, S protein (Vitronectin), Clusterin (SP40,40), C1INH
- 34. Complement resistance of tumor cells: basal and induced mechanisms Fishelson et al., 1999, Mol Imm
- 35. Эффект комплемента на опухолевые клетки неоднократно демонстрировался, тем не менее однозначных доказательств анти-раковых функций показано не
- 36. Известно, что клетки, обладающие ядрами, отличаются друг от друга в чувствительности к комплементу, эти различия принято
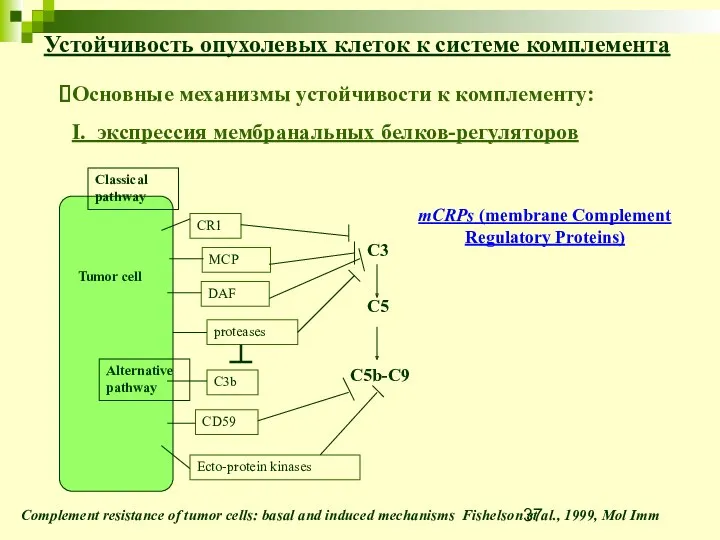
- 37. mCRPs (membrane Complement Regulatory Proteins) Устойчивость опухолевых клеток к системе комплемента Complement resistance of tumor cells:
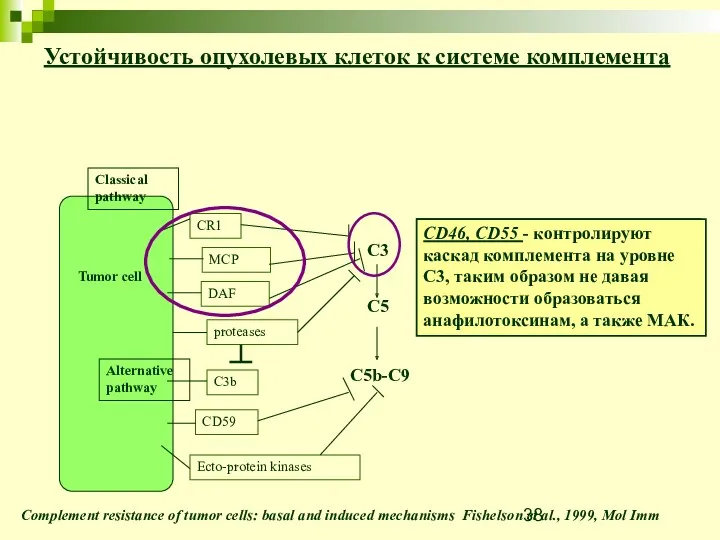
- 38. Устойчивость опухолевых клеток к системе комплемента Complement resistance of tumor cells: basal and induced mechanisms Fishelson
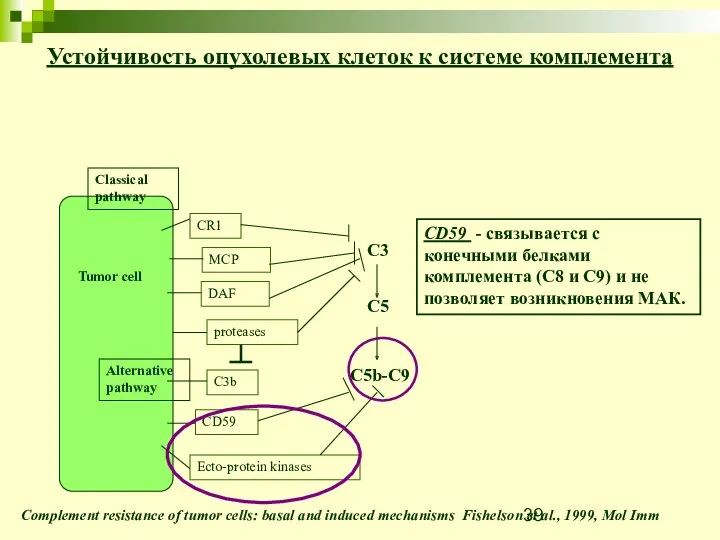
- 39. Устойчивость опухолевых клеток к системе комплемента Complement resistance of tumor cells: basal and induced mechanisms Fishelson
- 40. CD59 CD59 binds to C8 and C9 and prevents further build up of the Membrane Attack
- 41. mCRPs находящиеся на поверхности нормальных и опухолевых клеток и уровень их экспрессии даже в одних и
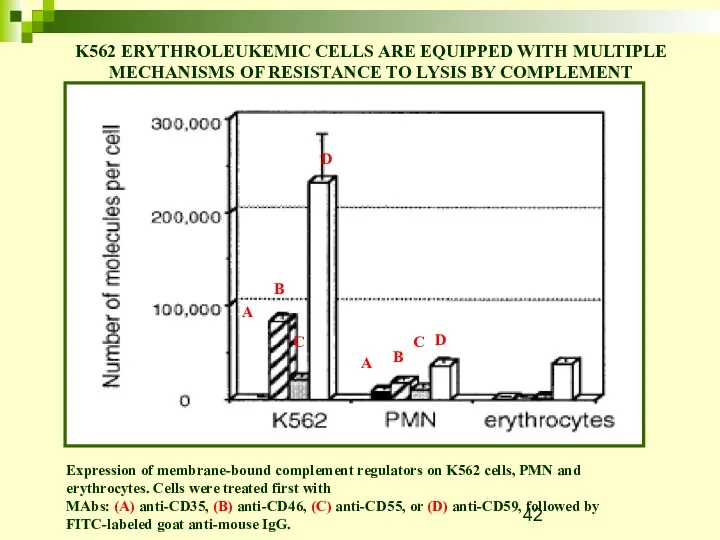
- 42. Expression of membrane-bound complement regulators on K562 cells, PMN and erythrocytes. Cells were treated first with
- 43. Важность mCRPs как механизма устойчивости к комплементу была также показана с помощью экспериментов с блокированием этих
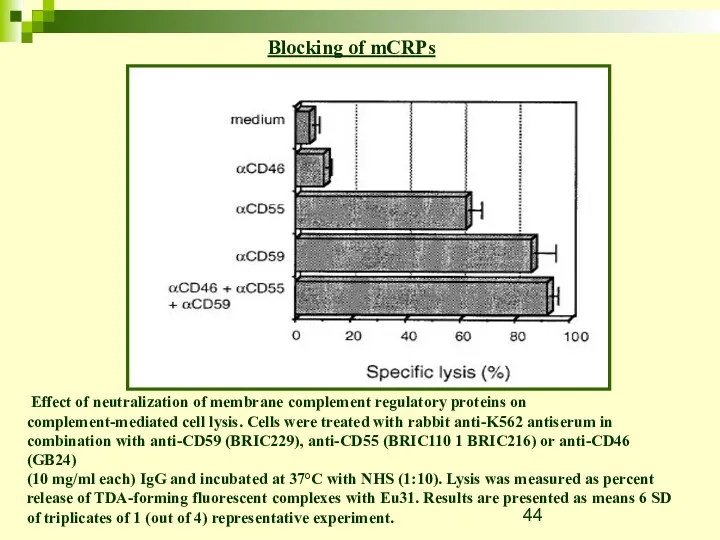
- 44. Effect of neutralization of membrane complement regulatory proteins on complement-mediated cell lysis. Cells were treated with
- 45. Основные механизмы устойчивости к комплементу: I. экспрессия растворимых белков-регуляторов
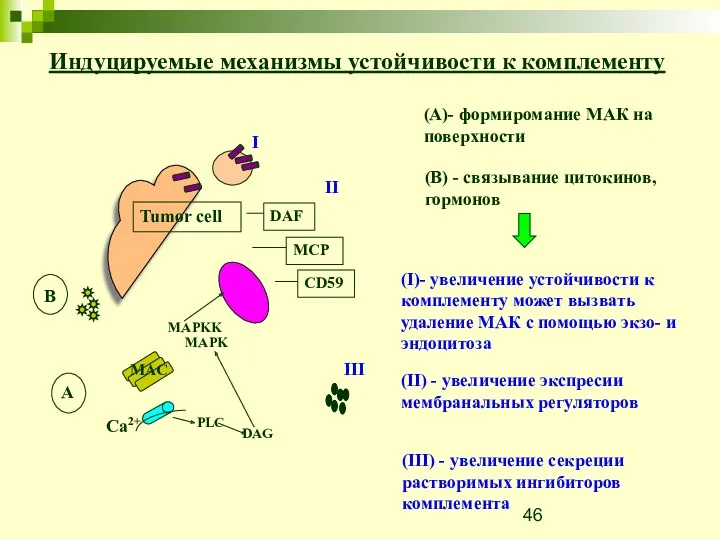
- 46. Индуцируемые механизмы устойчивости к комплементу Tumor cell DAF MCP CD59 I II III B Ca2+ MAC
- 47. Интересно, что одним из наиболее потенциальных подобных агентов является сам МАК. Для того чтобы лизировать клетки
- 48. Также было показано, что клетки К562 могут быть защищены от лизиса комплементом с помощью обработки с
- 49. Обработка клеток с помощью суб-литического комплемента приводит в действие клеточный механизм, который убирает МАК с поверхности
- 50. Mortalin/GRP75 promotes release of membrane vesicles from immune attacked cells and protection from complement-mediated lysis D.
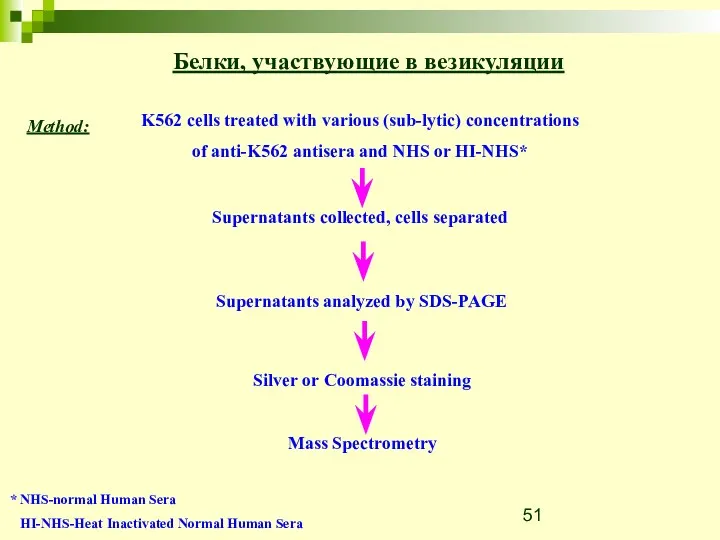
- 51. Белки, участвующие в везикуляции Method: * NHS-normal Human Sera HI-NHS-Heat Inactivated Normal Human Sera
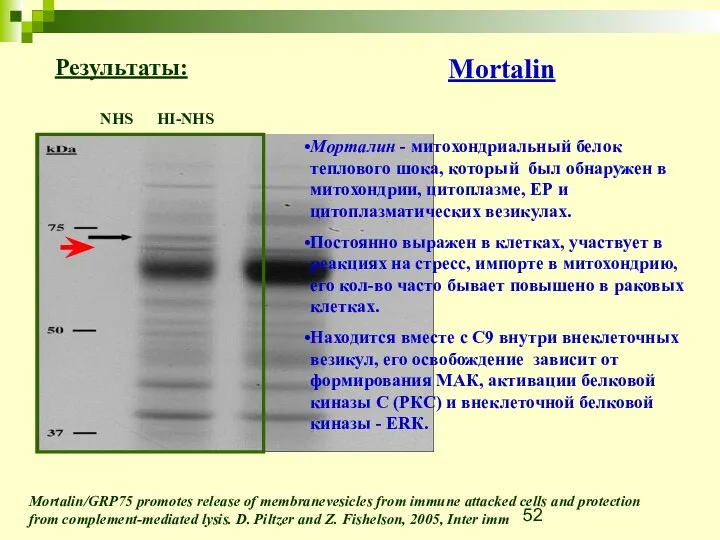
- 52. NHS HI-NHS Mortalin/GRP75 promotes release of membranevesicles from immune attacked cells and protection from complement-mediated lysis.
- 53. Mortalin Mitochondria Unfolding of proteins and importing them into the mitochondria Cytosol Intracellular trafficking P53 inactivation
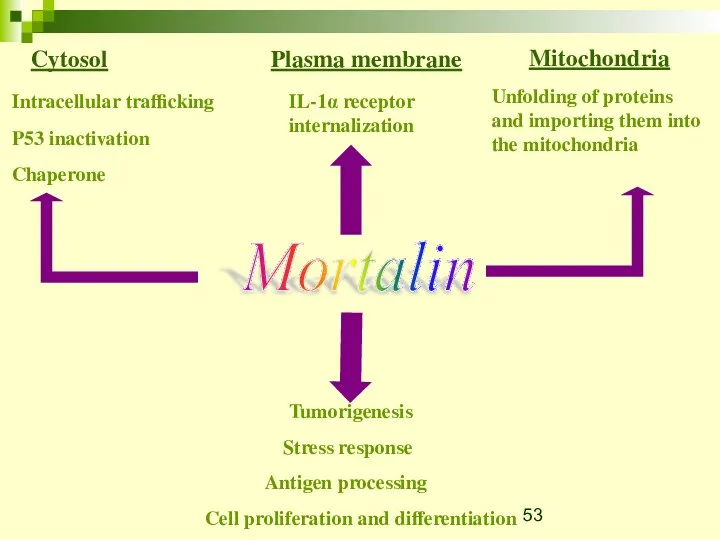
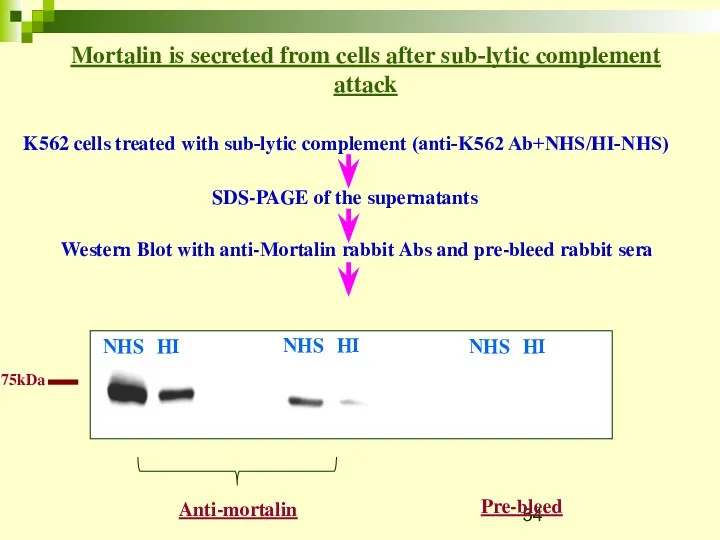
- 54. Mortalin is secreted from cells after sub-lytic complement attack K562 cells treated with sub-lytic complement (anti-K562
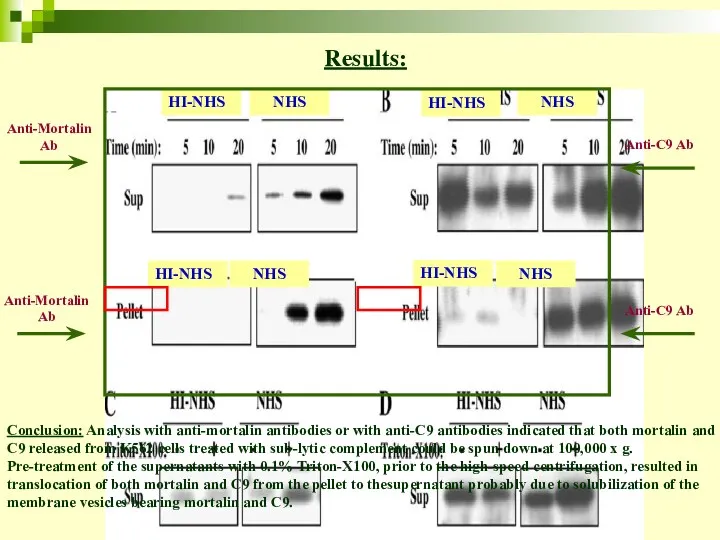
- 55. Mortalin and C9 are associated with membrane vesicles K562 treated with sub-lytic complement Sedimentation at 5000Xg
- 56. HI-NHS NHS HI-NHS NHS Anti-Mortalin Ab Anti-C9 Ab Anti-Mortalin Ab Anti-C9 Ab Results: HI-NHS NHS HI-NHS
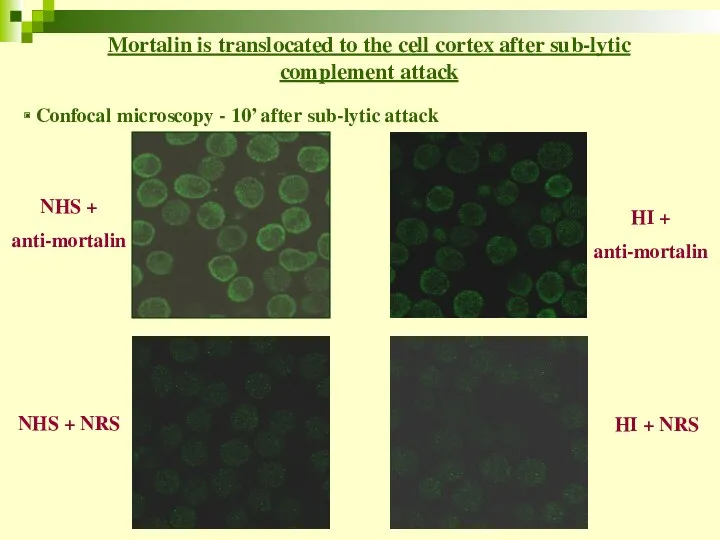
- 57. NHS + anti-mortalin Mortalin is translocated to the cell cortex after sub-lytic complement attack NHS +
- 58. Addition of anti-Mortalin Ab to the experiments Anti-Mortalin Ab lowers cells’ protection against complement K562 cells
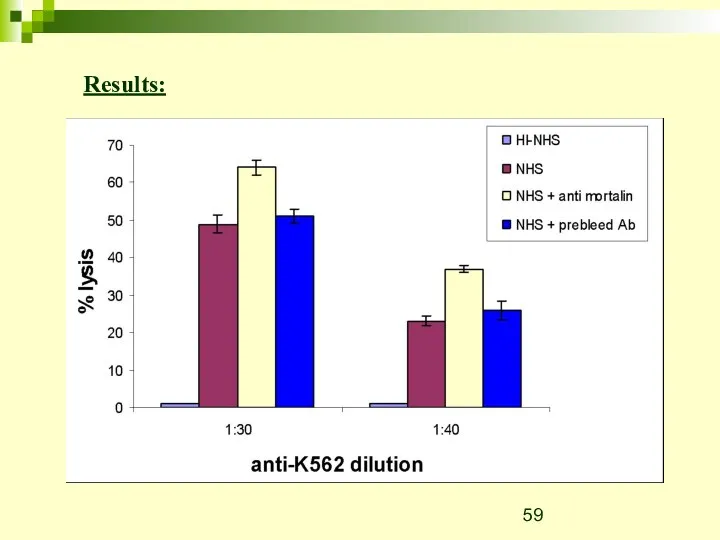
- 59. Results:
- 60. Increased sensitivity of early apoptotic cells to complement-mediated lysis Gitit Attali, Dana Gancz and Zvi Fishelson,
- 61. Интеракция белков комплемента с апоптотическими клетками была продемонстрирована, однако эта тема мало изучена. Апоптотические клетки могут
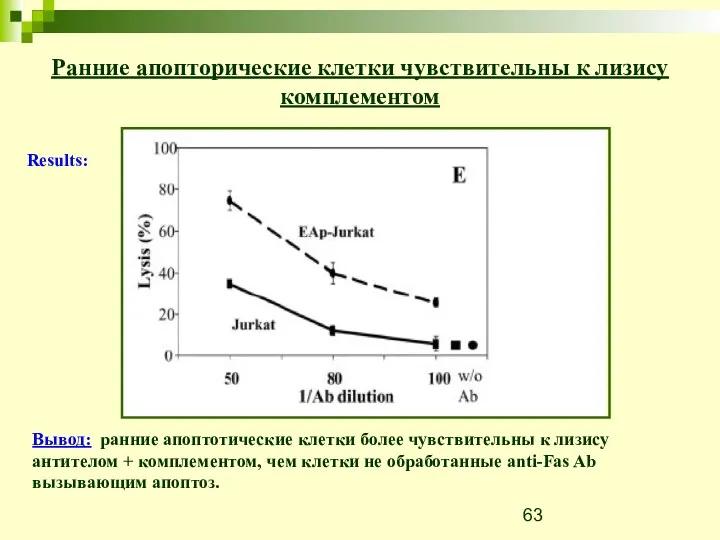
- 62. Ранние апопторические клетки чувствительны к лизису комплементом Цель: проверить интеракцию между ранними апоптотическими клетками и системой
- 63. Вывод: ранние апоптотические клетки более чувствительны к лизису антителом + комплементом, чем клетки не обработанные anti-Fas
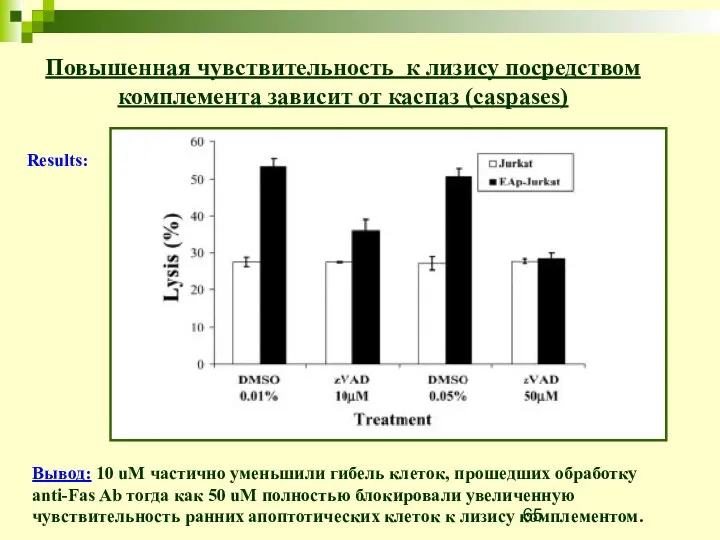
- 64. Повышенная чувствительность к лизису посредством комплемента зависит от каспаз (caspases) Цель: проверить участвуют ли каспазы к
- 65. Повышенная чувствительность к лизису посредством комплемента зависит от каспаз (caspases) Вывод: 10 uM частично уменьшили гибель
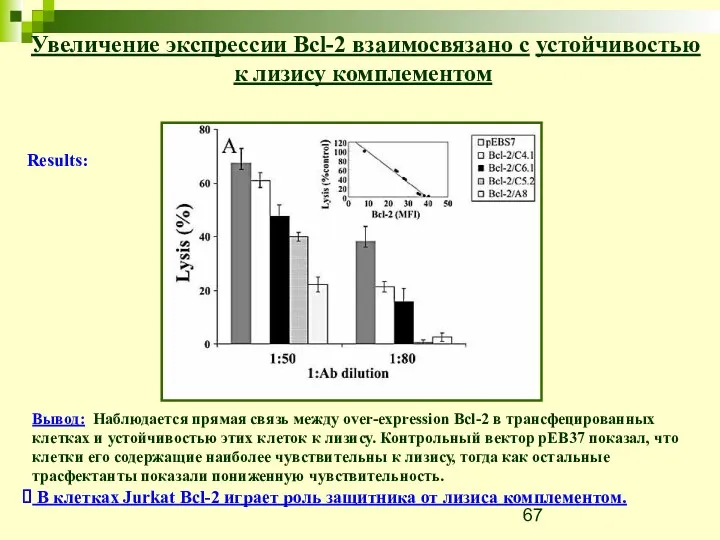
- 66. Увеличение экспрессии Bcl-2 взаимосвязано с устойчивостью к лизису комплементом Анти-апоптотические эффекты Bcl-2 хорошо известны. Этот белок
- 67. Увеличение экспрессии Bcl-2 взаимосвязано с устойчивостью к лизису комплементом Results: Вывод: Наблюдается прямая связь между over-expression
- 69. Скачать презентацию



























 Тыныс алудың маңызы. Тыныс алу мүшелері көмей бронхылар кеңірдек
Тыныс алудың маңызы. Тыныс алу мүшелері көмей бронхылар кеңірдек Металды қалыпталған сауытты дайындауда қолданылатын болат маркасы
Металды қалыпталған сауытты дайындауда қолданылатын болат маркасы Средства, влияющие на Н-холинорецепторы. Н-холиномиметики. Ганглиоблокаторы. Миорелаксанты периферического действия (Лекция 5)
Средства, влияющие на Н-холинорецепторы. Н-холиномиметики. Ганглиоблокаторы. Миорелаксанты периферического действия (Лекция 5) Особенности фармакокинетики и фармакотерапии в неонатальном периоде
Особенности фармакокинетики и фармакотерапии в неонатальном периоде Острые промиелоцитарные лейкозы
Острые промиелоцитарные лейкозы Журектiн аускультациясы патологияда
Журектiн аускультациясы патологияда Промывание желудка
Промывание желудка Осложнения желудочно-кишечного тракта внутриутробного развития
Осложнения желудочно-кишечного тракта внутриутробного развития Продуктивное воспаление
Продуктивное воспаление 05. медичне страхування
05. медичне страхування Рестриктивные кардиомиопатии. Формы РКМП
Рестриктивные кардиомиопатии. Формы РКМП Опухоли слюнных желез
Опухоли слюнных желез Изосерологическая несовместимость крови матери и плода
Изосерологическая несовместимость крови матери и плода Болезнь Лайма
Болезнь Лайма Рак яичников
Рак яичников Введение в доказательную медицину
Введение в доказательную медицину Вплив алкоголю на дітей та підлітків
Вплив алкоголю на дітей та підлітків Дерматомиозит
Дерматомиозит Кавказские Минеральные Воды
Кавказские Минеральные Воды Профессиональная гигиена полости рта
Профессиональная гигиена полости рта Т-20С.31 янв
Т-20С.31 янв Дифференциально-диагностический поиск у пациентов с гипогликемическим синдромом
Дифференциально-диагностический поиск у пациентов с гипогликемическим синдромом Сердце, аорта, кровь, вены, капилляры
Сердце, аорта, кровь, вены, капилляры Ларингит
Ларингит Проблемы нормативного обеспечения в сфере информатизации здравоохранения
Проблемы нормативного обеспечения в сфере информатизации здравоохранения Қан айналымды зерттеу әдістері. Интегралдық және регионарлық реография. Реография
Қан айналымды зерттеу әдістері. Интегралдық және регионарлық реография. Реография Анемия у детей
Анемия у детей Клиническая характеристика больных и оказание неотложной помощи при почечной колике
Клиническая характеристика больных и оказание неотложной помощи при почечной колике