Содержание
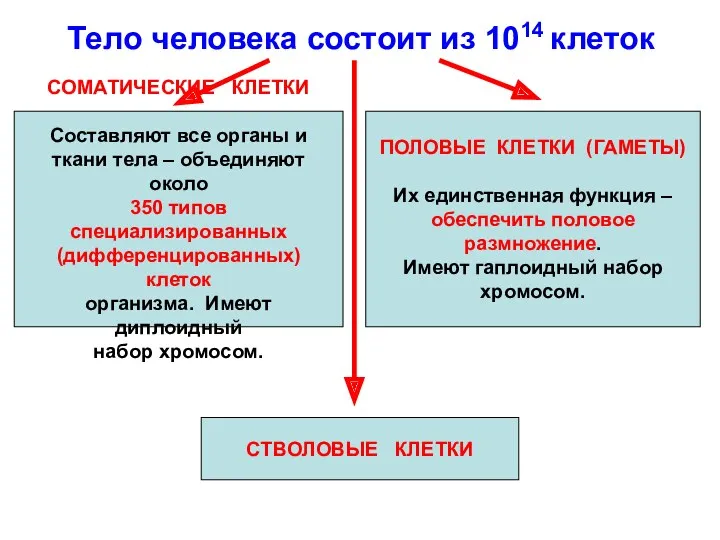
- 2. Тело человека состоит из 1014 клеток СОМАТИЧЕСКИЕ КЛЕТКИ Составляют все органы и ткани тела – объединяют
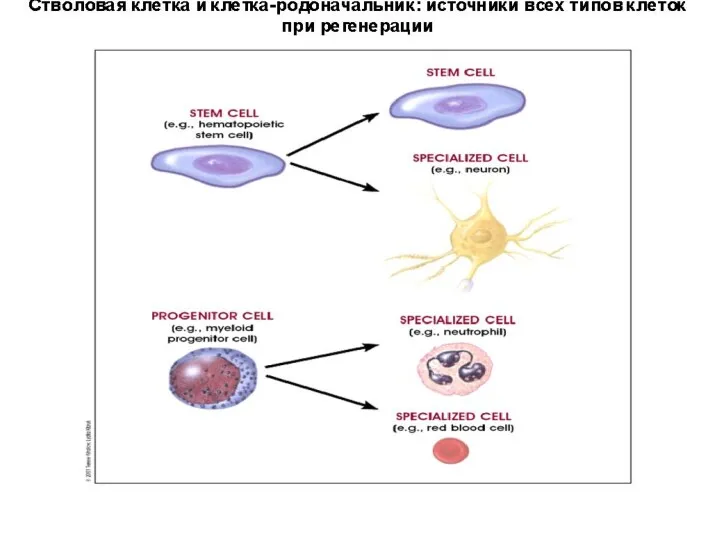
- 3. СТВОЛОВАЯ КЛЕТКА – примитивная, незрелая, (недифференцированная) клетка, присутствующая в многоклеточном организме. Она может длительное время сохранять
- 4. Историческая справка 1896 г. - Вильсон, изучая сперматогенез, вы- сказал гипотезу о наличии в ткани СК,
- 5. 20-30 годы – русский врач, эмигрант Воронцов успешно практикует в Париже – «сеансы омоложения» путем пересадки
- 6. 1960 г. – Алтман и Дас открыли явление нейрогенеза у взрослого человека (сущест- вование СК в
- 7. 1968/69 гг. – Томас осуществил успешное лечение лейкемии путем пересадки костного мозга между родными братьями. 1970
- 8. 1978 г. – в крови пупочного канатика человека обнаружены гематопоэтические СК. 1981 г. - Мартин Эванс
- 9. 1998 г. – Джеймс Томсон и Джон Беккер (США) запатентовали 5 протоколов полу-чения линий ЭСК человека.
- 10. 2001 г. – первая попытка лечения ИМ с помощью СК. 2003 г. – Сингтао Ни выделил
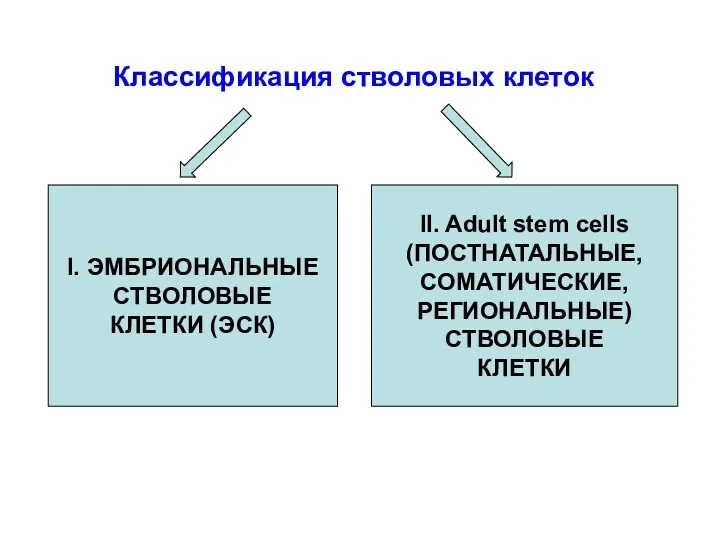
- 11. I. ЭМБРИОНАЛЬНЫЕ СТВОЛОВЫЕ КЛЕТКИ (ЭСК) II. Adult stem cells (ПОСТНАТАЛЬНЫЕ, СОМАТИЧЕСКИЕ, РЕГИОНАЛЬНЫЕ) СТВОЛОВЫЕ КЛЕТКИ Классификация стволовых
- 12. Эмбриональные стволовые клетки
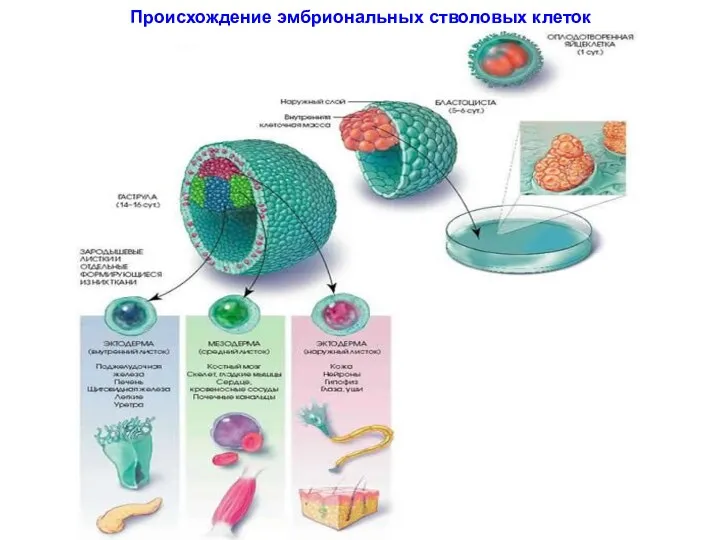
- 13. I. Эмбриональные СК Образуют «внутреннюю клеточную массу» (эмбриобласт) внутри бластоциста – стадия зародыша (эмбриона) до его
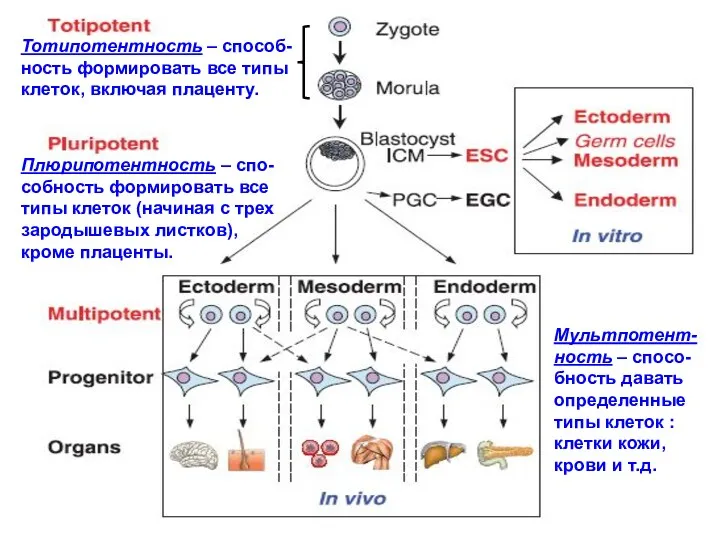
- 14. Тотипотентность – способ- ность формировать все типы клеток, включая плаценту. Плюрипотентность – спо- собность формировать все
- 15. Из схемы следует, что: тотипотентны только те клетки, из которых состоит зародыш на стадии морула (8-16
- 16. Происхождение эмбриональных стволовых клеток
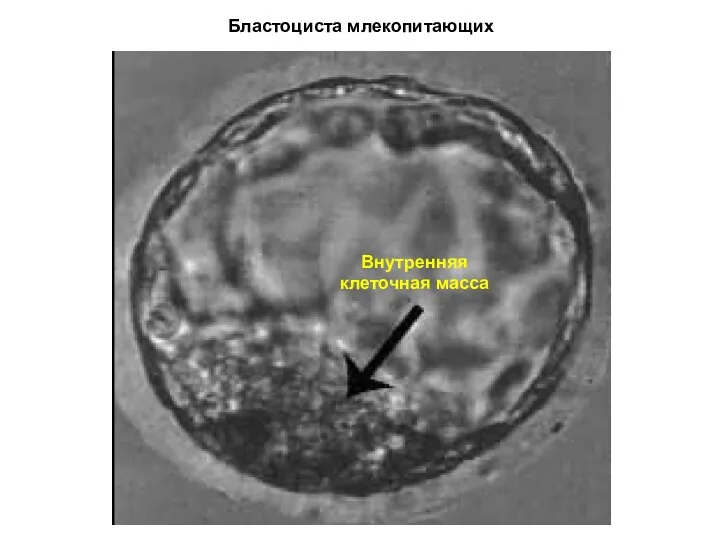
- 17. Бластоциста млекопитающих Внутренняя клеточная масса
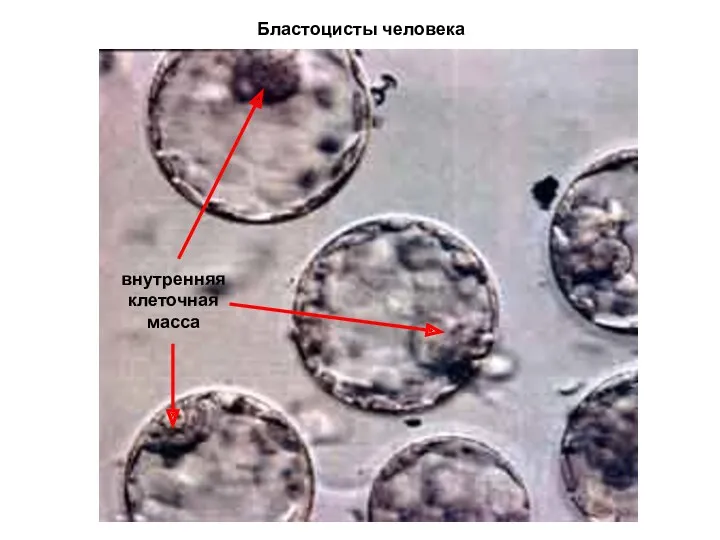
- 18. Бластоцисты человека внутренняя клеточная масса
- 19. Бластоцист – состоит из 2-х типов клеток: ЭСК и трофобластов. Трофобласты образуют оболочку, питают ЭСК, участвуют
- 20. Геном ЭСК находится в «нулевой точке» (G1 – фаза клеточного цикла). В ЭСК еще не включен
- 21. ФУНДАМЕНТАЛЬНЫЕ СВОЙСТВА ЭСК (в равной мере этими свойствами должны обладать также линии ЭСК, полученные искусственно) Способность
- 22. 2. Высокая активность теломеразы (быстрое и эффективное восстановление длины тело-мера хромосомы), что объясняет способность ЭСК к
- 23. 5. Способность формировать тератому после введения в ткани иммунодефицитных мышей. Это доброкачественная опухоль, гистологи-чески представляет собой
- 24. 8. Способность образовывать химеру: ЭСК от одной мыши вводятся в бластоцист другой мыши. Развивающийся организм несет
- 25. Механизмы поддержания «стволовости» (stemness) ЭСК Сигнальные пути, опосредуемые Янус-киназой и транскрипционным фактором STAT. Есть и другие
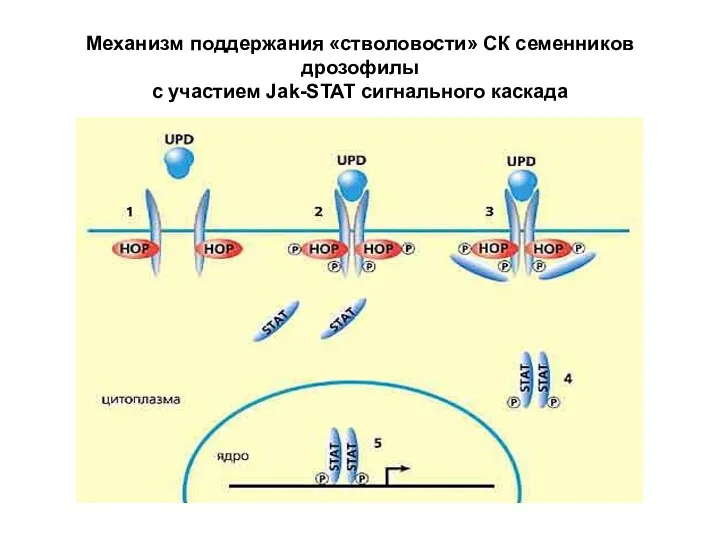
- 26. Механизм поддержания «стволовости» СК семенников дрозофилы с участием Jak-STAT сигнального каскада
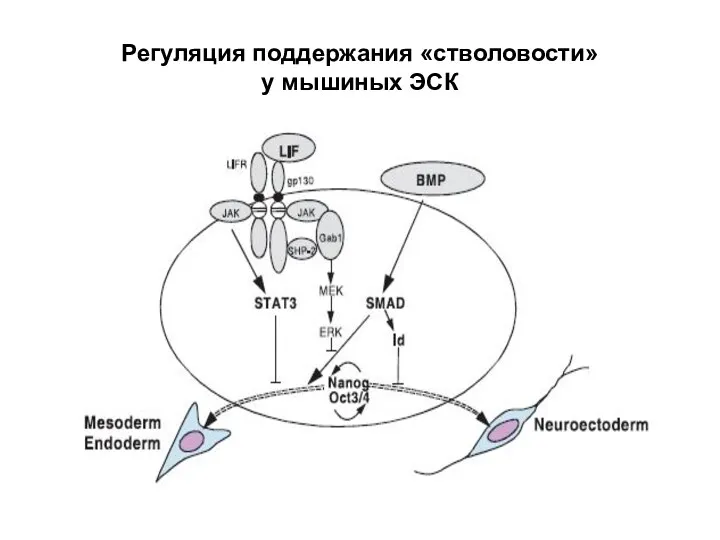
- 27. Регуляция поддержания «стволовости» у мышиных ЭСК
- 28. Практика показала, что культивировать ЭСК гораздо сложнее, чем дифференциро-ванные соматические клетки. ЭСК человека оказались гораздо «требовательнее»,
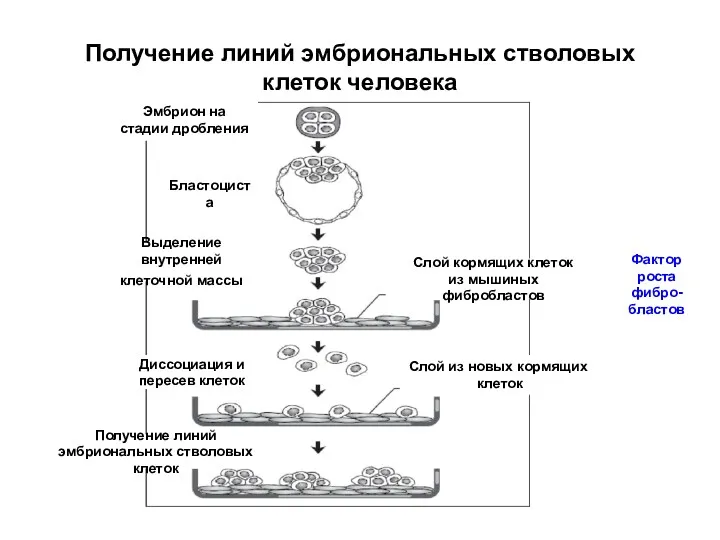
- 29. Получение линий эмбриональных стволовых клеток человека Эмбрион на стадии дробления Бластоциста Выделение внутренней клеточной массы Слой
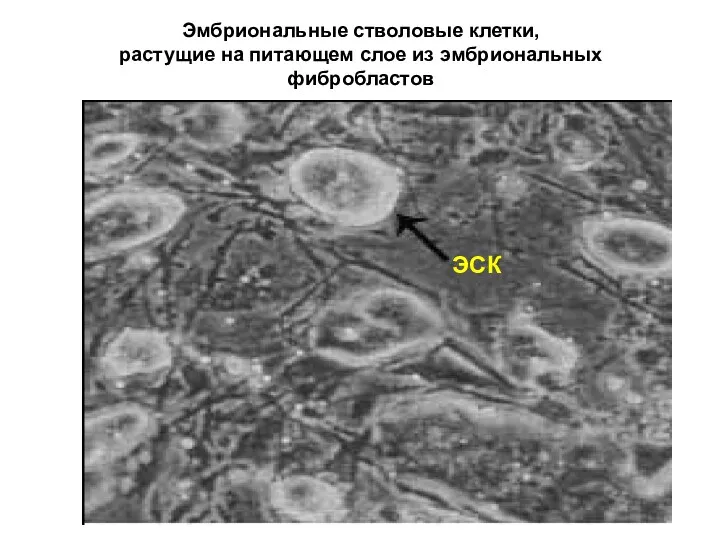
- 30. Эмбриональные стволовые клетки, растущие на питающем слое из эмбриональных фибробластов ЭСК
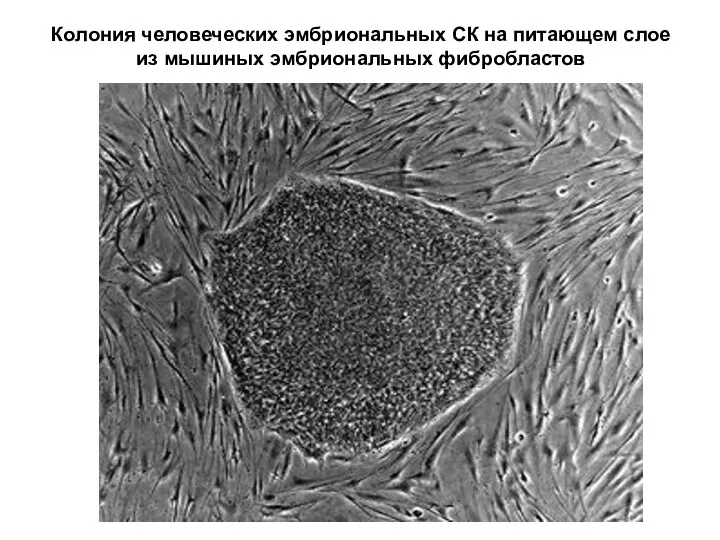
- 31. Колония человеческих эмбриональных СК на питающем слое из мышиных эмбриональных фибробластов
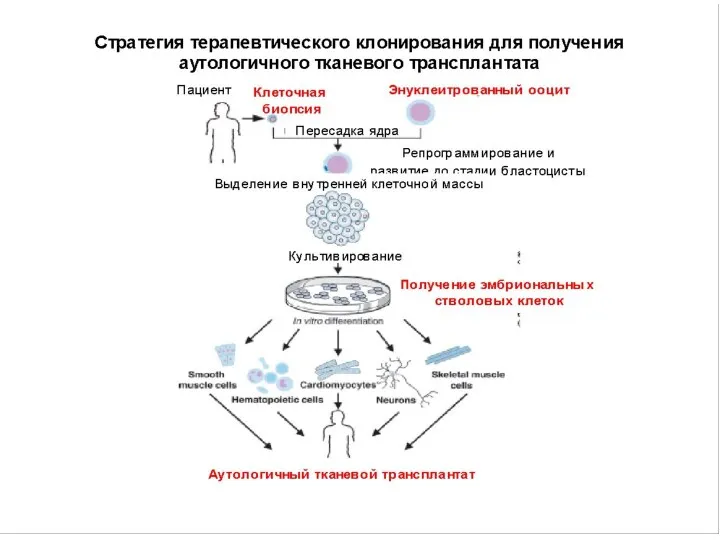
- 32. На сегодняшний день нет ни одной линии ЭСК, готовых для клинического применения. В большинстве стран получение
- 33. Постнатальные стволовые клетки (adult stem cell)
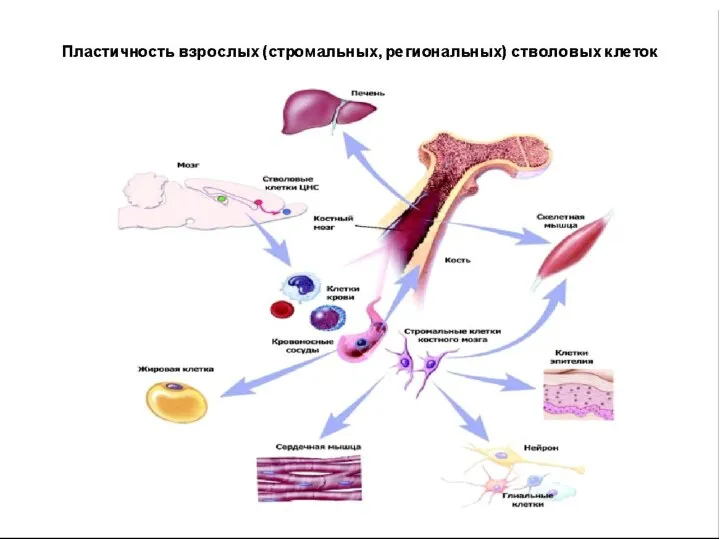
- 34. II. Постнатальные СК = adult stem cell (обладают мультипотентностью) Фетальные СК – абортивный материал, 9-12 недели
- 35. Стромальные (мезенхимальные) СК – костный мозг. Здесь содержится большая часть СК взрослого организма: - кроветворные СК
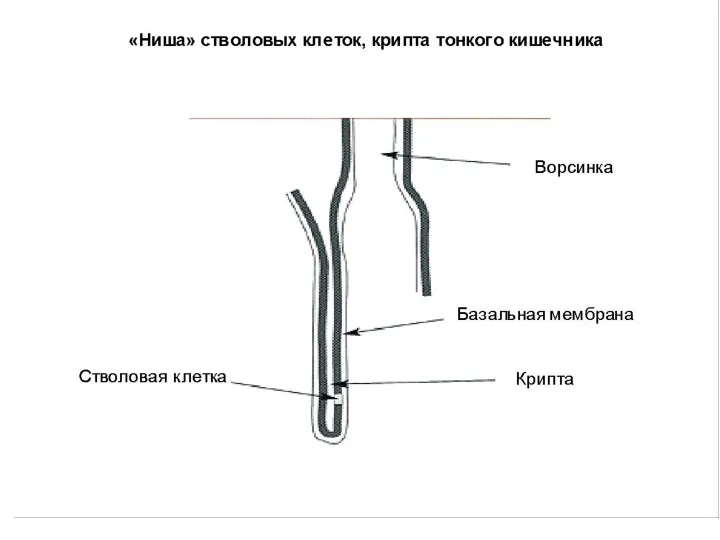
- 36. Эпителиальные СК – складки (крипты) сли-зистой оболочки тонкого кишечника. Дают начало многим типам клеток ЖКТ. СК
- 37. Биологическая функция постнатальных СК – поддержание клеточного гомеостаза ткани путем замены мертвых или поврежденных клеток на
- 38. Если для использования ЭСК в клеточной терапии существуют этические и религиозные запреты, обусловленные необходимостью разрушения бластоциты
- 39. Во взрослом организме наиболее богаты СК кровь из пуповины и, особенно, костный мозг. Так, стромальные СК
- 41. С возрастом число постнатальных СК уменьшается: число СК в костном мозге: Новорожденный …………….1 СК /10.000 Подросток………….…..в
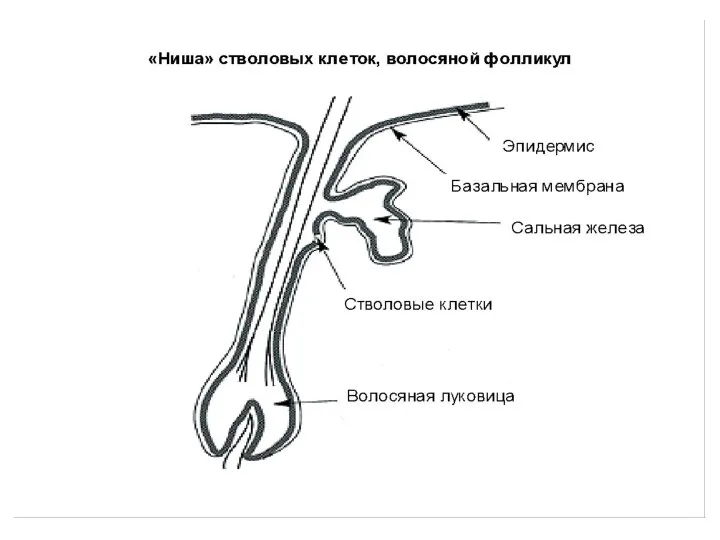
- 42. Представления о «нише» СК Постнатальная СК существует in vivo в особом микроокружении – «нише». «Ниша» обеспечивает
- 43. Характерные свойства «ниши» СК Наличие базальной мембраны. Наличие молекул-сигнализаторов (факторы роста и др.), поступающих из внеклеточного
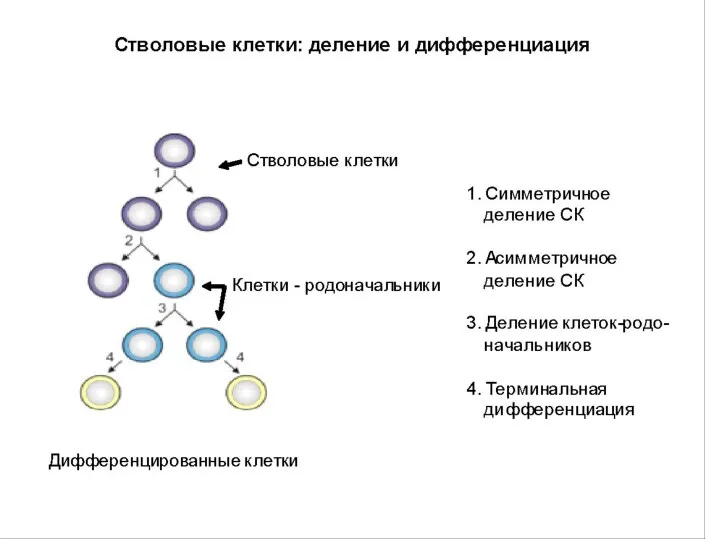
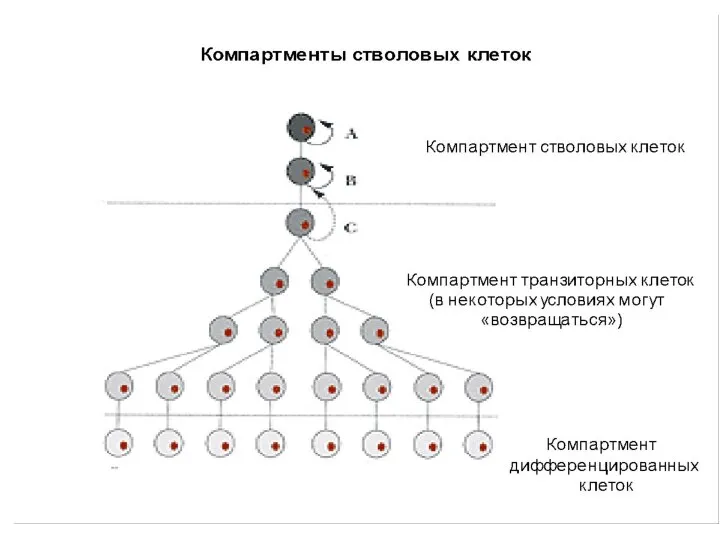
- 46. Типы деления постнатальных СК Симметричное деление – образуется две идентичные СК 2. Асимметричное деление – 1
- 50. Свойства постнатальных СК Если ЭСК плюрипотентны, то постнатальные СК – мультипотентны, то есть обладают способностью увеличивать
- 51. В отличии от грызунов, чьи постнатальные СК сравнительно легко выращивать в культуре, постнатальные СК человека имеют
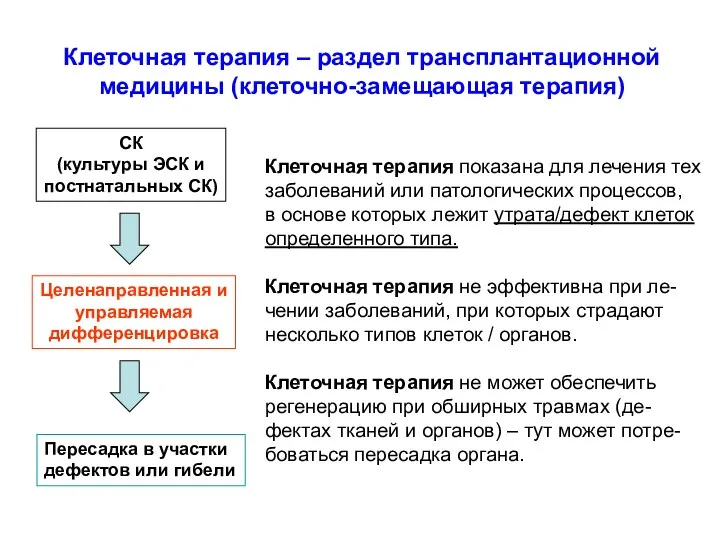
- 52. Клеточная терапия – раздел трансплантационной медицины (клеточно-замещающая терапия) СК (культуры ЭСК и постнатальных СК) Целенаправленная и
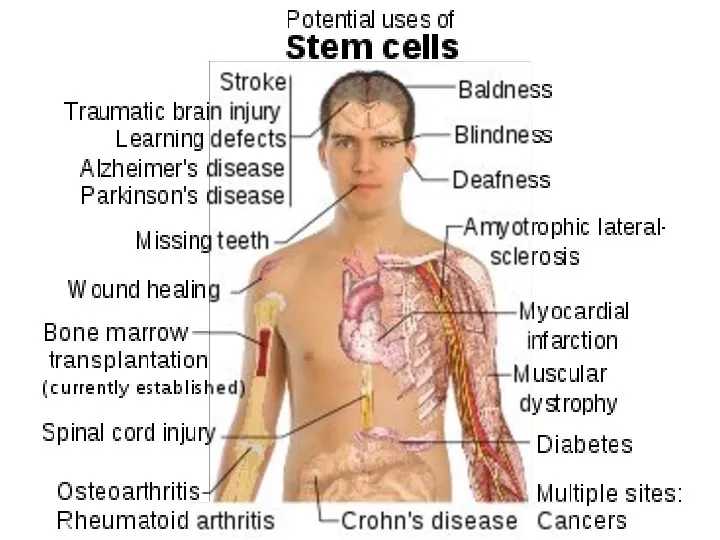
- 53. Некоторые заболевания, для лечения которых показана клеточная терапия (По результатам обследования населения США, 2000 г.) Заболевания
- 57. В настоящее время существует один вид полноценной клеточной терапии: пересадка костного мозга для лечения лейкемии.
- 58. Препятствия и проблемы на пути к терапии стволовыми клетками Отсутствуют линии ЭСК, пригодные для клинического применения
- 59. В марте 2009 года Б. Обама отменил запрет на исследования с использо-ванием человеческих эмбриональ-ных стволовых клеток,
- 61. Скачать презентацию





































 Спонтанды пневмоторакс кезіндегі визуалды зерттеу әдістері
Спонтанды пневмоторакс кезіндегі визуалды зерттеу әдістері Вирусные дерматозы
Вирусные дерматозы Клиническая и биологическая смерть
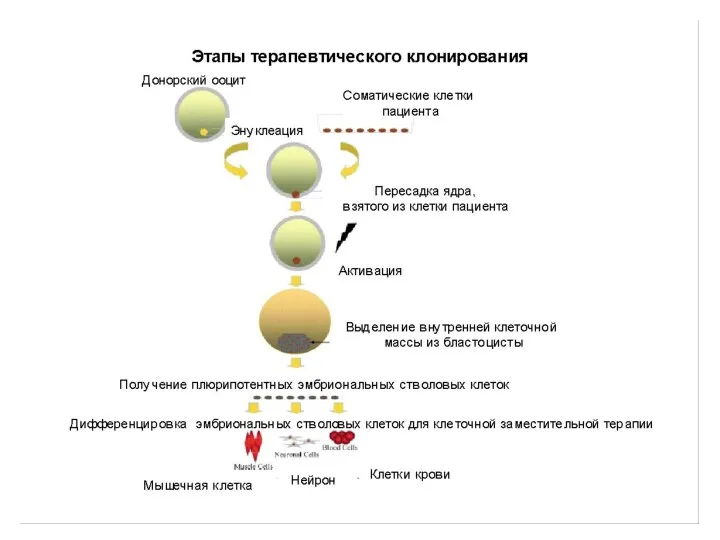
Клиническая и биологическая смерть Эффективность лапароскопической аппендэктомии
Эффективность лапароскопической аппендэктомии Мочевой пузырь
Мочевой пузырь Методы изучения общественного здоровья и здравоохранения
Методы изучения общественного здоровья и здравоохранения Кровоснабжение челюстнолицевой области
Кровоснабжение челюстнолицевой области Асептика. Антисептика
Асептика. Антисептика Десмургия
Десмургия Понятие стресс. Фазы стресса. Схема развития стресс-реакции
Понятие стресс. Фазы стресса. Схема развития стресс-реакции Генитальды эндометриозы емдеуде, әйелдердің фертильділігін қалыптастыру мақсатындағы хирургиялық немесе гормональды ем
Генитальды эндометриозы емдеуде, әйелдердің фертильділігін қалыптастыру мақсатындағы хирургиялық немесе гормональды ем Патология белой крови
Патология белой крови Общая характеристика СДВГ. Психологические причины возникновения СДВГ
Общая характеристика СДВГ. Психологические причины возникновения СДВГ Подострый тиреоидит
Подострый тиреоидит Синдром Дауна
Синдром Дауна Дәрілік заттардың өзара әрекеттесуі
Дәрілік заттардың өзара әрекеттесуі Мүгедектік деген не
Мүгедектік деген не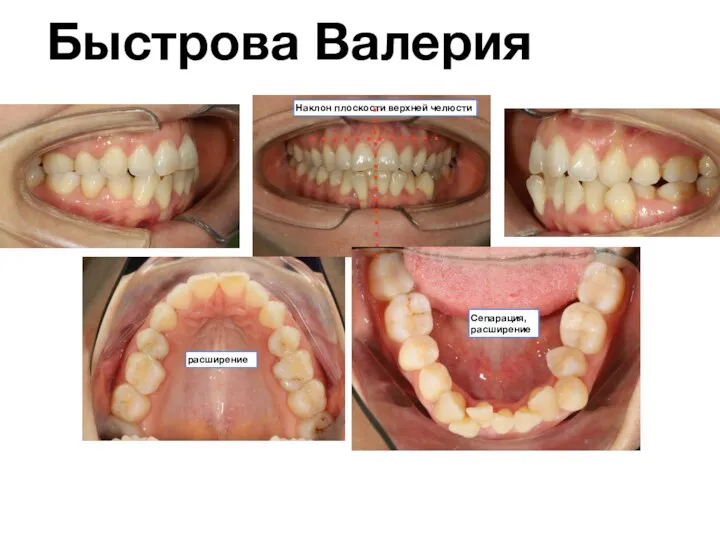 Стоматология. Клинический случай
Стоматология. Клинический случай Консультирование как неотъемлемый компонент качества услуг. Контрацепция после аборта
Консультирование как неотъемлемый компонент качества услуг. Контрацепция после аборта Особенности клинического течения огнестрельных ранений нижней челюсти
Особенности клинического течения огнестрельных ранений нижней челюсти Инфильтративный туберкулез легких
Инфильтративный туберкулез легких Нарушения ритма и проводимости
Нарушения ритма и проводимости Наблюдение и уход за больными с заболеваниями органов пищеварения
Наблюдение и уход за больными с заболеваниями органов пищеварения Физиотерапия. Амплипульстерапия
Физиотерапия. Амплипульстерапия Панариций және оның түрлері
Панариций және оның түрлері Современный взгляд на невынашивание беременности – возможности лечения
Современный взгляд на невынашивание беременности – возможности лечения Лабораторні методи діагностики в ревматології
Лабораторні методи діагностики в ревматології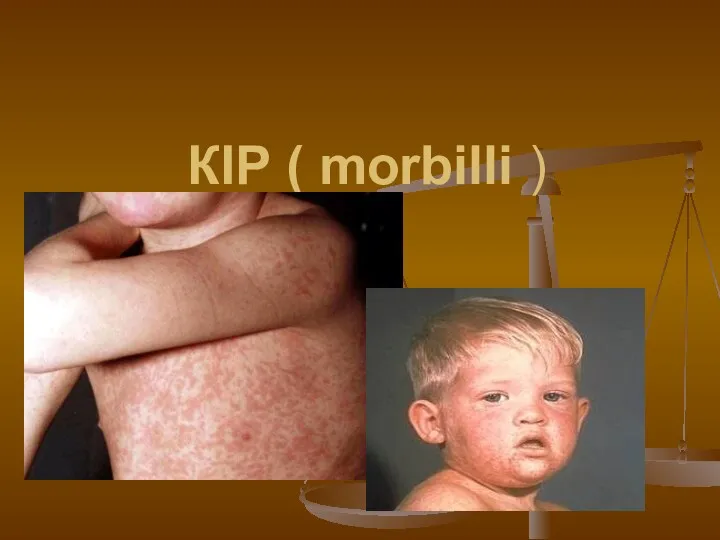 Гостра повітряно-краплина інфекція КІР
Гостра повітряно-краплина інфекція КІР