Содержание
- 2. Элекролиты – это вещества, водные растворы или расплавы которых проводят электрический ток (кислоты, основания, соли). Основные
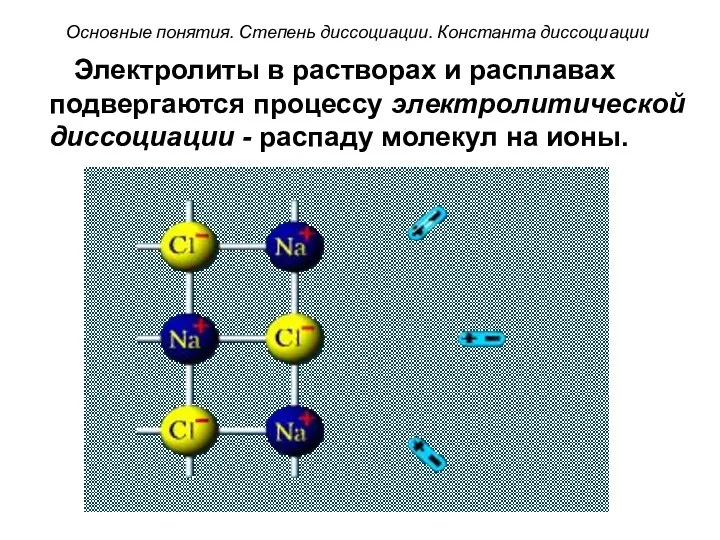
- 3. Электролиты в растворах и расплавах подвергаются процессу электролитической диссоциации - распаду молекул на ионы. Основные понятия.
- 4. Количественной характеристикой способности электролита распадаться на ионы является величина степени диссоциации электролита (α), которая показывает отношение
- 5. Раствор сахарозы Неэлектролиты: α = 0 Не проводят электрический ток Основные понятия. Степень диссоциации. Константа диссоциации
- 6. По величине α электролиты классифицируют на: 1. Сильные электролиты: α > 0,3 (больше 30%), в разбавленных
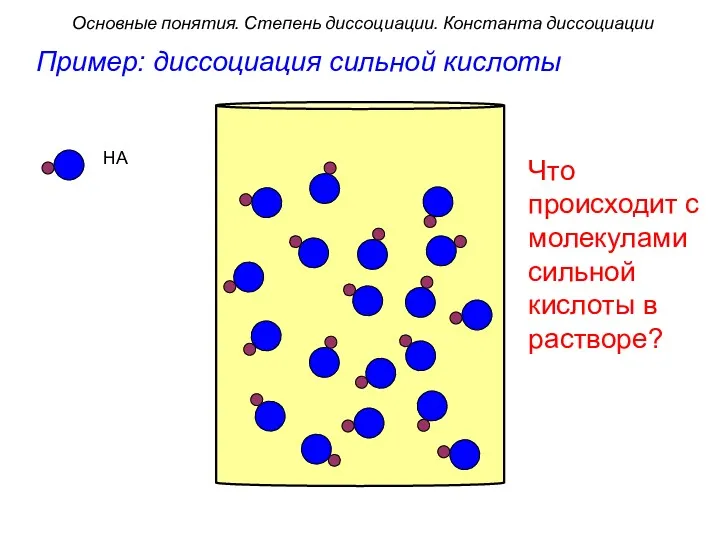
- 7. HA Пример: диссоциация сильной кислоты Что происходит с молекулами сильной кислоты в растворе? Основные понятия. Степень
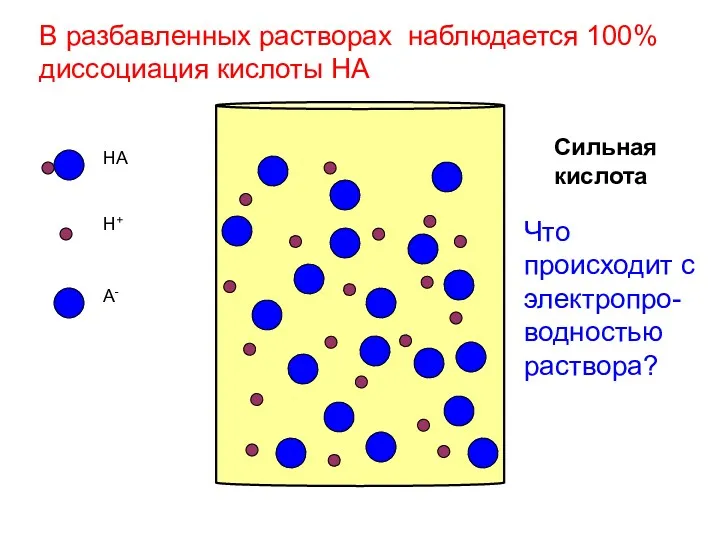
- 8. HA H+ A- Сильная кислота В разбавленных растворах наблюдается 100% диссоциация кислоты HA Что происходит с
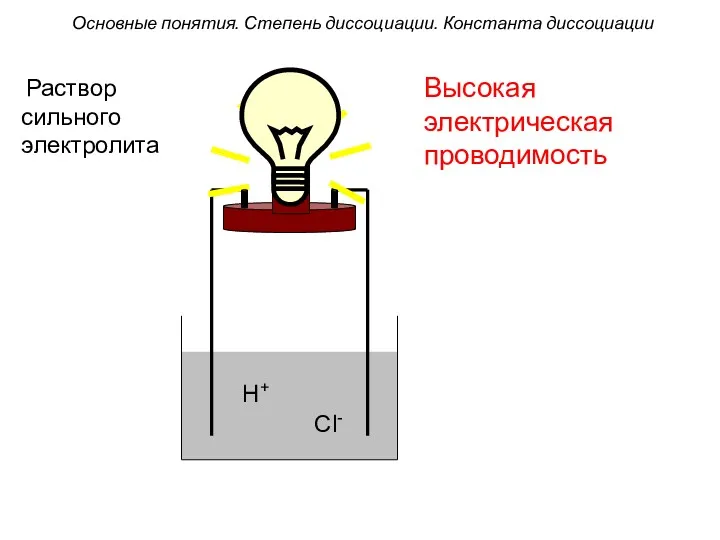
- 9. H+ Cl- Высокая электрическая проводимость Основные понятия. Степень диссоциации. Константа диссоциации Раствор сильного электролита
- 10. 2. Средней силы электролиты 0,3 > α > 0,03 (от 3 до 30 %) Н-р: H3PO4,
- 11. Слабые электролиты α Основные понятия. Степень диссоциации. Константа диссоциации Н-р: H2CO3, H2S, H2SiO3, HNO2, CH3COOH и
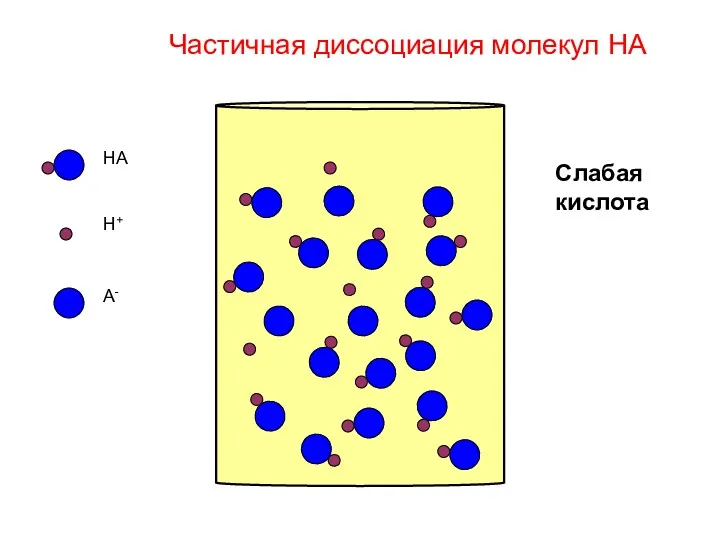
- 12. HA H+ A- Слабая кислота Частичная диссоциация молекул HA
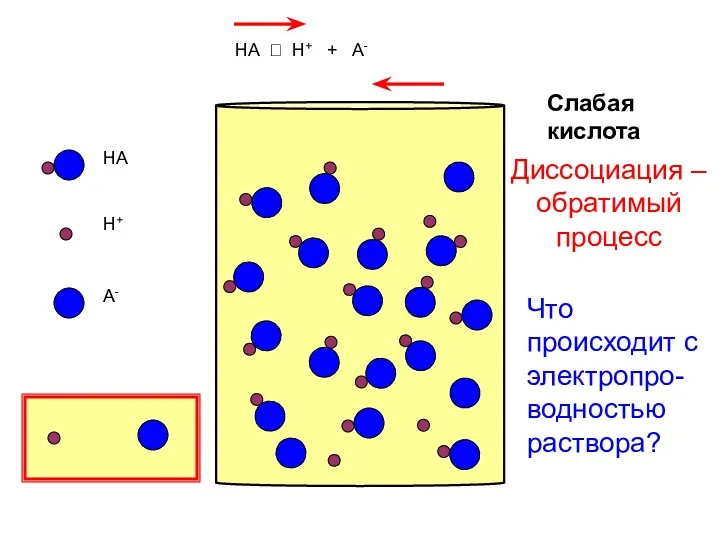
- 13. HA H+ A- Слабая кислота HA ⮀ H+ + A- Диссоциация – обратимый процесс Что происходит
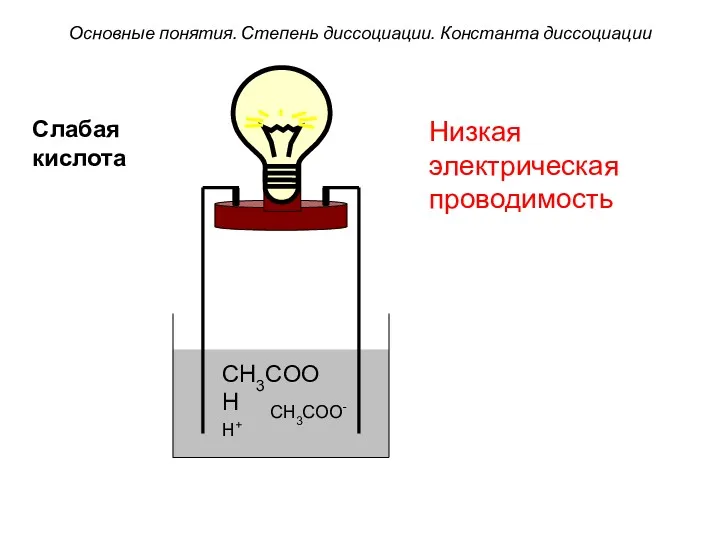
- 14. CH3COOH CH3COO- H+ Низкая электрическая проводимость Основные понятия. Степень диссоциации. Константа диссоциации Слабая кислота
- 15. Процесс диссоциации как равновесный обратимый процесс характеризуется константой диссоциации электролита. Для бинарного электролита: К А ⮀
- 16. Чем выше значение рКд, тем слабее диссоциирует электролит. Кд зависит от природы электролита, температуры и практически
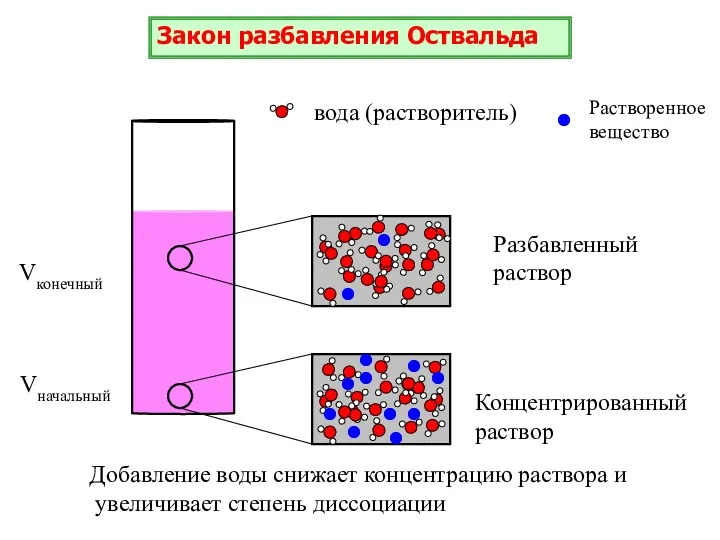
- 17. Для слабых электролитов справедлив закон Оствальда: степень диссоциации слабого электролита возрастает с разбавлением раствора. где V(X)–
- 18. вода (растворитель) Растворенное вещество Концентрированный раствор Разбавленный раствор Добавление воды снижает концентрацию раствора и увеличивает степень
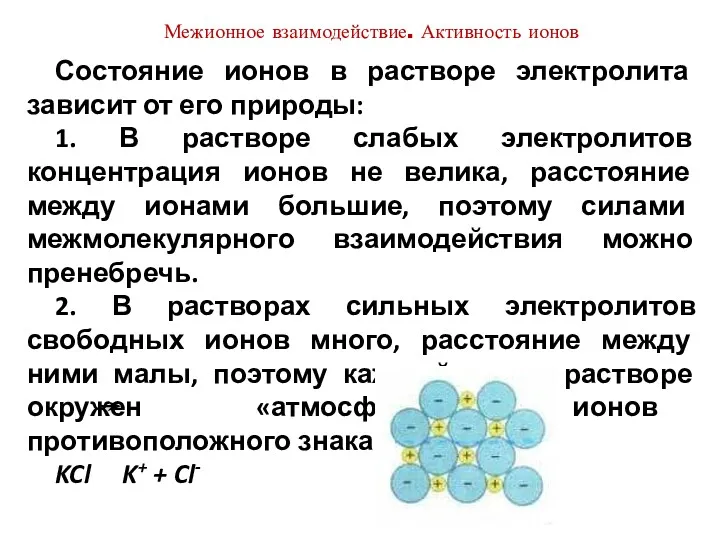
- 19. Состояние ионов в растворе электролита зависит от его природы: 1. В растворе слабых электролитов концентрация ионов
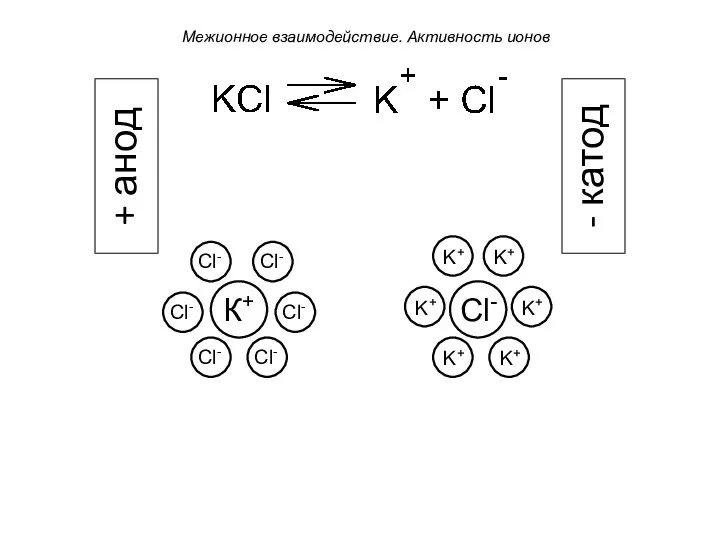
- 20. Если через раствор такого электролита пропускать электрический ток, погрузив в него электроды, то центральный ион начинает
- 21. Межионное взаимодействие. Активность ионов
- 22. Межионное взаимодействие. Активность ионов
- 23. + анод - катод Межионное взаимодействие. Активность ионов
- 24. Межионное взаимодействие. Активность ионов Для оценки концентрационных эффектов в растворах сильных электролитов вводится величина активности электролита
- 25. Активность или эффективная концентрация – это концентрация ионов в растворе с учетом сил межионного взаимодействия. Межионное
- 26. Активность связана с истинной концентрацией растворенного вещества соотношением: а(х)- активность электролита, моль·дм-3 С(х)- концентрация электролита, моль·дм-3
- 27. Если f(х)=1, тогда а(х)=С(х), ионы практически не связаны межионным взаимодействием. Это достигается в разбавленных растворах (C(x)≈10-4
- 28. Для количественной оценки суммарного влияния ионов друг на друга было введено понятие ионной силы раствора. Ионной
- 29. Для биологических систем in vivo: Iфиз = 0,15 моль·кг-1 Растворы, применяемые в медицинской практике и имеющие
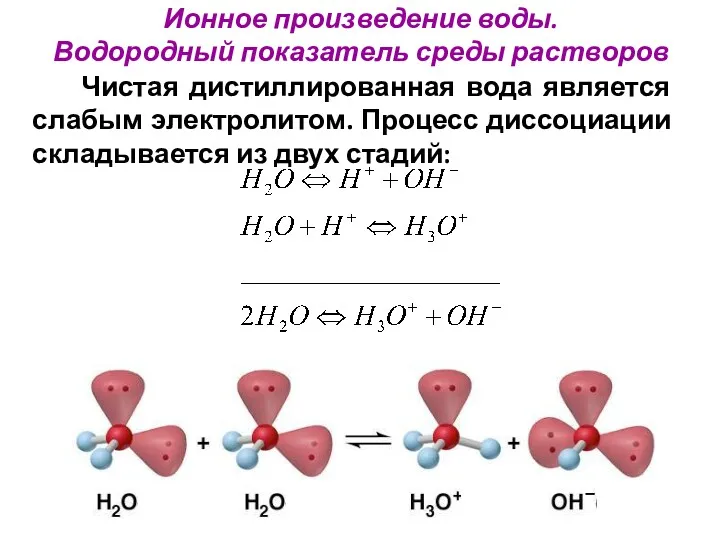
- 30. Ионное произведение воды. Водородный показатель среды растворов Чистая дистиллированная вода является слабым электролитом. Процесс диссоциации складывается
- 31. Константа диссоциации воды при 25˚С, определенная методом электрической проводимости, равна: Ионное произведение воды. Водородный показатель среды
- 32. Степень диссоциации воды очень мала (α=1,9 · 10-9), то есть из 555 млн. молекул только одна
- 33. Эту величину называют константой автоионизации воды (Кв) или ионным произведением воды: Ионное произведение воды. Водородный показатель
- 34. Увеличение С(Н+) приводит к уменьшению С(ОН-) и наоборот, т.е. эти величины сопряжены. В чистой дистиллированной воде
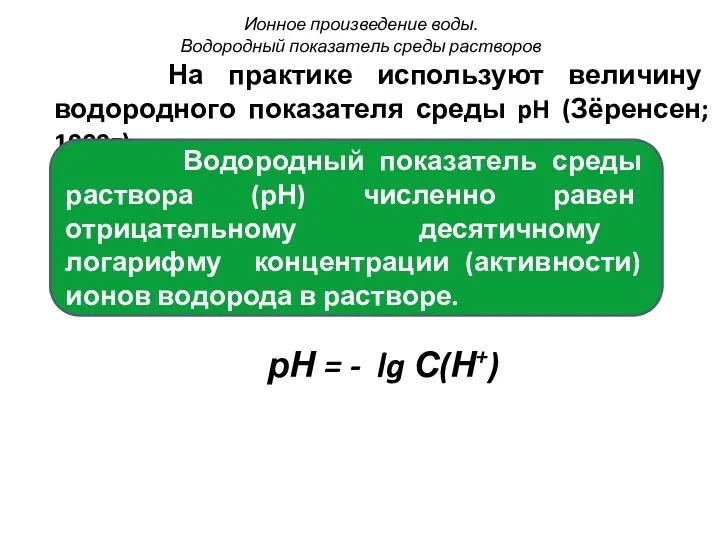
- 35. На практике используют величину водородного показателя среды pH (Зёренсен; 1909г). рН = - lg С(Н+) Ионное
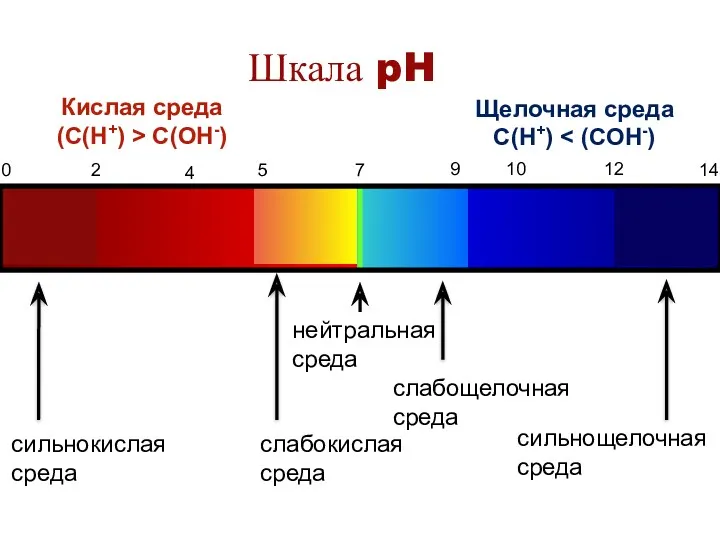
- 36. Ионное произведение воды. Водородный показатель среды растворов По величине рН различают: Нейтральную среду: рН = 7
- 37. Шкала pH 0 2 4 5 7 9 10 12 14 Кислая среда (С(H+) > С(OH-)
- 38. Гидроксильный показатель среды раствора (рОН) численно равен отрицательному десятичному логарифму концентрации (активности) гидроксид-ионов в растворе. рОН
- 39. С учетом показателей концентраций ионов преобразуем уравнение ионного произведения воды. Ионное произведение воды. Водородный показатель среды
- 40. Для биологических систем in vivo , с учетом температуры тела ≈ 37оС уравнение ионного произведения воды
- 41. Водородный показатель среды растворов Все вышеописанное относится к теории разбавленных растворов сильных электролитов. Для характеристики растворов
- 42. Водородный показатель среды растворов СН3СООН ⮀ Н+ + СН3СОО- (α потенц. к-ть актив. к-ть общая кислотность
- 43. Водородный показатель среды растворов Общая кислотность определяется титрованием раствора щелочью. Активную кислотность определяют потенциометрически. рН такого
- 44. Водородный показатель среды растворов Свободные протоны и молекулы кислот in vivo имеют разнообразную физиологическую активность, поэтому
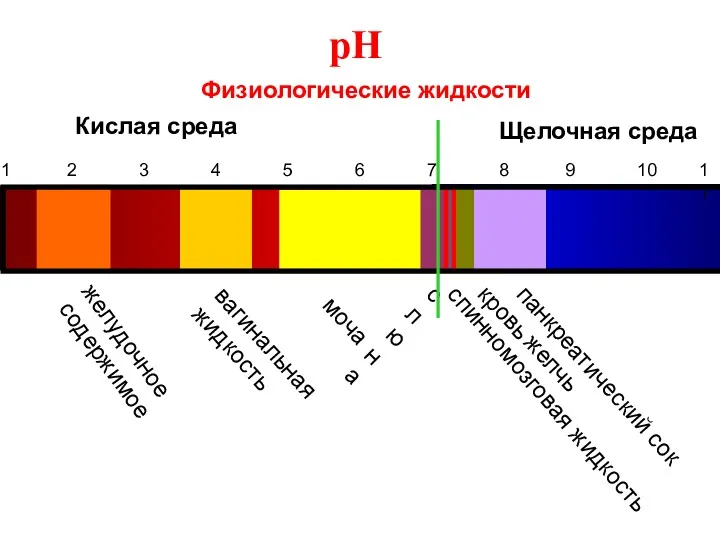
- 45. Биологическое значение pH Биологические жидкости характеризуются определенным и постоянным значением pH (в норме): рН крови ≈
- 46. pH 1 2 3 4 5 6 8 9 10 11 Физиологические жидкости желудочное содержимое вагинальная
- 47. Биологическое значение pH. Постоянство рН биологических сред является залогом нормальной работы организма. Это объясняется несколькими причинами:
- 48. Биологическое значение pH. Организм человека располагает тонкими механизмами регуляции происходящих в нем биохимических и физиологических процессов,
- 49. Биологическое значение pH. Изменения кислотности биологических сред, сопровождающиеся уменьшением pH называются ацидозом, а увеличением pH –
- 51. Скачать презентацию

































 Опухолевые маркеры: роль в клинической практике
Опухолевые маркеры: роль в клинической практике Кровь, её состав и функции. Группы крови
Кровь, её состав и функции. Группы крови Биопсия почек. Показания, методика проведения
Биопсия почек. Показания, методика проведения Анестезиология и реаниматология. Введение в дисциплину
Анестезиология и реаниматология. Введение в дисциплину Endodontics includes a treatment of root canals inside the tooth
Endodontics includes a treatment of root canals inside the tooth Влияние материала ИОЛ и величины передне-задней оси глаза при миопии на развитие вторичной катаракты в послеоперационный период
Влияние материала ИОЛ и величины передне-задней оси глаза при миопии на развитие вторичной катаракты в послеоперационный период Постуральный контроль
Постуральный контроль Тауарлар қорының құрылымы және классификациясы
Тауарлар қорының құрылымы және классификациясы Отработка. Особенности анатомического строения зубов боковой группы : премоляров , моляров верхней , нижней челюстей
Отработка. Особенности анатомического строения зубов боковой группы : премоляров , моляров верхней , нижней челюстей Медицинская визуализация мочевыделительной системы. Часть 1. Рентгенанатомия. Методы диагностики
Медицинская визуализация мочевыделительной системы. Часть 1. Рентгенанатомия. Методы диагностики Паровая стерилизация на фармацевтическом производстве. Компания Миллаб
Паровая стерилизация на фармацевтическом производстве. Компания Миллаб Укусы клещей
Укусы клещей Технология определения хим.свойств мочи
Технология определения хим.свойств мочи Оперативные доступы к органам брюшной полости
Оперативные доступы к органам брюшной полости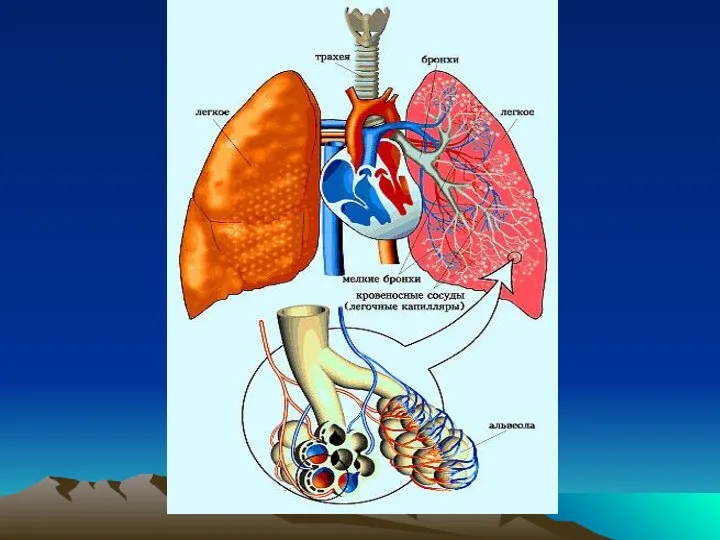 Инструментальные методы исследования. Синдромы при заболеваниях органов дыхания
Инструментальные методы исследования. Синдромы при заболеваниях органов дыхания Моторні функції мозочка. Моторні функції великих півкуль і базальних гангліїв
Моторні функції мозочка. Моторні функції великих півкуль і базальних гангліїв Рекомендации ESC по артериальной гипертензии
Рекомендации ESC по артериальной гипертензии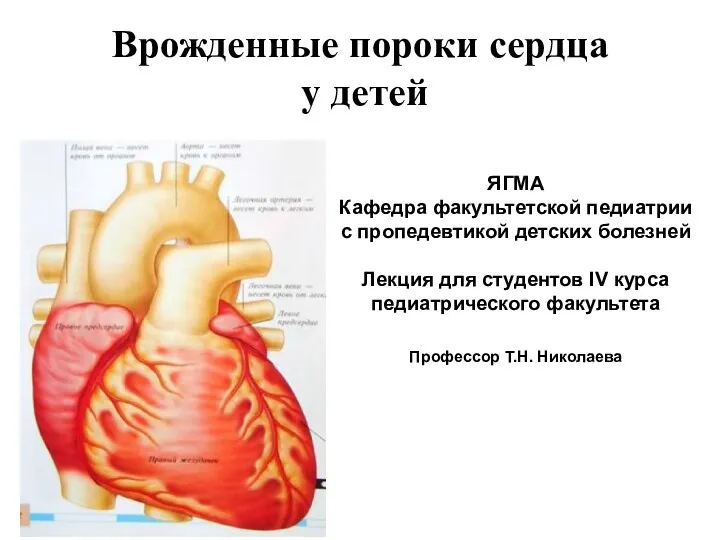 Врожденные пороки сердца у детей
Врожденные пороки сердца у детей Учение об инфекции патогенность и вирулентность микробов
Учение об инфекции патогенность и вирулентность микробов Предоперационный период. Операция. Послеоперационный период
Предоперационный период. Операция. Послеоперационный период Алкоголизм. Наркомания. Токсикомания
Алкоголизм. Наркомания. Токсикомания Реабилитация пациентов в гинекологии. Лекция №21
Реабилитация пациентов в гинекологии. Лекция №21 Ингаляционные методы анестезии у детей
Ингаляционные методы анестезии у детей Менингит. Менингококкты инфекция
Менингит. Менингококкты инфекция Новый продукт
Новый продукт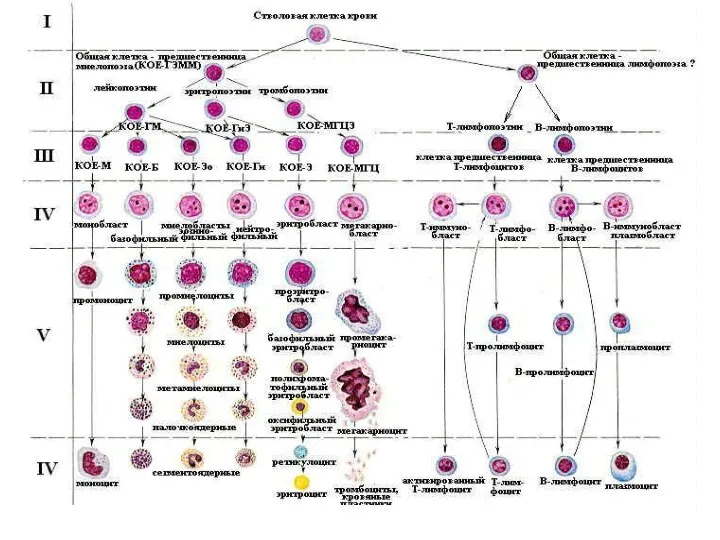 Эритрон. Показатели эритропоэза
Эритрон. Показатели эритропоэза Новые подходы в организации и проведении предварительных и периодических медицинских осмотров
Новые подходы в организации и проведении предварительных и периодических медицинских осмотров Сестринский процесс при уходе за пациентами с сахарным диабетом второго типа
Сестринский процесс при уходе за пациентами с сахарным диабетом второго типа