Содержание
- 2. «Иммунитет - это способ защиты организма от тел и веществ, несущих признаки генетически чужеродной информации.» -
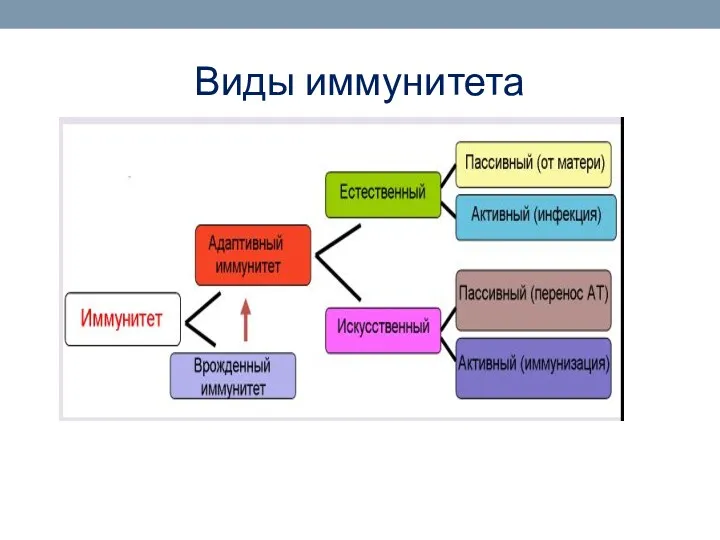
- 3. Виды иммунитета
- 4. Абсолютный врожденный иммунитет проявляется как полная невосприимчивость к чужеродному агенту. Например, домашние животные не восприимчивы к
- 5. Главные составляющие врожденного иммунитета
- 6. Молекулы-мишени иммунитета и распознающие их рецепторы 1. Образы патогенности или патоген-ассоциированные молекулярные паттерны PAMP (pathogen-associated molecular
- 7. Рецепторы для РАМР - PRRs Растворимые циркулирующие молекулы, такие как компоненты системы комплемента, взаимодействующие с микроорганизмами
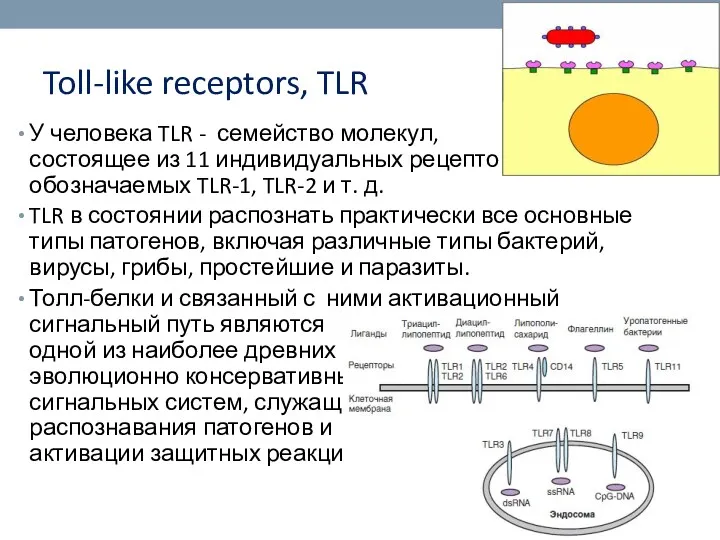
- 8. Toll-like receptors, TLR У человека TLR - семейство молекул, состоящее из 11 индивидуальных рецепторов, обозначаемых TLR-1,
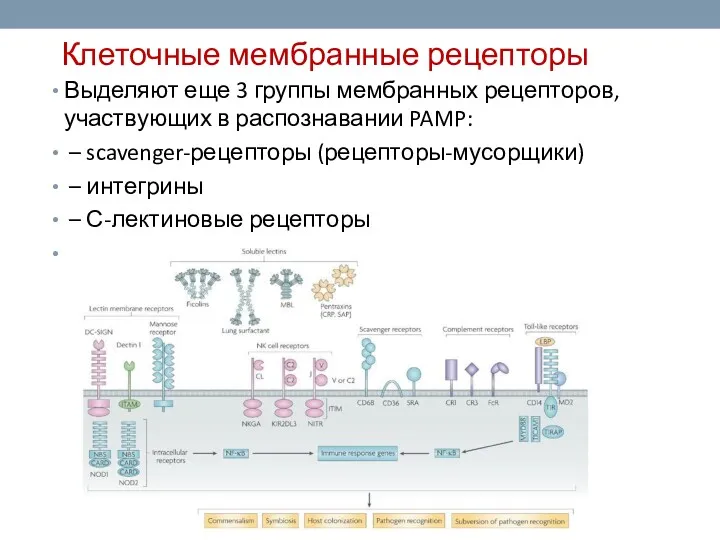
- 9. Клеточные мембранные рецепторы Выделяют еще 3 группы мембранных рецепторов, участвующих в распознавании PAMP: – scavenger-рецепторы (рецепторы-мусорщики)
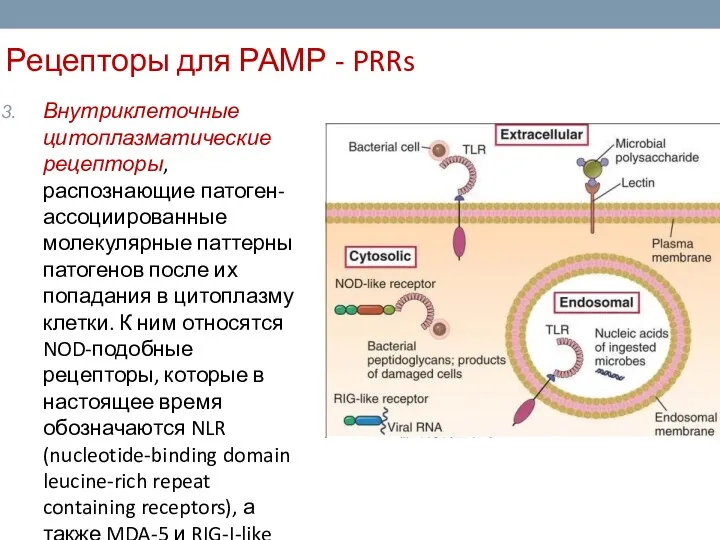
- 10. Рецепторы для РАМР - PRRs Внутриклеточные цитоплазматические рецепторы, распознающие патоген-ассоциированные молекулярные паттерны патогенов после их попадания
- 11. Некоторые NOD-подобные рецепторы распознают не только сигналы проникновения инфекции в клетку, но и т.н. немикробные „сигналы
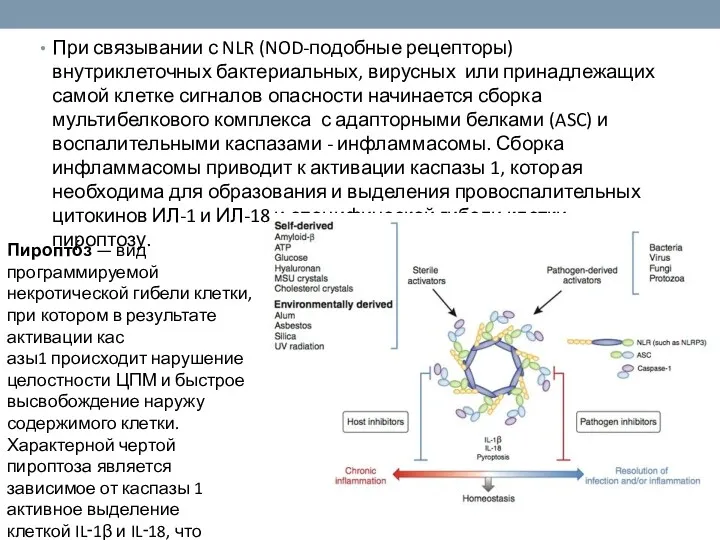
- 12. При связывании с NLR (NOD-подобные рецепторы) внутриклеточных бактериальных, вирусных или принадлежащих самой клетке сигналов опасности начинается
- 13. Молекулы-мишени иммунитета и распознающие их рецепторы 2. Антигены – высокомолекулярные соединения, способные стимулировать иммунокомпетентные клетки и
- 14. Молекулы-мишени иммунитета и распознающие их рецепторы 3. Стрессорные молекулы –собственные молекулы организма, экспрессируемые на мембране при
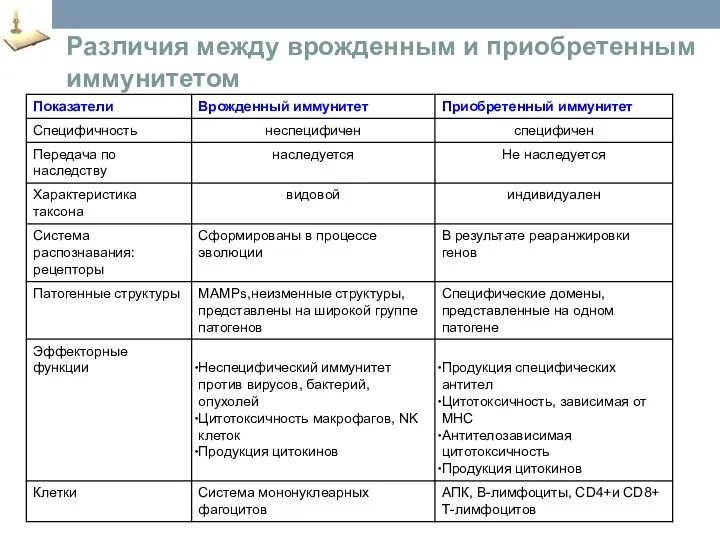
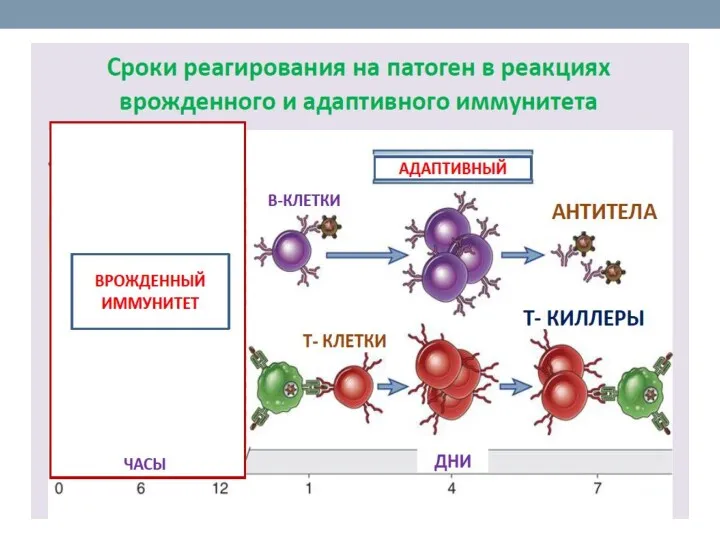
- 15. Различия между врожденным и приобретенным иммунитетом
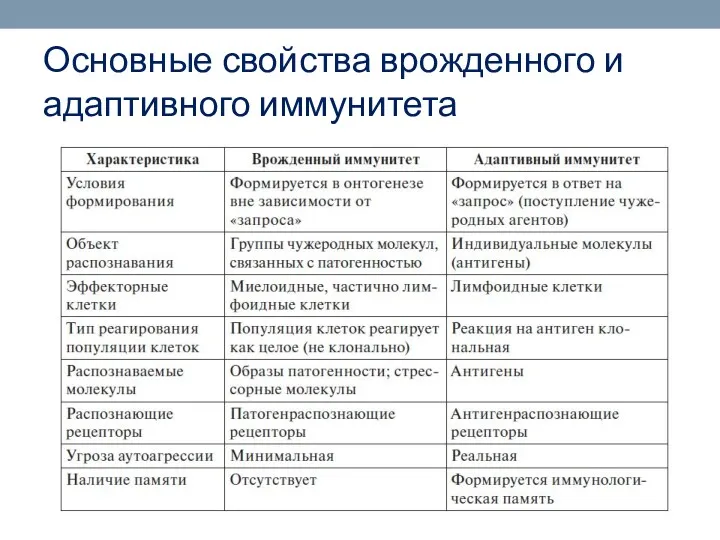
- 16. Основные свойства врожденного и адаптивного иммунитета
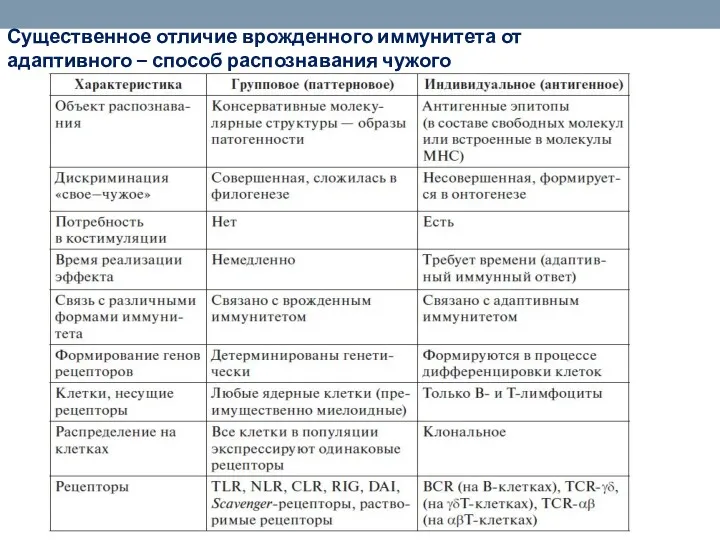
- 17. Существенное отличие врожденного иммунитета от адаптивного – способ распознавания чужого
- 18. Факторы врожденного иммунитета Наследуются Действуют быстро Распознают опасность Память отсутствует Механизмы отличаются от адаптивного иммунитета
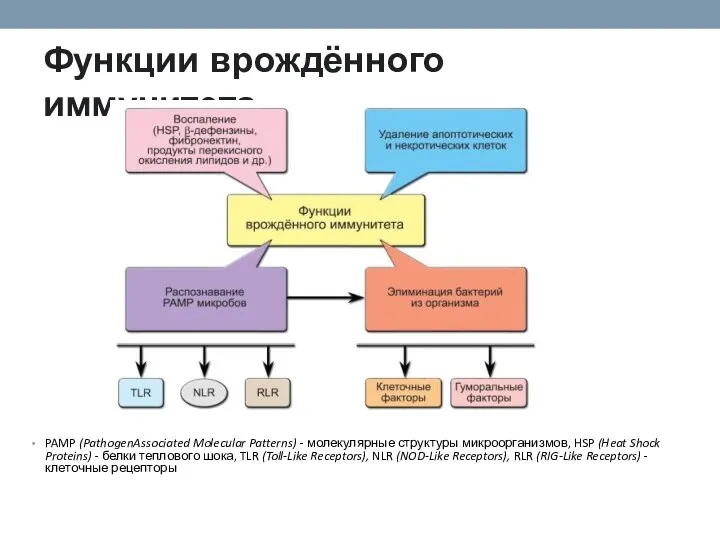
- 20. Функции врождённого иммунитета. PAMP (PathogenAssociated Molecular Patterns) - молекулярные структуры микроорганизмов, HSP (Heat Shock Proteins) -
- 21. Факторы врожденного иммунитета Условно факторы неспецифической защиты можно разбить на четыре типа: -Естественные барьеры: кожа и
- 22. Естественные барьеры Кожа человека выполняет в первую очередь механическую, барьерную функцию. Кожа подавляет колонизацию и размножение
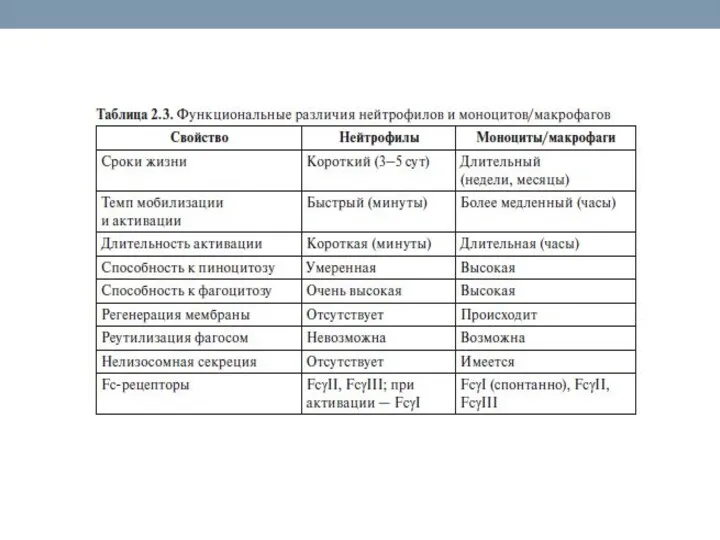
- 23. Клеточные факторы: миелоидные клетки – основа врожденного иммунитета Эффекторные клетки врожденного иммунитета: Нейтрофилы, моноциты и их
- 24. Вспомогательные клетки Эозинофилы – в крови менее суток, в тканях 10-12 суток. Роль в иммунной защите
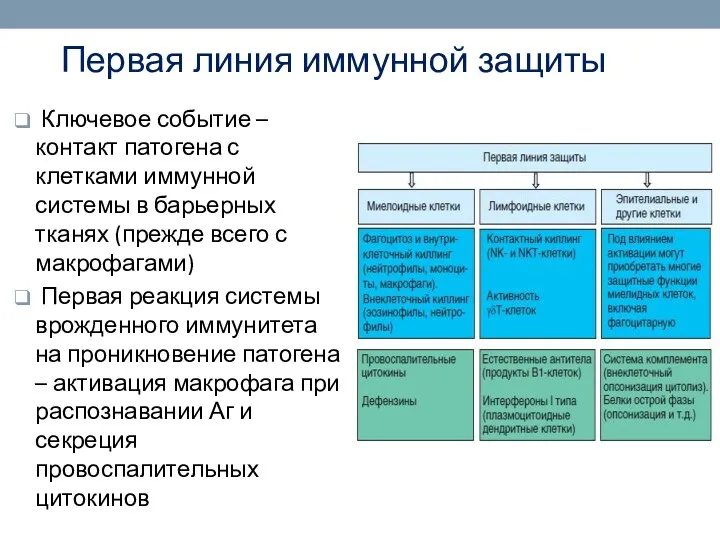
- 25. Первая линия иммунной защиты Ключевое событие – контакт патогена с клетками иммунной системы в барьерных тканях
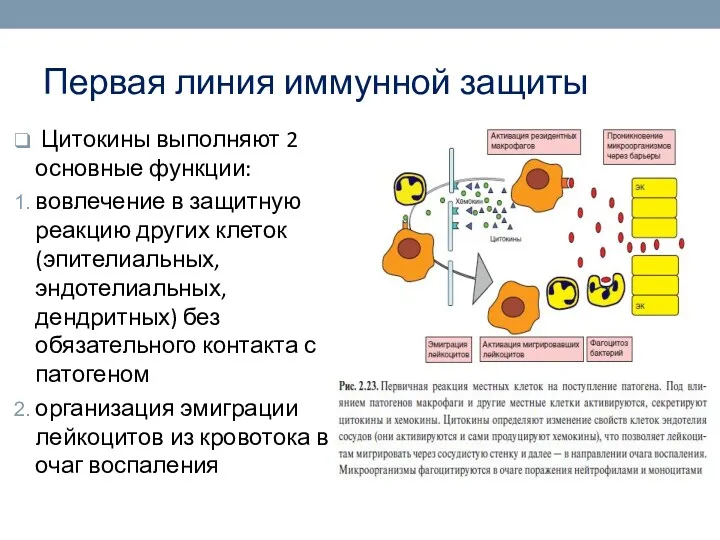
- 26. Первая линия иммунной защиты Цитокины выполняют 2 основные функции: вовлечение в защитную реакцию других клеток (эпителиальных,
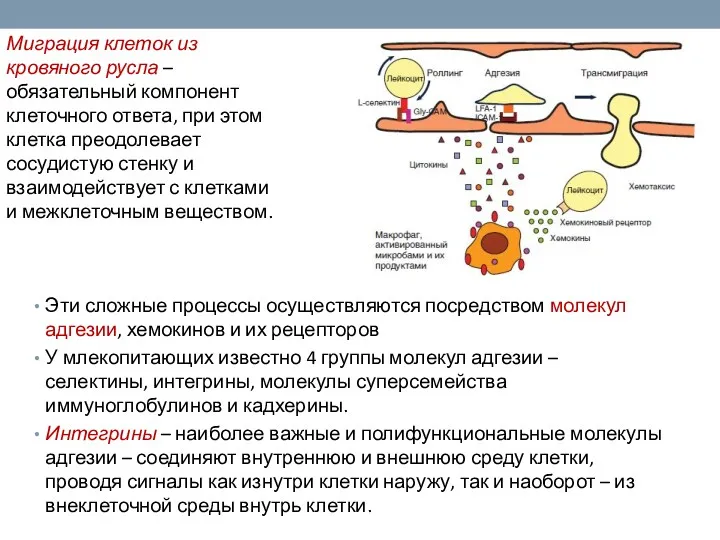
- 27. Эти сложные процессы осуществляются посредством молекул адгезии, хемокинов и их рецепторов У млекопитающих известно 4 группы
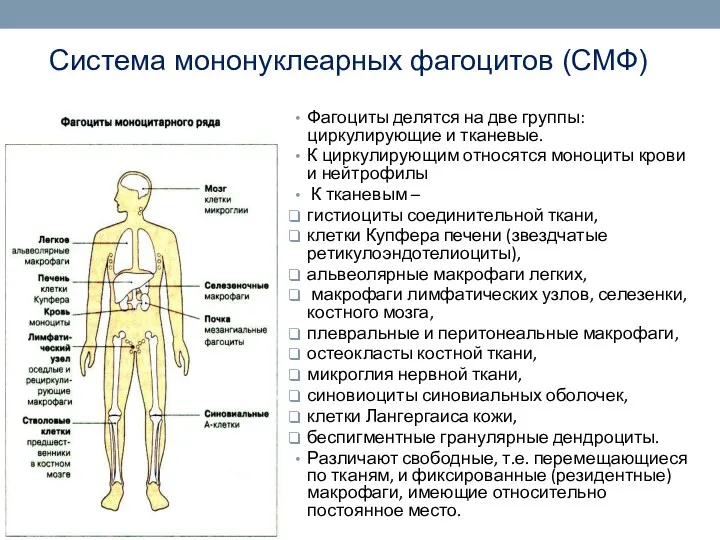
- 29. Система мононуклеарных фагоцитов (СМФ) Фагоциты делятся на две группы: циркулирующие и тканевые. К циркулирующим относятся моноциты
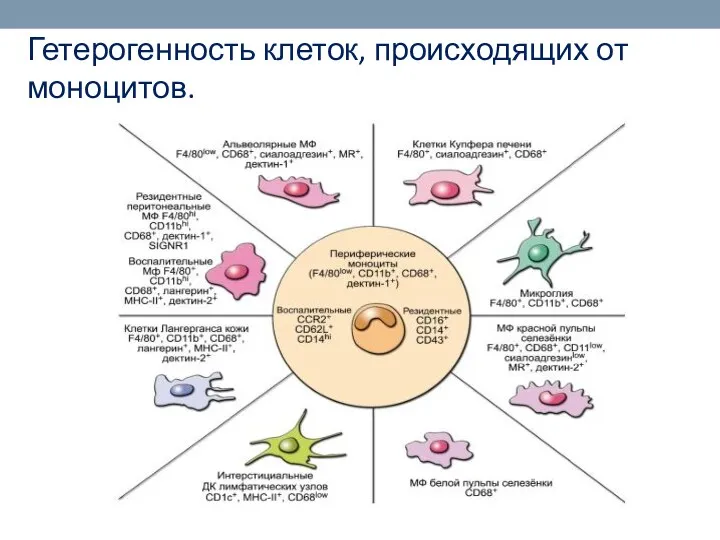
- 31. Гетерогенность клеток, происходящих от моноцитов.
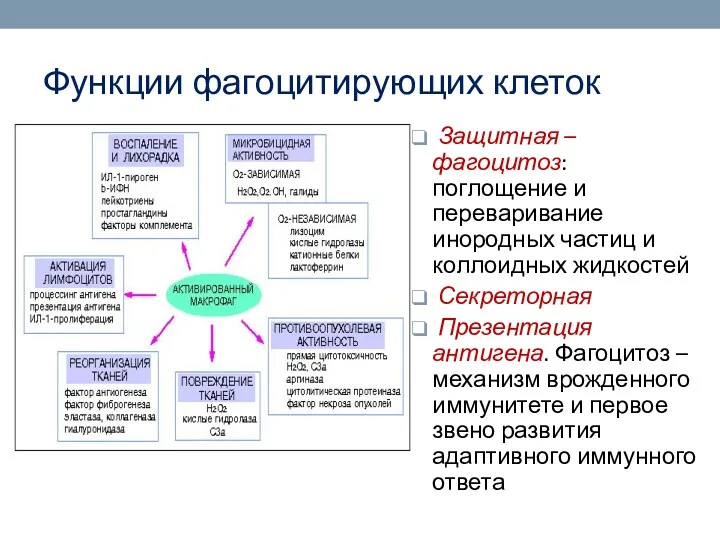
- 32. Функции фагоцитирующих клеток Защитная – фагоцитоз: поглощение и переваривание инородных частиц и коллоидных жидкостей Секреторная Презентация
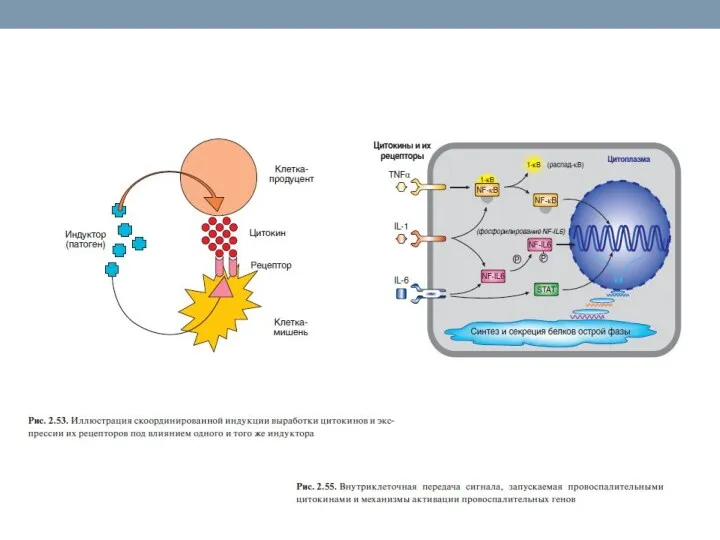
- 33. Активация клеток врожденного иммунитета Распознавание PAMP подготавливает клетки к выполнению основной функции – удалению чужеродных агентов;
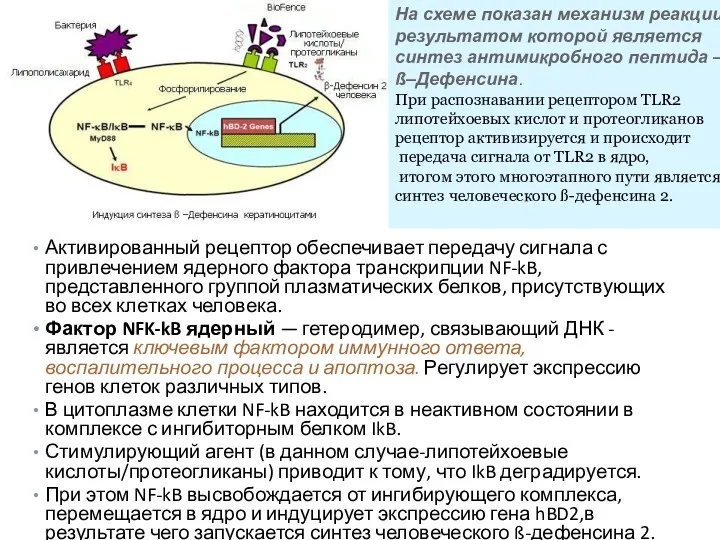
- 34. Активированный рецептор обеспечивает передачу сигнала с привлечением ядерного фактора транскрипции NF-kB, представленного группой плазматических белков, присутствующих
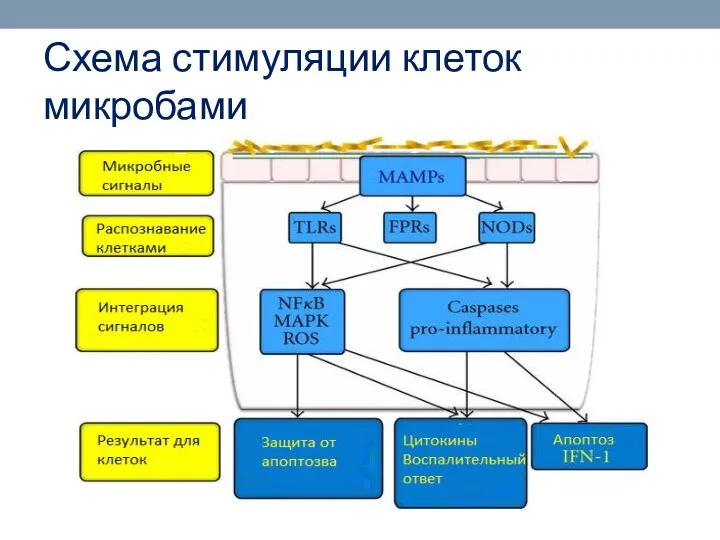
- 35. Схема стимуляции клеток микробами
- 36. Существует вероятность того, что клетки организма хозяина складывают вместе две части поступившей информации, чтобы запустить иммунный
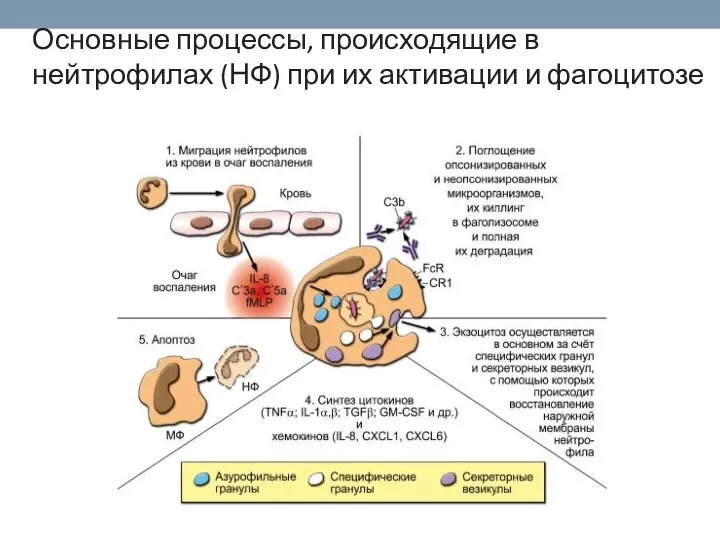
- 37. Основные процессы, происходящие в нейтрофилах (НФ) при их активации и фагоцитозе
- 38. Стадии фагоцитоза 1. Хемотаксис (хемо - химический; таксис - двигательная реакция) - направленное движение клеток вдоль
- 39. Стадии фагоцитоза 3. Эндоцитоз (поглощение) состоит из этапов: Активация мембраны. На этой стадии осуществляется подготовка объекта
- 40. Механизмы уничтожения чужеродных агентов Внутриклеточный кислородзависимый Главное событие – кислородный взрыв, сопровождающийся образованием активных форм кислорода.
- 41. Механизмы уничтожения чужеродных агентов Внутриклеточный кислород-независимый Различают 4 основных типа: При первом типе используются электрически заряженные
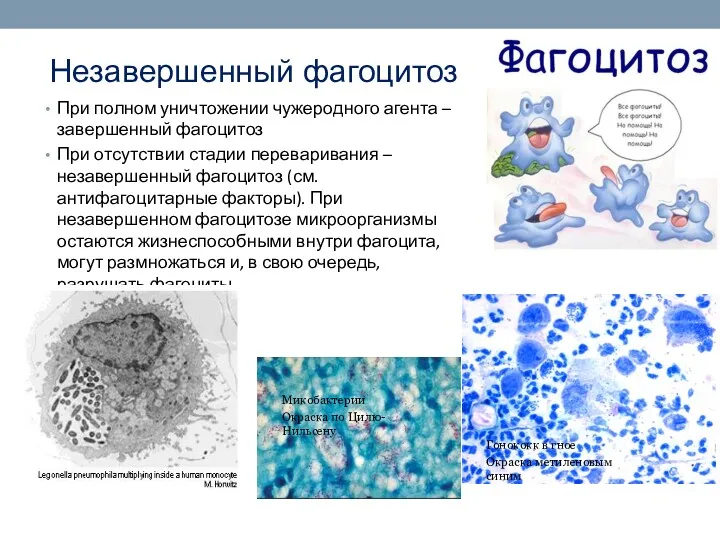
- 42. Незавершенный фагоцитоз При полном уничтожении чужеродного агента – завершенный фагоцитоз При отсутствии стадии переваривания – незавершенный
- 43. Контактная киллерная активность миелоидных клеток Миелоидные клетки осуществляют внутриклеточный киллинг-фагоцитоз, внеклеточный – обеспечивают продукты окислительного взрыва,
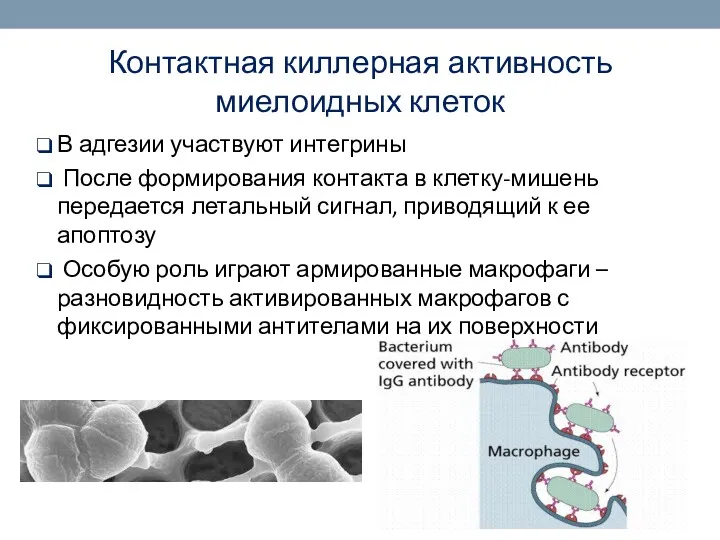
- 44. Контактная киллерная активность миелоидных клеток В адгезии участвуют интегрины После формирования контакта в клетку-мишень передается летальный
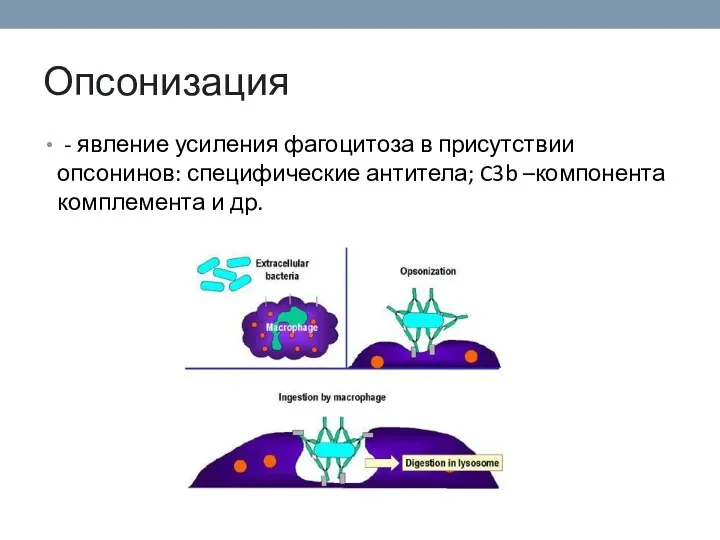
- 45. Опсонизация - явление усиления фагоцитоза в присутствии опсонинов: специфические антитела; C3b –компонента комплемента и др.
- 46. Оценка фагоцитарной активности 1. Фагоцитарный индекс (ФИ) — процент клеток, вступивших в фагоцитоз, от общего их
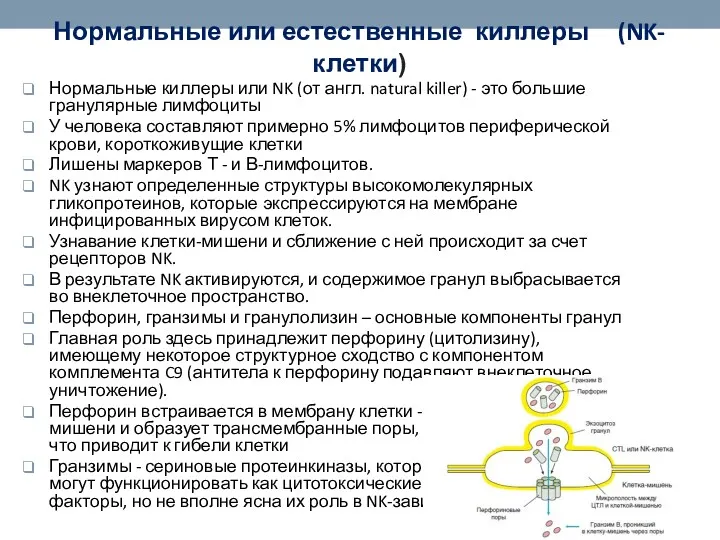
- 47. Нормальные или естественные киллеры (NK-клетки) Нормальные киллеры или NK (от англ. natural killer) - это большие
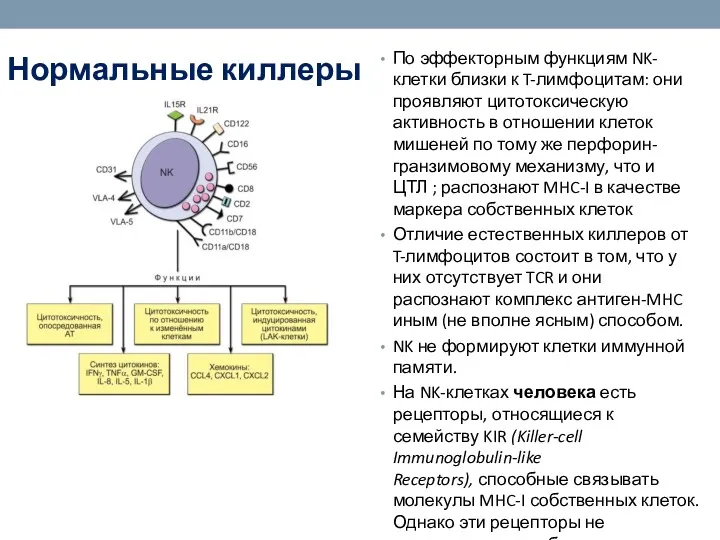
- 48. Нормальные киллеры (NK-клетки) По эффекторным функциям NK-клетки близки к T-лимфоцитам: они проявляют цитотоксическую активность в отношении
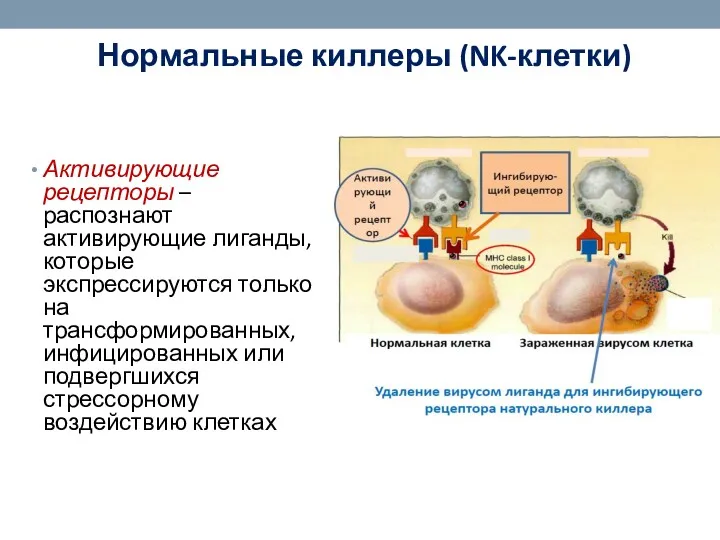
- 49. Нормальные киллеры (NK-клетки) Активирующие рецепторы – распознают активирующие лиганды, которые экспрессируются только на трансформированных, инфицированных или
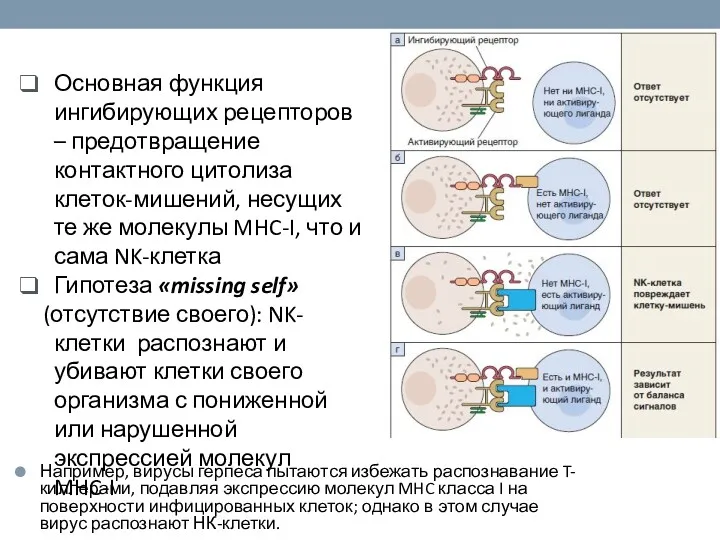
- 50. Основная функция ингибирующих рецепторов – предотвращение контактного цитолиза клеток-мишений, несущих те же молекулы MHC-I, что и
- 51. Физиологические факторы Кислый рН желудочного сока Кашлевой рефлекс Чихание Работа ресничного эпителия Повышение температуры тела (оптимальная
- 52. Гуморальные факторы сыворотки и других биологических жидкостей:
- 53. Гуморальные факторы Лизоцим – это фермент мурамидаза, расщепляющий бета-1,4-гликозидные связи между аминосахарами пептидогликана (муреина), – в
- 54. Система комплемента Комплемент – сложный белковый комплекс сыворотки крови. Система комплемента состоит из более чем 30
- 55. Система комплемента В сыворотке находится в неактивном состоянии (полностью инактивируется при 56°C) Активируется система комплемента за
- 56. Система комплемента Центральное место в системе комплемента занимает белок С3. В плазме крови постоянно происходит «холостая»
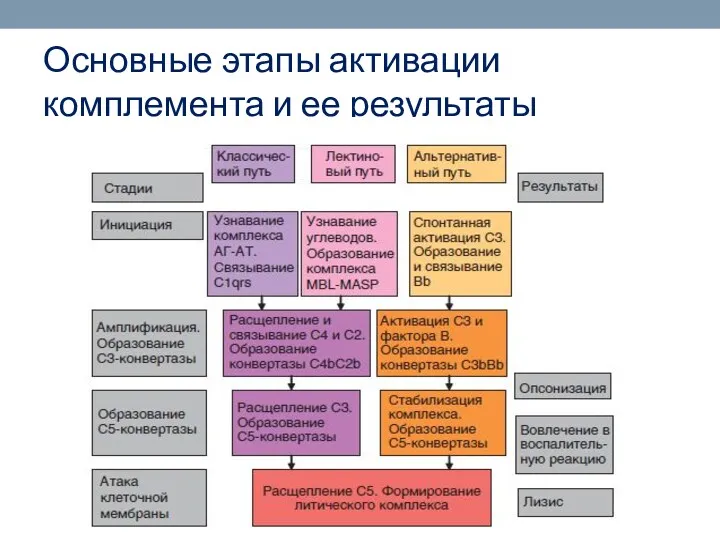
- 57. Основные этапы активации комплемента и ее результаты
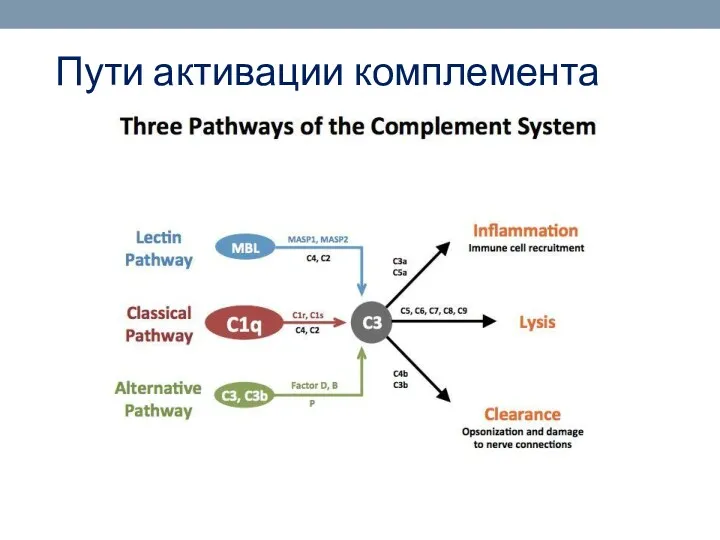
- 58. Пути активации комплемента
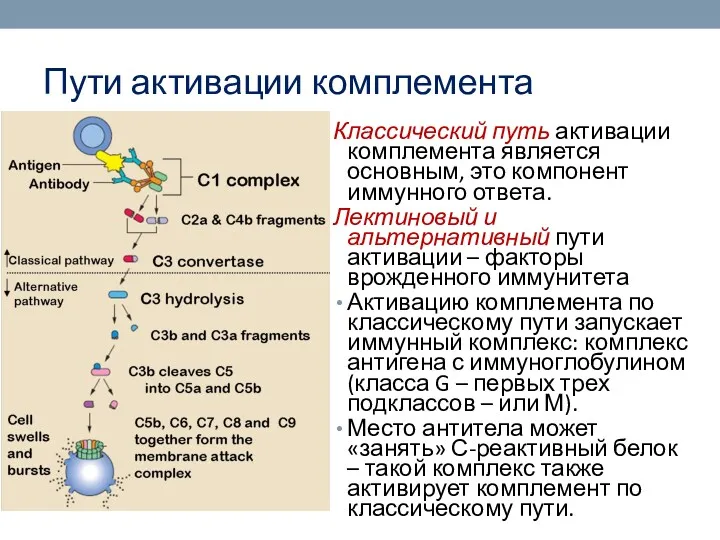
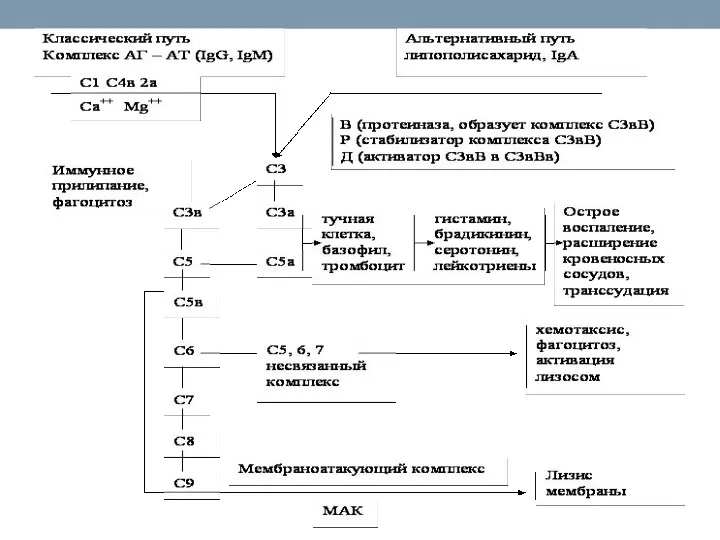
- 59. Пути активации комплемента Классический путь активации комплемента является основным, это компонент иммунного ответа. Лектиновый и альтернативный
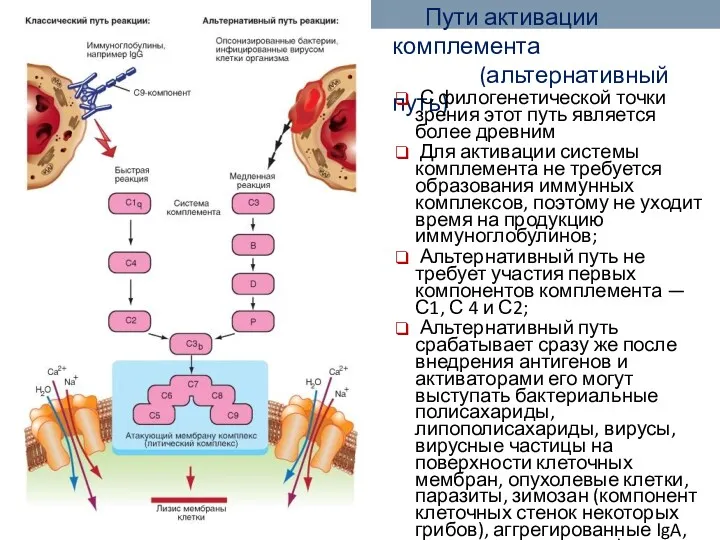
- 60. Пути активации комплемента (альтернативный путь) Альтернативный путь активации комплемента запускается гидролизом C3 прямо на поверхности патогена.
- 61. Пути активации комплемента (альтернативный путь) С филогенетической точки зрения этот путь является более древним Для активации
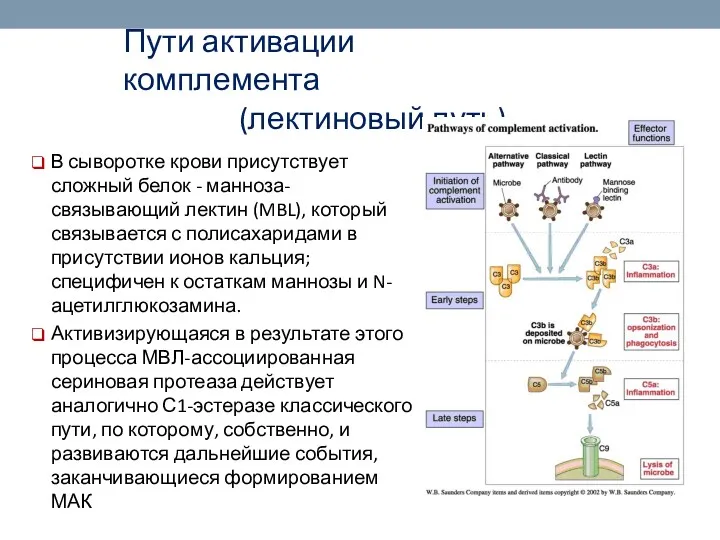
- 63. Пути активации комплемента (лектиновый путь) В сыворотке крови присутствует сложный белок - манноза-связывающий лектин (MBL), который
- 64. Мембраноатакующий комплекс (МАС) Биологические эффекты активации системы комплемента: Цитотоксическая, или литическая функция. В конечной стадии активации
- 65. Биологические эффекты активации системы комплемента Опсонизирующая функция. Сразу вслед за активацией системы комплемента образуются опсонизирующие компоненты,
- 66. Биологические эффекты активации системы комплемента Солюбилизация (то есть растворение) иммунных комплексов (молекулой C3b). При недостаточности комплемента
- 67. Биологические эффекты активации системы комплемента Активные фракции комплемента С3а и С5а называются анафилотоксинами, так как участвуют,
- 68. Гуморальные факторы Дефензины – семейство низкомолекулярных белков – пептидов. У человека идентифицировано α- и ß- подсемейство
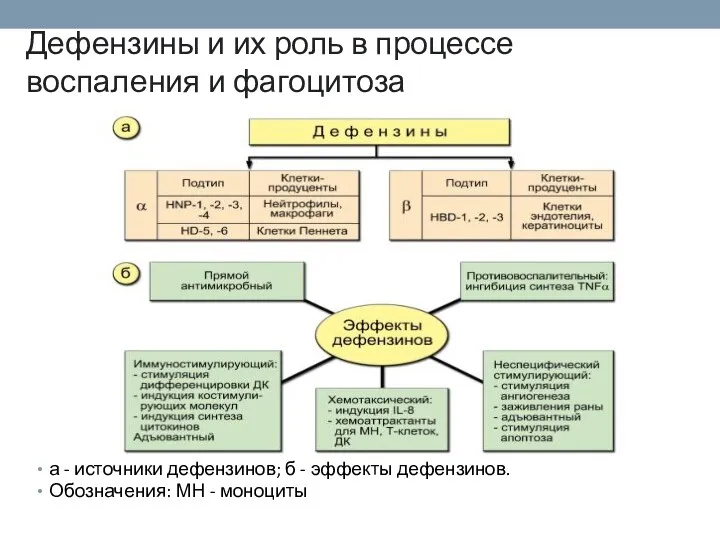
- 69. Дефензины и их роль в процессе воспаления и фагоцитоза а - источники дефензинов; б - эффекты
- 70. Гуморальные факторы Цитокины – это небольшие белки, действующие аутокринно(т.е. на клетку, которая их продуцирует) или паракринно
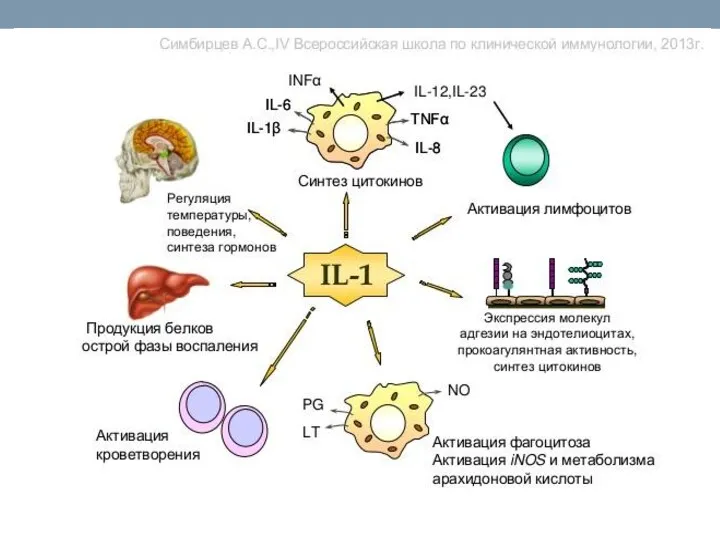
- 71. Цитокины(продолжение) ИЛ-1 и ФНО альфа и ФНО альфа . Эти цитокины способствуют активации фагоцитов, их миграции
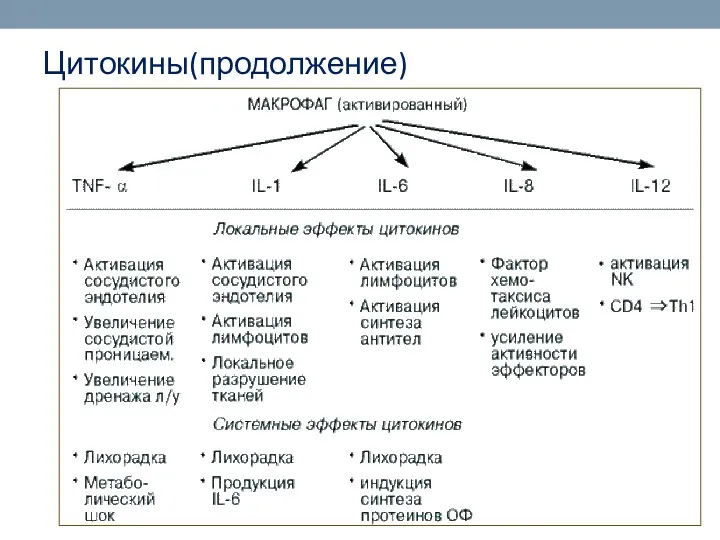
- 72. Цитокины(продолжение)
- 74. Цитокины: интерфероны Интерфероны – полипептиды, вырабатывающиеся и аккумулирующиеся во всех ядросодержащих клетках крови и эпителиальных клетках
- 75. Интерферон: семейство молекул В организме человека существует около 20 видов интерферонов. Для удобства изучения интерфероны разделили
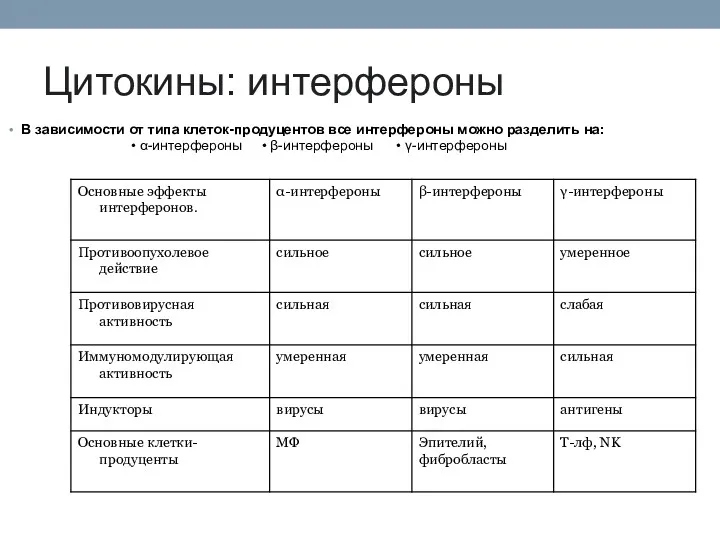
- 76. Цитокины: интерфероны В зависимости от типа клеток-продуцентов все интерфероны можно разделить на: • α-интерфероны • β-интерфероны
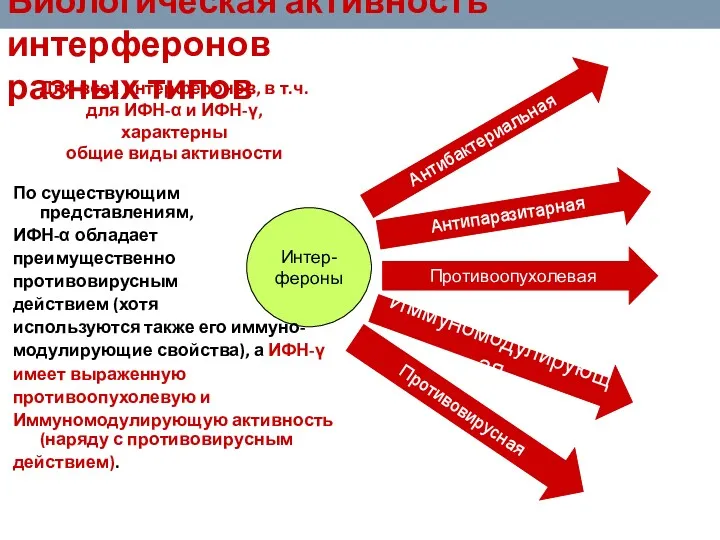
- 77. Биологическая активность интерферонов разных типов Интер- фероны Противовирусная Антибактериальная Иммуномодулирующая Для всех интерферонов, в т.ч. для
- 78. Механизмы, обеспечивающие клинически важные функции интерферона Иммуномодулирующая функция 1. Активация макрофагов и NК клеток 2. Активация
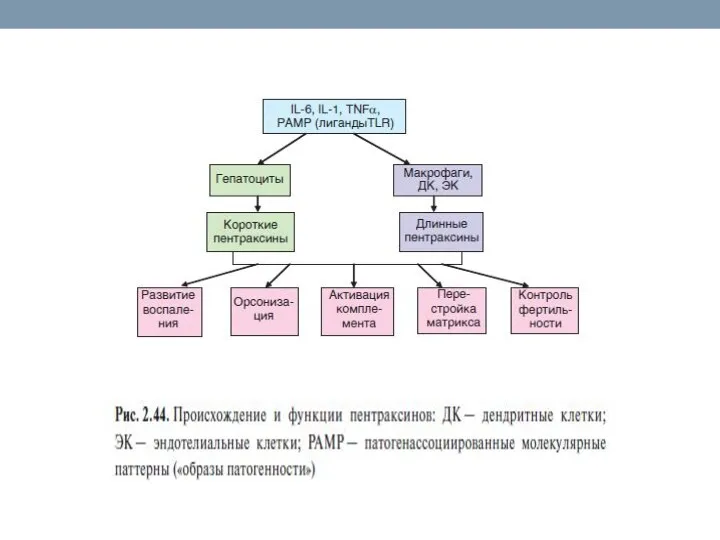
- 79. Белки острой фазы В ответ на инфекцию или повреждение тканей резко увеличивается концентрация некоторых белков плазмы
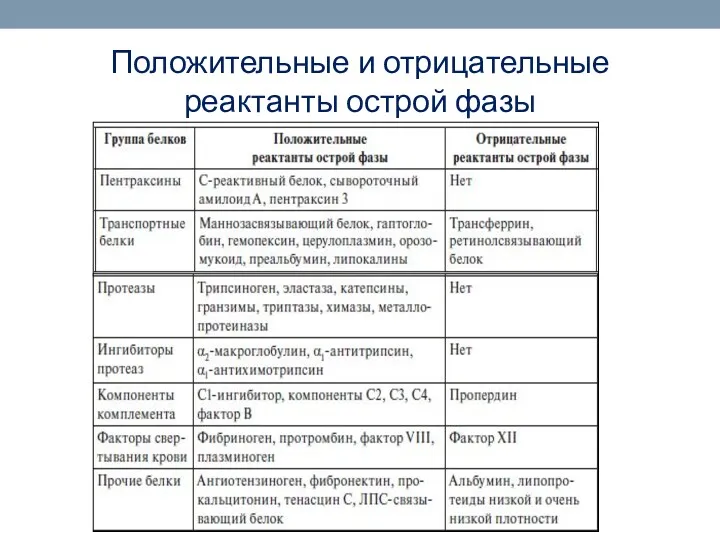
- 80. Положительные и отрицательные реактанты острой фазы
- 82. Белки острой фазы С-реактивный белок (СРБ). Является важным фактором регуляции воспалительных процессов и антимикробной защиты организма.
- 83. Белки острой фазы Сывороточный амилоидный А компонент (СААК). Макромолекулы, характеризующиеся высокой гетерогенностью. Полагают, что СААК участвуют
- 84. Основные семейства интерлейкинов
- 86. Нормальные антитела Антитела, появление которых не связано с иммунизацией или инфекцией называют нормальными. То есть, сыворотка
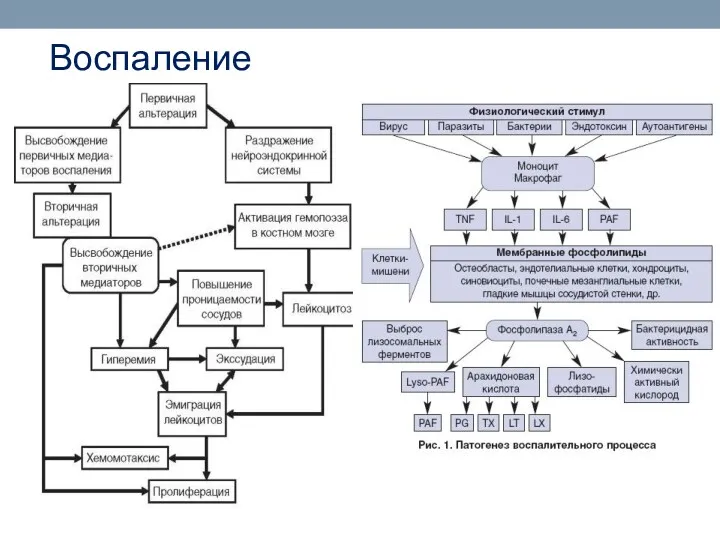
- 88. Воспаление Воспаление (inflammatio, от лат. in-flammare - воспламенять) -сформировавшаяся в процессе эволюции реакция организма на местное
- 89. Воспаление
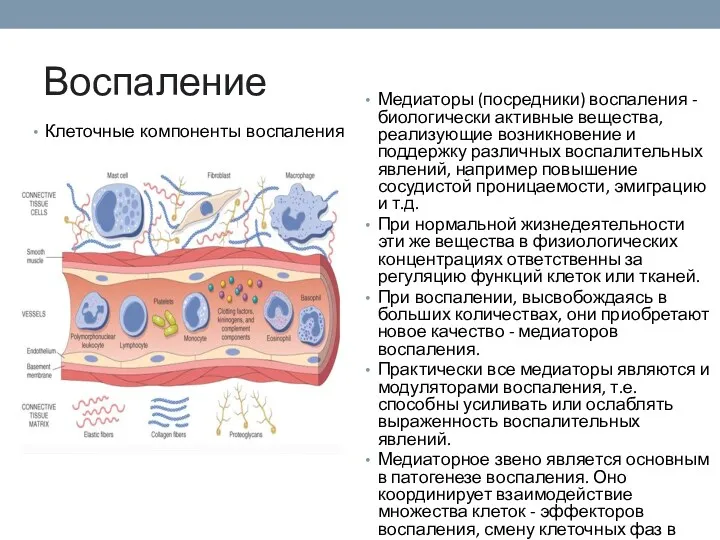
- 90. Воспаление Клеточные компоненты воспаления Медиаторы (посредники) воспаления - биологически активные вещества, реализующие возникновение и поддержку различных
- 92. Скачать презентацию














































 Інсульт. Причини, симптоми інсульту, перша допомога, поради
Інсульт. Причини, симптоми інсульту, перша допомога, поради Миокардит, кардиомиопатии, перикардит, артериальная гипертензия
Миокардит, кардиомиопатии, перикардит, артериальная гипертензия Антропометриялық көрсеткіштерді анықтау
Антропометриялық көрсеткіштерді анықтау Ротовирусная инфекция
Ротовирусная инфекция ЛРС мочегонного действия
ЛРС мочегонного действия Измерение артериального давления. История развития метода
Измерение артериального давления. История развития метода Внебольничная пневмония
Внебольничная пневмония Етеккір циклінің бұзылуы
Етеккір циклінің бұзылуы Антисептика и дезинфекция
Антисептика и дезинфекция Осложнения анестезии в плановой хирургии. Остановка сердца, гипотонии, бронхоспазм. Синдром Мендельсона
Осложнения анестезии в плановой хирургии. Остановка сердца, гипотонии, бронхоспазм. Синдром Мендельсона Организация службы профессиональной патологии Республики Беларусь. Расследование и учет профессиональных заболеваний
Организация службы профессиональной патологии Республики Беларусь. Расследование и учет профессиональных заболеваний Медицинские отходы
Медицинские отходы Хроническая обструктивная болезнь легких
Хроническая обструктивная болезнь легких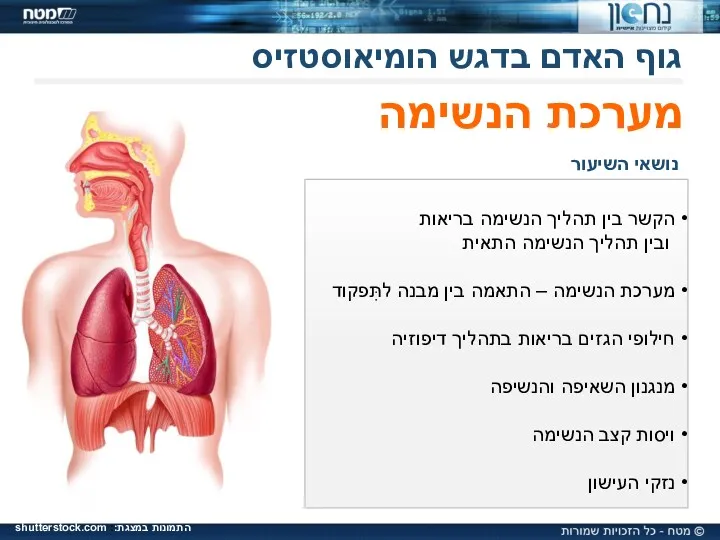 גוף האדם בדגש הומיאוסטזיס
גוף האדם בדגש הומיאוסטזיס Жедел аллергиялық синдромдар кезіндегі алғашқы көмек: есекжем,квинке ісігі,анафилактикалық шок
Жедел аллергиялық синдромдар кезіндегі алғашқы көмек: есекжем,квинке ісігі,анафилактикалық шок ТОО Kaz-BioNano. Медицинская деятельность. Подвиды лицензируемого вида деятельности
ТОО Kaz-BioNano. Медицинская деятельность. Подвиды лицензируемого вида деятельности Морфологічні та функціональні особливості процесу сечовиділення у дітей
Морфологічні та функціональні особливості процесу сечовиділення у дітей Микробиологическая диагностика ВИЧ-инфекции и СПИД -ассоциированных заболеваний
Микробиологическая диагностика ВИЧ-инфекции и СПИД -ассоциированных заболеваний Лабораторная диагностика сифилиса и инфекций передаваемых половым путем
Лабораторная диагностика сифилиса и инфекций передаваемых половым путем Вірусні інфекції в перинатальному періоді
Вірусні інфекції в перинатальному періоді Синтетична теорія еволюції. Особливості дії еволюційних факторів у популяціях людей. (Лекція 15)
Синтетична теорія еволюції. Особливості дії еволюційних факторів у популяціях людей. (Лекція 15) Какие заболевания называются инвазионными?
Какие заболевания называются инвазионными? Дизартрия. Анартрия
Дизартрия. Анартрия Рак слизистой оболочки полости рта
Рак слизистой оболочки полости рта Обучение различным способам дыхания для благополучного течения родов, приемам обезболивания родов
Обучение различным способам дыхания для благополучного течения родов, приемам обезболивания родов Стерилизация. Стерилизация алдындағы тазарту
Стерилизация. Стерилизация алдындағы тазарту Утренний туалет новорожденного
Утренний туалет новорожденного Основы логопедии
Основы логопедии