Содержание
- 2. ТЕОРИЯ ГОРЕНИЯ и ВЗРЫВА Дисциплина
- 3. Литература 1. Теория горения и взрыва: практикум: учебное пособие / В.А. Девисилов, Т.И. Дроздова, С.С. Тимофеева
- 7. Вопросы лекции Горение . Условия для возникновения горения. Горючее вещество. Группы горючих веществ или материалов Полное
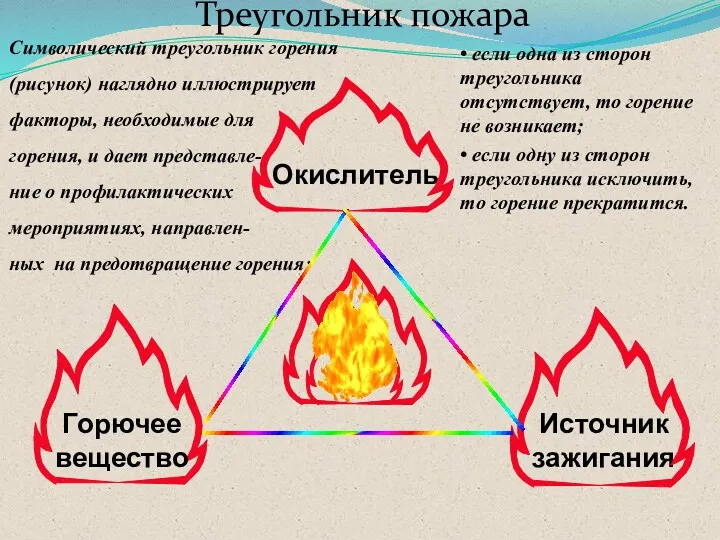
- 11. Треугольник пожара Окислитель Источник зажигания Горючее вещество Символический треугольник горения (рисунок) наглядно иллюстрирует факторы, необходимые для
- 14. Органические горючие вещества – это все вещества на основе углерода, представляющие собой материалы растительного и животного
- 15. К горючим металлам и их производным относятся все щелочные и щелочно-земельные металлы, а также металлы других
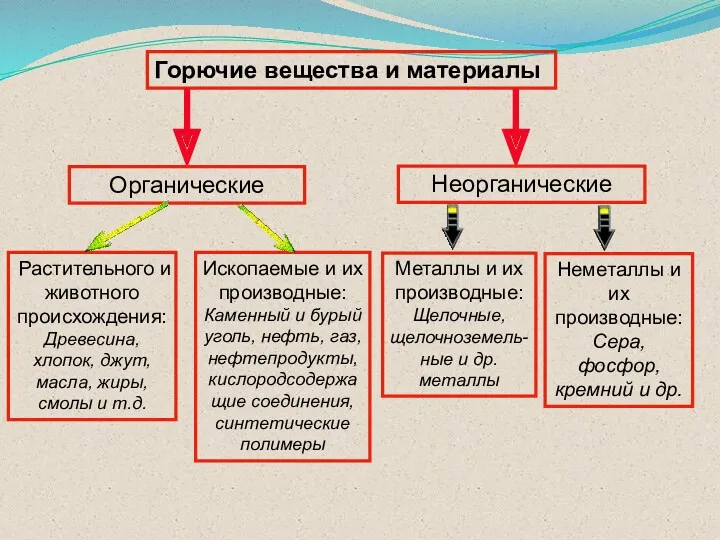
- 16. Горючие вещества и материалы Органические Неорганические Ископаемые и их производные: Каменный и бурый уголь, нефть, газ,
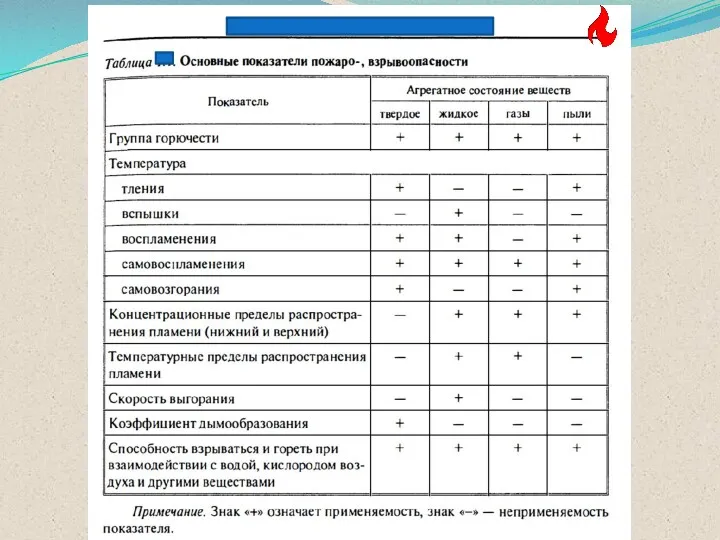
- 17. Все индивидуальные вещества могут быть охарактеризованы коэффициентом горючести. Коэффициент горючести К является безразмерным коэффициентом и служит
- 18. K = 4 × n(C) + 4 × n(S ) + n(H ) + n(N )
- 19. Расчет коэффициента горючести Пример 1. Рассчитать коэффициент горючести анилина С6Н5NH2 и хлорной кислоты HClO4. Решение: В
- 20. Пример 2. Определить горючесть этиламина (C2H5NH2). Решение. Рассчитываем коэффициент горючести этиламина: n(C) = 2; n(H =
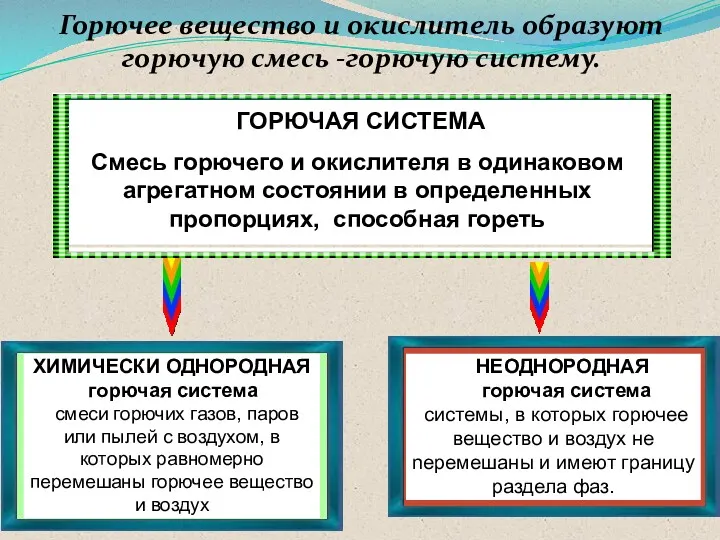
- 22. ГОРЮЧАЯ СИСТЕМА Смесь горючего и окислителя в одинаковом агрегатном состоянии в определенных пропорциях, способная гореть ХИМИЧЕСКИ
- 24. Горючие вещества могут быть в трех агрегатных состояниях: жидком, твердом, газообразном. Отдельные твердые вещества при нагревании
- 25. К внешним проявлениям горения относится пламя, которое характеризуется свечением и выделением теплоты. При горении конденсированных систем
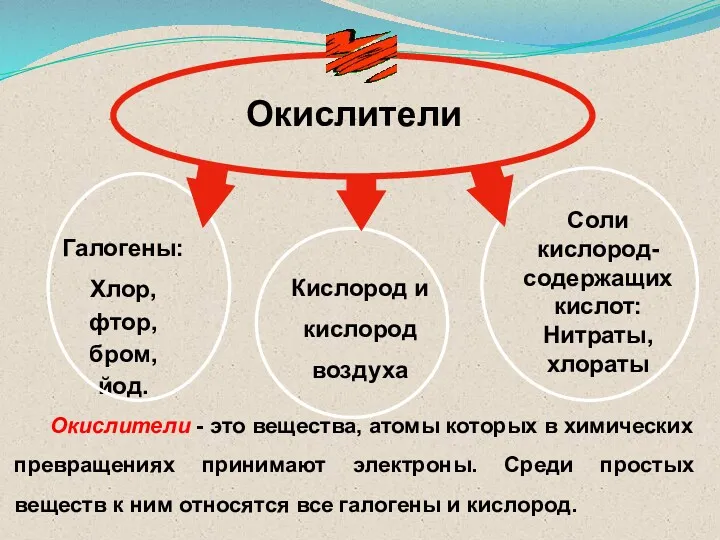
- 29. Окислители Соли кислород-содержащих кислот: Нитраты, хлораты Галогены: Хлор, фтор, бром, йод. Кислород и кислород воздуха Окислители
- 35. P2O5 Оксид фосфора Na2O K2O
- 36. Л
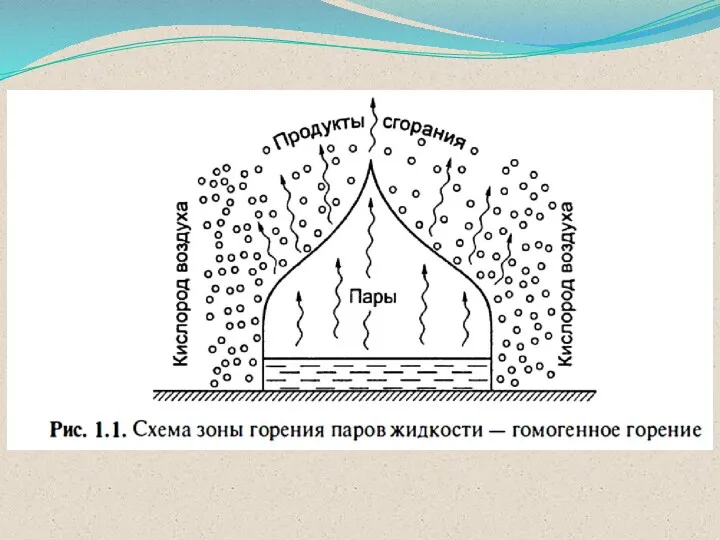
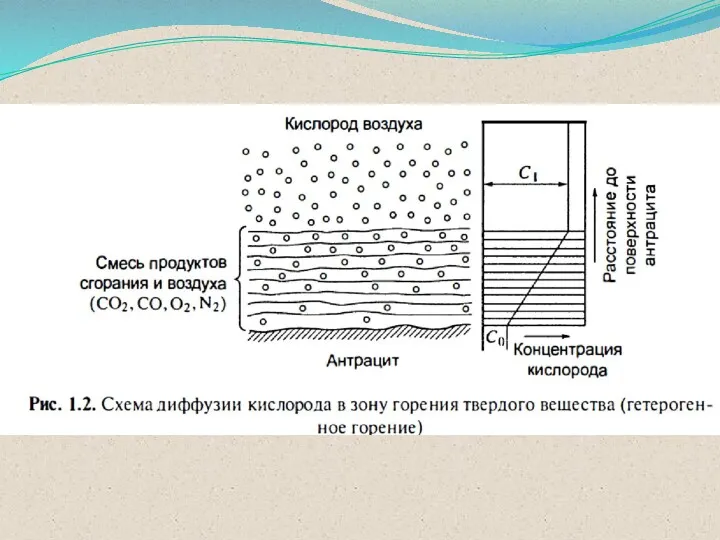
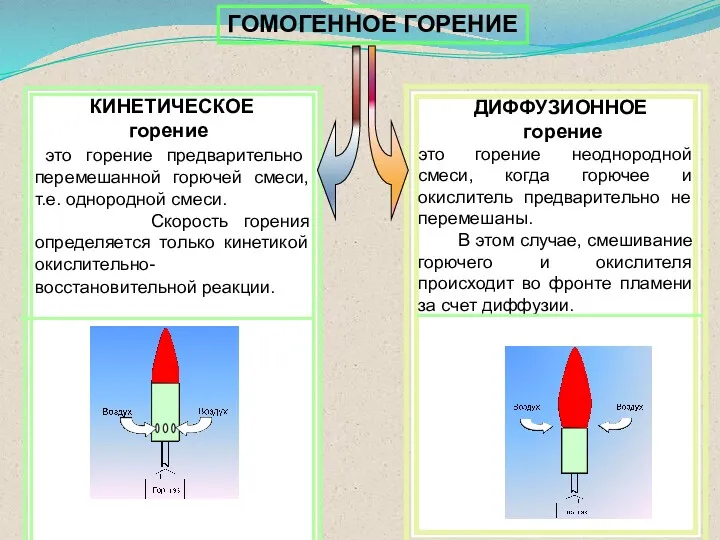
- 43. Виды и режимы горения ГОМОГЕННОЕ горение оба компонента находятся в одной фазе (однородные горючие смеси) ГЕТЕРОГЕННОЕ
- 44. ДИФФУЗИОННОЕ горение это горение неоднородной смеси, когда горючее и окислитель предварительно не перемешаны. В этом случае,
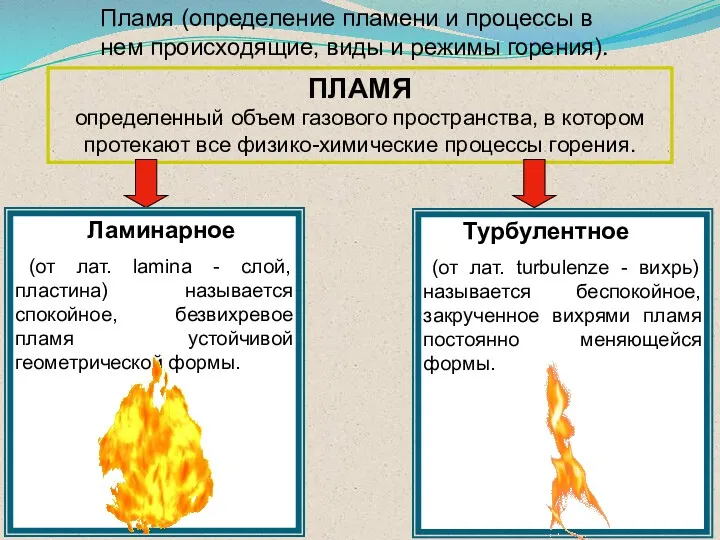
- 45. ПЛАМЯ определенный объем газового пространства, в котором протекают все физико-химические процессы горения. Ламинарное (от лат. lamina
- 46. Структура пламени ФРОНТ ПЛАМЕНИ (δпл.) – тонкий поверхностный слой, ограничивающий пламя, непосредственно в котором протекают окислительно-восстановительные
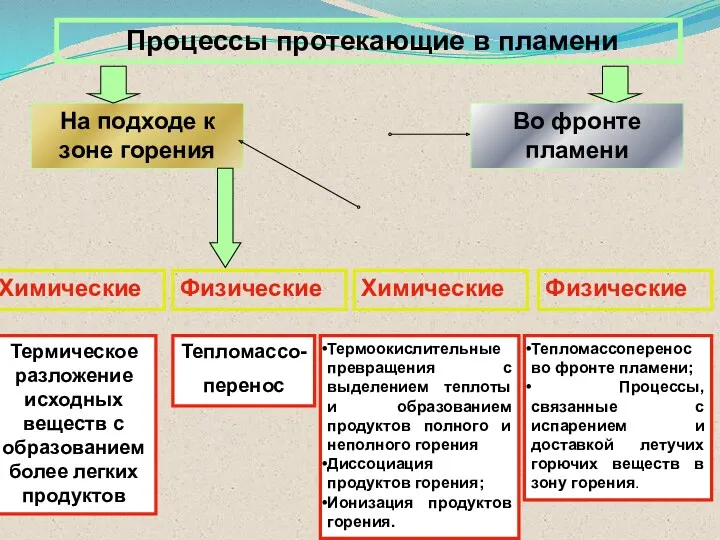
- 47. Процессы протекающие в пламени На подходе к зоне горения Во фронте пламени Химические Физические Физические Химические
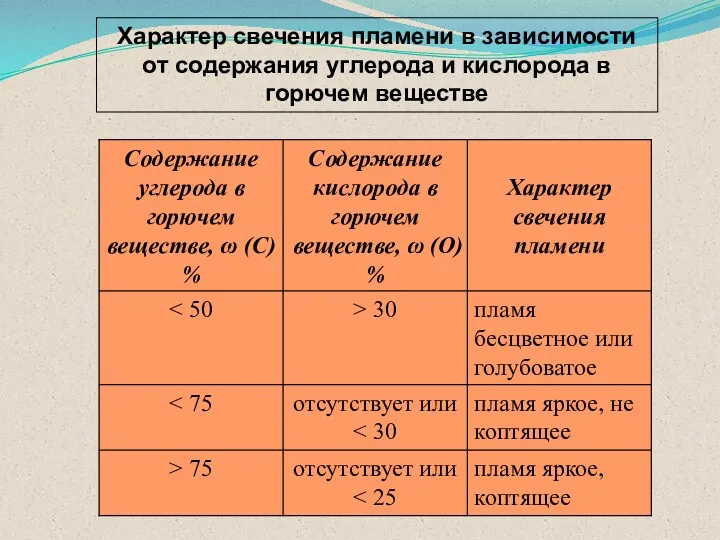
- 48. Характер свечения пламени в зависимости от содержания углерода и кислорода в горючем веществе
- 49. Рассчитать коэффициент горючести следующих веществ
- 51. Скачать презентацию





































 Специальная пожарно-спасательная часть. Описание района выезда по административному округу. Город Гаджиево. ЗАТО Александровск
Специальная пожарно-спасательная часть. Описание района выезда по административному округу. Город Гаджиево. ЗАТО Александровск Гидродинамическая авария
Гидродинамическая авария Безопасность и правила дорожного движения
Безопасность и правила дорожного движения Серия терактов. Башни Близнецы
Серия терактов. Башни Близнецы Оружие массового поражения
Оружие массового поражения Презентация Здоровый образ жизни
Презентация Здоровый образ жизни В здоровом теле – здоровый дух. Открытый урок
В здоровом теле – здоровый дух. Открытый урок Пожарная безопасность. (Тема 5)
Пожарная безопасность. (Тема 5) Өндірістік факторлар түрлері
Өндірістік факторлар түрлері Правила поведения на летних каникулах
Правила поведения на летних каникулах Здоровьесберегающие технологии в работе с детьми в ДОУ
Здоровьесберегающие технологии в работе с детьми в ДОУ Чрезвычайные ситуации техногенного характера, связанные с выбросом радиоактивных веществ (РВ)
Чрезвычайные ситуации техногенного характера, связанные с выбросом радиоактивных веществ (РВ) Здоров’я людини
Здоров’я людини Снюс, табак бездымный, не безвредный
Снюс, табак бездымный, не безвредный Правила и безопасность дорожного движения
Правила и безопасность дорожного движения Пожарная безопасность
Пожарная безопасность 02.2022 окр. мир
02.2022 окр. мир Вводный инструктаж по охране труда и пожарной безопасности
Вводный инструктаж по охране труда и пожарной безопасности Установки водяного и пенного пожаротушения. Пожарная автоматика
Установки водяного и пенного пожаротушения. Пожарная автоматика Чрезвычайные ситуации техногенного характера, их причины и последствия
Чрезвычайные ситуации техногенного характера, их причины и последствия Безопасное поведение на водоемах
Безопасное поведение на водоемах Безопасность использования технических средств информационных технологий
Безопасность использования технических средств информационных технологий Электромагнитные волны. Влияние электромагнитного излучения на организм человека
Электромагнитные волны. Влияние электромагнитного излучения на организм человека Характеристика дорожно-транспортного движения, его участники. (Лекция 1)
Характеристика дорожно-транспортного движения, его участники. (Лекция 1) Медиа-викторина Наш друг Светофор
Медиа-викторина Наш друг Светофор Презентация к уроку в 5 классе Опасности на воде и водном транспорте.
Презентация к уроку в 5 классе Опасности на воде и водном транспорте. Мониторинг знаний правил дорожного движения
Мониторинг знаний правил дорожного движения Мы выбираем жизнь. Профилактика суицида
Мы выбираем жизнь. Профилактика суицида