Содержание
- 2. АЛКАНЫ Получение, нахождение в природе и применение алканов ВПЕРЕД НАЗАД
- 3. ВПЕРЕД Газообразные алканы получают из природного и попутного нефтяных газов; Жидкие и твердые – из нефти.
- 4. ВПЕРЕД Рудничный газ состоит из МЕТАНА Природный газ на 95% состоит из метана МЕТАН называют ещё
- 5. ВПЕРЕД 3. Изомеризация алканов: 4. Гидрирование непредельных углеводородов: ВПЕРЕД НАЗАД
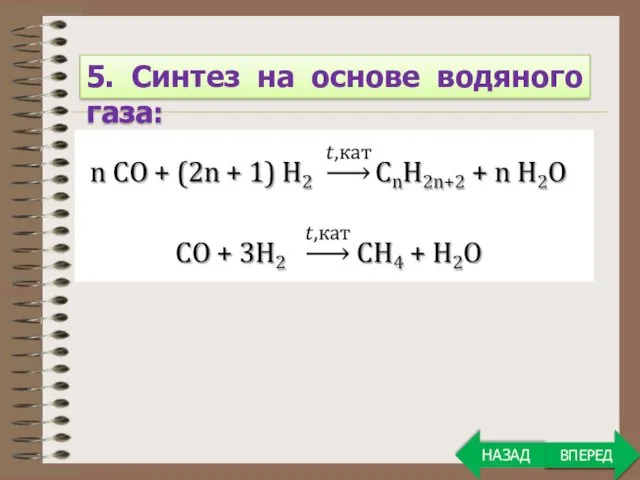
- 6. ВПЕРЕД 5. Синтез на основе водяного газа: ВПЕРЕД НАЗАД
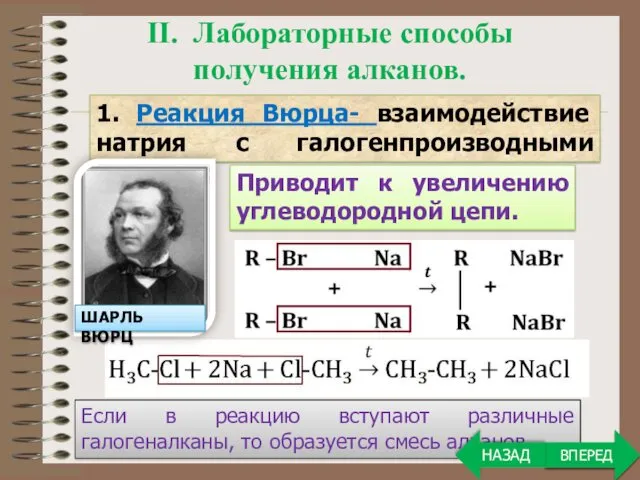
- 7. Если в реакцию вступают различные галогеналканы, то образуется смесь алканов. ВПЕРЕД II. Лабораторные способы получения алканов.
- 8. ВПЕРЕД 2. Реакция Дюма - сплавление солей карбоновых кислот со щелочью.
- 9. 3. Синтез Кольбе - электролиз солей карбоновых кислот. 4. Гидролиз карбидов металлов. Al4C3 + 12H2O →
- 10. Применение АЛКАНОВ ВПЕРЕД НАЗАД
- 11. Применение алканов Газообразные АЛКАНЫ (метан и пpопан-бутановая смесь) используются в качестве ценного ТОПЛИВА. Жидкие УГЛЕВОДОPОДЫ составляют
- 12. тетрахлорметан – растворитель, для гашения пламени; фтор-, хлор- углеводороды (фреоны) – хладагенты, производство аэрозолей, производство тефлона.
- 13. ВПЕРЕД Метан– получение сажи для типографской краски, резины, синтез водорода, производство ацетилена, формальдегида. Применение алканов ВПЕРЕД
- 14. ВПЕРЕД Нахождение в природе АЛКАНОВ ВПЕРЕД НАЗАД
- 15. ВПЕРЕД Нахождение в природе Основные источники алканов – нефть и природный газ. Метан составляет основную массу
- 16. ВПЕРЕД ВПЕРЕД НАЗАД
- 17. В природе широко распространены также газовые гидраты алканов, в основном метана, они залегают в осадочных породах
- 18. Твердые алканы встречаются в природе в виде залежей горного воска – озокерита, в восковых покрытиях листьев,
- 19. АЛКЕНЫ Получение и применение алканов ВПЕРЕД НАЗАД
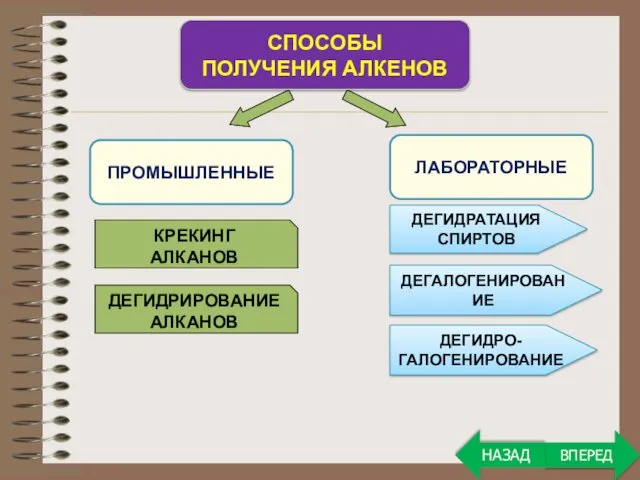
- 20. ПРОМЫШЛЕННЫЕ СПОСОБЫ ПОЛУЧЕНИЯ АЛКЕНОВ ЛАБОРАТОРНЫЕ КРЕКИНГ АЛКАНОВ ДЕГИДРИРОВАНИЕ АЛКАНОВ ДЕГИДРАТАЦИЯ СПИРТОВ ДЕГАЛОГЕНИРОВАНИЕ ДЕГИДРО- ГАЛОГЕНИРОВАНИЕ ВПЕРЕД НАЗАД
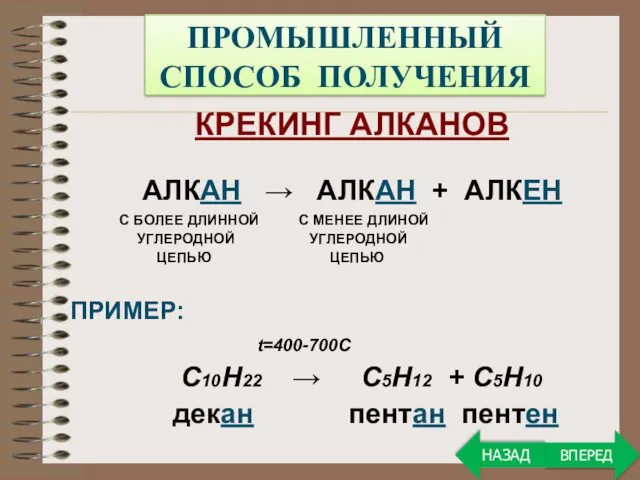
- 21. ПРОМЫШЛЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ КРЕКИНГ АЛКАНОВ АЛКАН → АЛКАН + АЛКЕН С БОЛЕЕ ДЛИННОЙ С МЕНЕЕ ДЛИНОЙ
- 22. ПРОМЫШЛЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ ДЕГИДРИРОВАНИЕ АЛКАНОВ АЛКАН → АЛКЕН + ВОДОРОД ПРИМЕР: Ni, t=500C Н3С - СН3
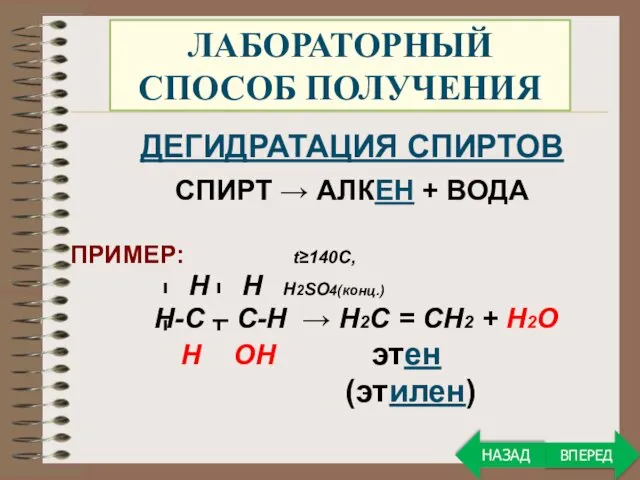
- 23. ЛАБОРАТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯ ДЕГИДРАТАЦИЯ СПИРТОВ СПИРТ → АЛКЕН + ВОДА ПРИМЕР: t≥140C, Н Н Н2SO4(конц.) Н-С
- 24. ЛАБОРАТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯ ДЕГАЛОГЕНИРОВАНИЕ ПРИМЕР: t Н2С – СН2 + Zn → Н2С = СН2 +
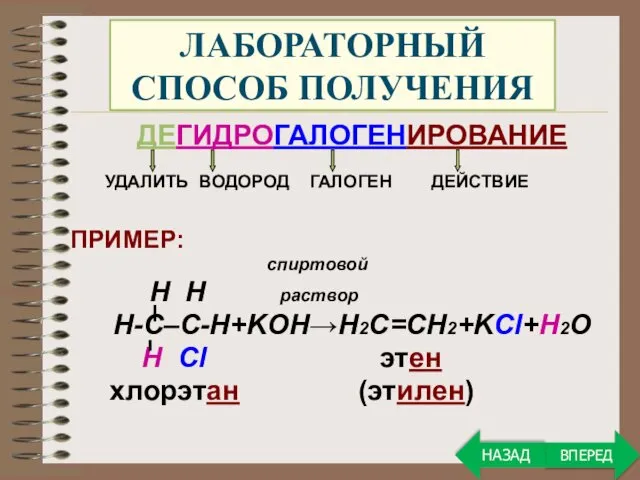
- 25. ЛАБОРАТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯ ДЕГИДРОГАЛОГЕНИРОВАНИЕ УДАЛИТЬ ВОДОРОД ГАЛОГЕН ДЕЙСТВИЕ ПРИМЕР: спиртовой H H раствор Н-С–С-Н+KOH→Н2С=СН2+KCl+H2O Н Cl
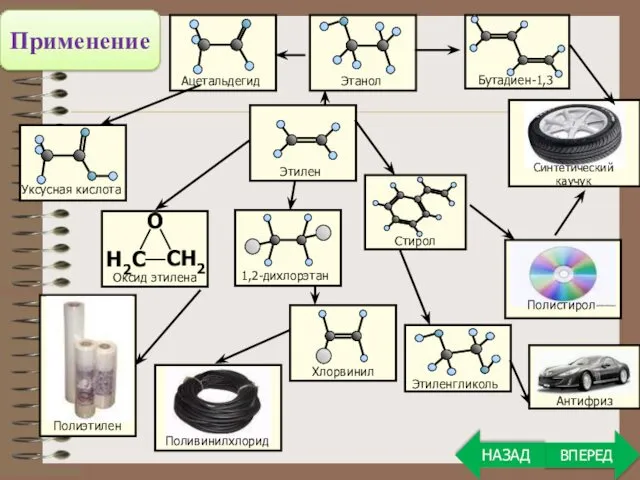
- 26. Применение ВПЕРЕД НАЗАД
- 27. Применение алкенов ВПЕРЕД НАЗАД
- 28. АЛКИНЫ Получение и применение алканов ВПЕРЕД НАЗАД
- 29. Получение АЛКИНОВ 1) В промышленности ацетилен получают высокотемпературным пиролизом метана. 1500ºС 2CH4 → HC≡CH + 3H2
- 30. 4) Алкины можно получить дегидрогалогенированием дигалогенопроизводных парафинов. Атомы галогена при этом могут быть расположены как у
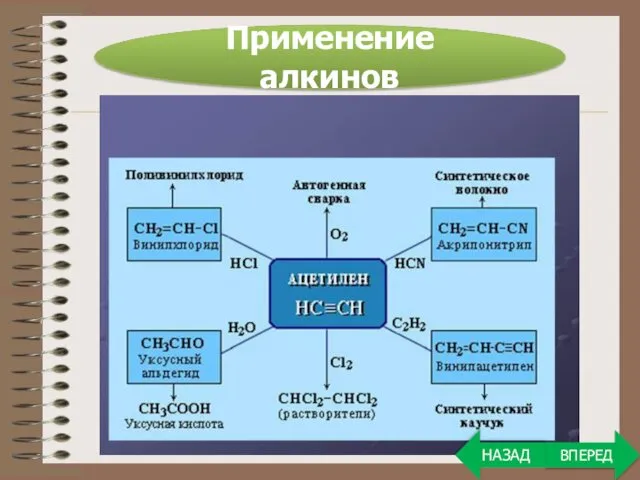
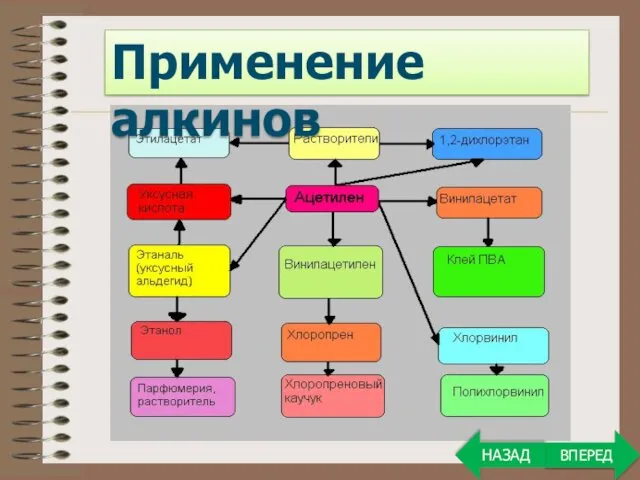
- 31. Применение алкинов ВПЕРЕД НАЗАД
- 32. Ранее ацетилен широко применялся для создания высокотемпературного пламени при газовой сварке. Сейчас на первый план вышло
- 33. Применение алкинов ВПЕРЕД НАЗАД
- 35. Скачать презентацию























 Начало столетней войны. Соперничество Англии и Франции. Жакерия
Начало столетней войны. Соперничество Англии и Франции. Жакерия пед.проектДифференцированный подход в обучении математики, как способ развития познавательной активности на уроке
пед.проектДифференцированный подход в обучении математики, как способ развития познавательной активности на уроке Романтизм и реализм романа Герой нашего времени. Роман в оценке В. Г. Белинского
Романтизм и реализм романа Герой нашего времени. Роман в оценке В. Г. Белинского Университетский гуманитарный класс
Университетский гуманитарный класс Технологии приема ТВ сигнала
Технологии приема ТВ сигнала Нестероїдні протизапальні засоби
Нестероїдні протизапальні засоби Решение задач по информатике ( по типу ОГЭ)
Решение задач по информатике ( по типу ОГЭ) Технологии сборочного производства
Технологии сборочного производства Сопереживание в картинах художников
Сопереживание в картинах художников Производство алюминия
Производство алюминия Современные образовательные технологии
Современные образовательные технологии Таблица сложения. Тренажёр Игра в футбол
Таблица сложения. Тренажёр Игра в футбол Развитие индивидуального жилищного строительства в Российской Федерации АО Банк ДОМ.РФ
Развитие индивидуального жилищного строительства в Российской Федерации АО Банк ДОМ.РФ Станционные пути и габаритные расстояния
Станционные пути и габаритные расстояния Функциональная полупроводниковая электроника. УФЭ (3)
Функциональная полупроводниковая электроника. УФЭ (3) Снегурочка в языческой культуре славян
Снегурочка в языческой культуре славян Сложение натуральных чисел
Сложение натуральных чисел Розв’язування текстових задач за допомогою систем рівнянь
Розв’язування текстових задач за допомогою систем рівнянь KS4502 包装指引 - 配 个电池 盖
KS4502 包装指引 - 配 个电池 盖 Презентация Новогодняя игрушка
Презентация Новогодняя игрушка Цінність послуги
Цінність послуги Правосознание и правовая культура. (Тема 18)
Правосознание и правовая культура. (Тема 18) Хрустальные деревья
Хрустальные деревья Состав и содержание проектно-конструкторской документации на швейные изделия
Состав и содержание проектно-конструкторской документации на швейные изделия Анемии у детей-4
Анемии у детей-4 Мастер класс Волшебные ленты
Мастер класс Волшебные ленты Построение третьего вида по двум данным
Построение третьего вида по двум данным Система менеджмента качества в аптечных организациях
Система менеджмента качества в аптечных организациях