Содержание
- 2. Учитель химии: Попова Светлана Анатольевна ГБОУ СОШ № 1465 Город Москва
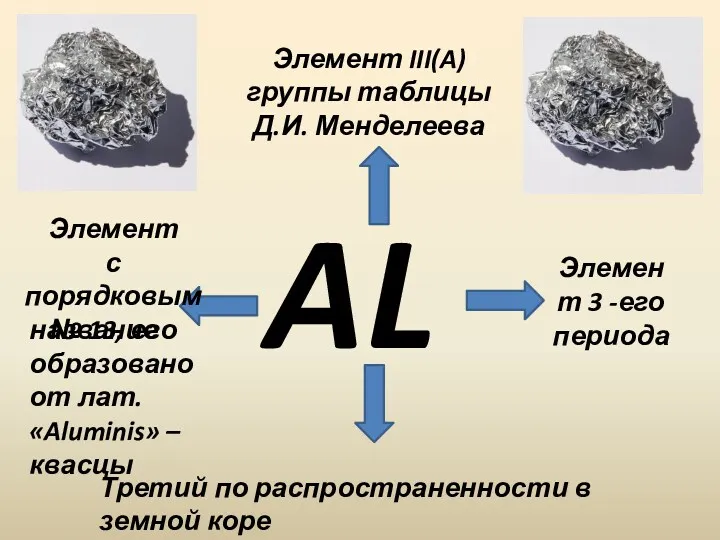
- 3. AL Элемент III(A) группы таблицы Д.И. Менделеева Элемент с порядковым № 13, его Элемент 3 -его
- 4. Датский физик Ганс Эрстед (1777-1851) Впервые алюминий был получен им в 1825 году действием амальгамы калия
- 5. Современное получение алюминия Современные метод получения был разработан независимо друг от друга: американцем Чарльзом Холлом и
- 6. Будучи студентом Оберлинского колледжа, он узнал, что можно разбогатеть и получить благодарность человечества, если изобрести способ
- 7. Поль Эру (1863-1914) – французский инженер - химик В 1889 году открыл алюминиевый завод во Фроне
- 8. Нахождение в природе Важнейшим на сегодня минералом алюминия является боксит Основной химический компонент боксита - глинозем
- 9. Физические свойства мягкий легкий (с малой плотностью – 2,7 г/см3) с высокой тепло- и электропроводностью легкоплавкий
- 10. с серой, образуя сульфид алюминия: 2Al + 3S = Al2S3 с азотом, образуя нитрид алюминия: 2Al
- 11. Химические свойства 1. с водой (после удаления защитной оксидной пленки) 2Al + 6H2O = 2Al(OH)3 +
- 12. ПРИМЕНЕНИЕ АЛЮМИНИЯ Легкий сплав дюраль используется в различных областях В Авиации В Космической технике В Электротехнике
- 14. Скачать презентацию










 Лекция №2, 3. Усилительные устройства. Основные понятия и определения
Лекция №2, 3. Усилительные устройства. Основные понятия и определения Сонячна система
Сонячна система Занятие Введение в программу
Занятие Введение в программу Знакомство с персональным компьютером. IT Essentials: программное и аппаратное обеспечение ПК v5.0
Знакомство с персональным компьютером. IT Essentials: программное и аппаратное обеспечение ПК v5.0 Здоровьесберегающие технологии на уроках математики
Здоровьесберегающие технологии на уроках математики Нестандартные уроки
Нестандартные уроки Классный час во 2 классе Мои права и права моих одноклассников
Классный час во 2 классе Мои права и права моих одноклассников Молитва ходатайства
Молитва ходатайства ВКР КОРНЕВА ПРЕЗЕНТ
ВКР КОРНЕВА ПРЕЗЕНТ Денежная система Германии
Денежная система Германии Всемирный день борьбы со СПИДом
Всемирный день борьбы со СПИДом Трансформаторы. Лекция 10
Трансформаторы. Лекция 10 Педагогический опыт Использование метода проектов
Педагогический опыт Использование метода проектов Zero conditional
Zero conditional Кислоты
Кислоты Полевые транзисторы
Полевые транзисторы Проектирование и разработка автоматизированной информационной системы для гостиничного предприятия
Проектирование и разработка автоматизированной информационной системы для гостиничного предприятия Вирусты гепатиттер А, В, С
Вирусты гепатиттер А, В, С Некоторые философские проблемы физики элементарных частиц
Некоторые философские проблемы физики элементарных частиц Материальная база обучения биологии
Материальная база обучения биологии Формирование культуры здорового образа жизни у учащихся
Формирование культуры здорового образа жизни у учащихся Орёл. Сильные стороны
Орёл. Сильные стороны Творчество Дионисия и Ушакова
Творчество Дионисия и Ушакова Gotovaya_prezentatsia_zadanie
Gotovaya_prezentatsia_zadanie Система управления содержимым
Система управления содержимым Методическая разработка раздела образовательной программы по ОБЖ, 7 класс
Методическая разработка раздела образовательной программы по ОБЖ, 7 класс Умный дом
Умный дом Памятка для родителей - гимназия
Памятка для родителей - гимназия