Содержание
- 2. Al 13 Алюминий (лат. (лат. Aluminium(лат. Aluminium) 3 8 2 26,9815 3s2 3p1 Порядковый номер. Химический
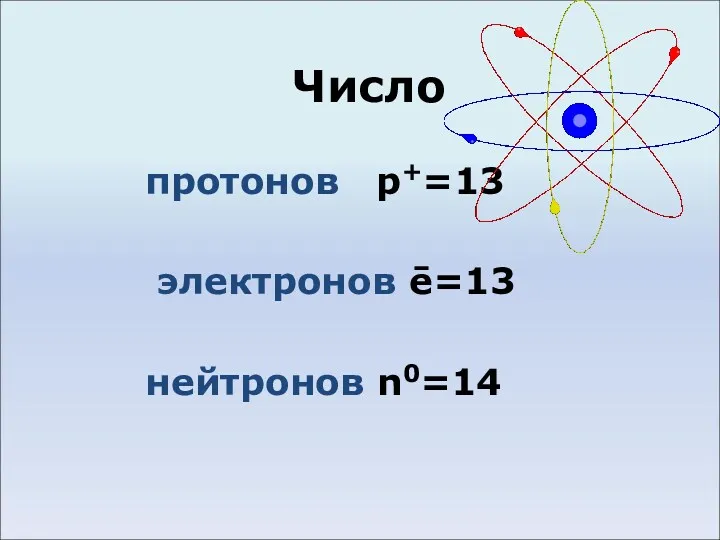
- 3. Число протонов p+=13 электронов ē=13 нейтронов n0=14
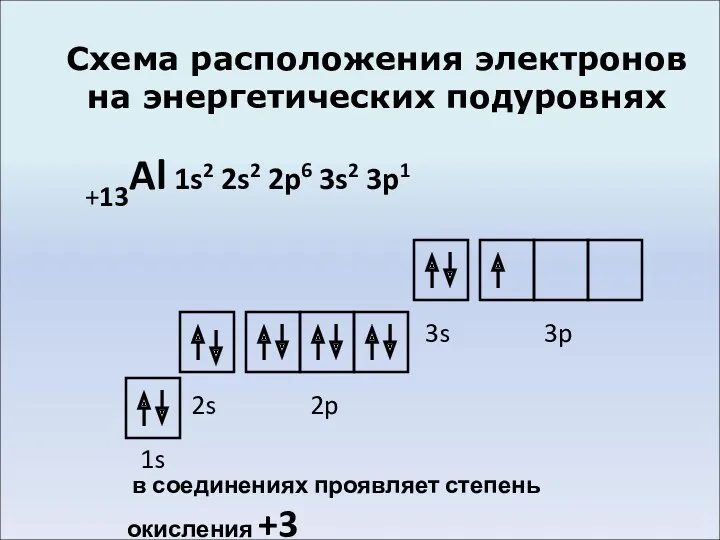
- 4. Схема расположения электронов на энергетических подуровнях +13Al 1s2 2s2 2p6 3s2 3p1 1s 2s 2p 3s
- 5. Al – типичный металл Восстановительные свойства Al 0- 3ē Al+3 Тип химической связи -металлическая Тип кристаллической
- 6. Физические свойства вещества Al – серебристо-белый металл, пластичный, легкий, хорошо проводит тепло и электрический ток, обладает
- 7. Особенности физических и химических свойств алюминия, его нахождения в природе и применения: Алюминий – самый распространенный
- 8. Алюминий реагирует с простыми веществами - неметаллами 4Al+3O2 = 2Al2O3 Поверхность покрывается пленкой оксида, в мелкораздробленном
- 9. Алюминий реагирует со сложными веществами: Алюминий растворяется в растворах кислот 2Al + 6HCl = 2AlCl3 +
- 10. Алюминий реагирует со сложными веществами: 3. Алюминий при высокой температуре реагирует с оксидами менее активных металлов
- 11. Алюминий реагирует со сложными веществами: 4.Так как алюминий – амфотерный металл, он реагирует с растворами щелочей.
- 12. Получение алюминия Алюминий получают электролизом раствора глинозема в расплавленном криолите (Na3AIF6) и электролизом расплава AlCl3
- 13. Применение Al
- 14. Соединения алюминия В природе алюминий встречается только в виде соединений и по распространенности в земной коре
- 15. Оксид алюминия Al2О3: Очень твердый (корунд, рубин)в кристаллическом состоянии, порошок белого цвета, тугоплавкий - 20500С. Не
- 16. Белый нерастворимый в воде порошок. Проявляет амфотерные свойства, взаимодействует: а) с кислотами Al (OH)3 + 3HCl
- 18. Скачать презентацию












 Киевская Русь в IX-XI веках. Политическая раздробленность Руси. Русь под властью Золотой Орды
Киевская Русь в IX-XI веках. Политическая раздробленность Руси. Русь под властью Золотой Орды Презентация Развитие зрительно-пространственной и зрительно-моторной координации
Презентация Развитие зрительно-пространственной и зрительно-моторной координации Планеты - гиганты
Планеты - гиганты Родительское собрание по итогам 1-го и 2-го триместров
Родительское собрание по итогам 1-го и 2-го триместров Антенны, СВЧ-устройства и их технологии
Антенны, СВЧ-устройства и их технологии Геохронологічна таблиця
Геохронологічна таблиця Культурное многообразие народов Сибири. (Лекция 4)
Культурное многообразие народов Сибири. (Лекция 4) Трансформаторы. Принцип действия
Трансформаторы. Принцип действия Модуль числа
Модуль числа Презентация на конкурс профсоюза
Презентация на конкурс профсоюза Логопедическая ритмика
Логопедическая ритмика Святая мать добром спасет
Святая мать добром спасет Межрайонный фестиваль ученического самоуправления Алые паруса. Этап фестиваля: 250 новогодних ночей
Межрайонный фестиваль ученического самоуправления Алые паруса. Этап фестиваля: 250 новогодних ночей Консультация для педагогов Толерантность
Консультация для педагогов Толерантность Озеро Байкал на юге Восточной Сибири
Озеро Байкал на юге Восточной Сибири Знакомство с Windows 8
Знакомство с Windows 8 От Рождества до Крещения. Обычаи и традиции
От Рождества до Крещения. Обычаи и традиции Распознавание пластмасс и волокон. Лабораторная работа
Распознавание пластмасс и волокон. Лабораторная работа Презентация к уроку Стратегии поведения в конфликте
Презентация к уроку Стратегии поведения в конфликте Твердые смазки
Твердые смазки Жизненный цикл клетки. Деление клетки. Митоз. Мейоз. Амитоз. Эндомитоз
Жизненный цикл клетки. Деление клетки. Митоз. Мейоз. Амитоз. Эндомитоз Тіндегі сұйықтық мөлшерінің бұзылуы:сулану,қуыстар шемені,шарана мен жаңа туған нәрестенің сулануы,эксикоз
Тіндегі сұйықтық мөлшерінің бұзылуы:сулану,қуыстар шемені,шарана мен жаңа туған нәрестенің сулануы,эксикоз Truth or lie. Arrangement in the black and white
Truth or lie. Arrangement in the black and white Поисковый проект Я помню! Я горжусь!
Поисковый проект Я помню! Я горжусь! Презентация Подарок для мамы
Презентация Подарок для мамы The smartphone
The smartphone Обзор новых скверов города Уфы
Обзор новых скверов города Уфы Палитры цветов в системах цветопередачи RGB, CMYK и HSB
Палитры цветов в системах цветопередачи RGB, CMYK и HSB