Содержание
- 2. Какие из исходных веществ друг с другом реагировать не будут? 1) SO2 + NaOH → 2)
- 3. Из перечня формул оксидов, выберите те формулы оксидов, которые относятся к кислотным: FeO CO2 CuO MgO
- 4. Из перечня формул оксидов, выберите те формулы оксидов, которые относятся к основным: FeO NO2 BaO CO
- 5. H3PO4 + 3KOH → K3PO4 + 3H2O Выберите из перечня формулы двух веществ, которые будут с
- 6. Ответьте на следующие вопросы: Кислотные оксиды взаимодействуют с кислотами? Основные оксиды взаимодействуют с основаниями? Кислоты взаимодействуют
- 7. АМФОТЕРНЫЕ ОКСИДЫ И ГИДРОКСИДЫ Амфоте́рность (от др.-греч. ἀμφότεροι «двойственный; обоюдный») — способность некоторых химических веществ и
- 8. ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ Взаимодействие с кислотами: Взаимодействие с щелочами: BeO + 2HCI → BeCI2 +
- 9. ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ГИДРОКСИДОВ Формулы амфотерных гидроксидов можно изобразить следующим образом: Zn(OH)2 ▬ H2ZnO2 Al(OH)3 ▬
- 10. АМФОТЕРНОСТЬ ГИДРОКСИДА ЦИНКА
- 12. Скачать презентацию
 Совершенствование технологии транспортировки картофеля с дополнительной сепарацией во время движения транспортного средства
Совершенствование технологии транспортировки картофеля с дополнительной сепарацией во время движения транспортного средства Партизанское движение в годы Великой Отечественной войны на временно оккупированной территории СССР
Партизанское движение в годы Великой Отечественной войны на временно оккупированной территории СССР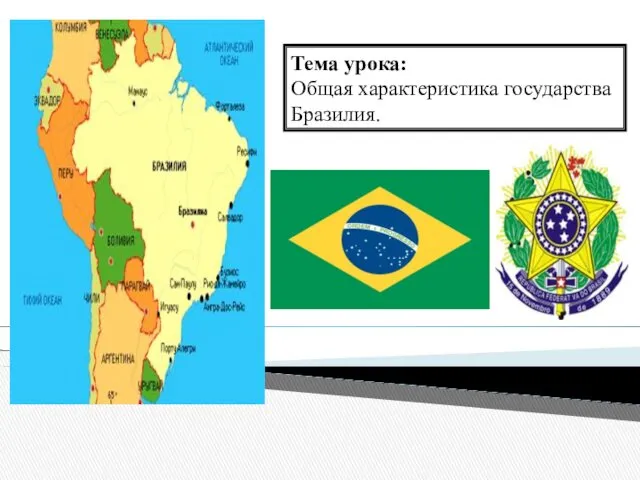 Общая характеристика государства Бразилия
Общая характеристика государства Бразилия Создание системы предупреждения потопа
Создание системы предупреждения потопа Презентация к классному часу Профессия - журналист 4 класс
Презентация к классному часу Профессия - журналист 4 класс Озеленение инженерных сооружений
Озеленение инженерных сооружений Твой спортивный уголок
Твой спортивный уголок Городец На Волге
Городец На Волге Путешествие в Норвегию. Эдвард Григ
Путешествие в Норвегию. Эдвард Григ Из опыта работы.
Из опыта работы. Открытие первого магазина Пятёрочка в Калининграде. Блогеры
Открытие первого магазина Пятёрочка в Калининграде. Блогеры Славянская религия
Славянская религия Этапы развития психологии. (Лекция 2)
Этапы развития психологии. (Лекция 2) Кроссворд Иудаизм
Кроссворд Иудаизм Формирование коммуникативных универсальных учебных действий на уроках математики в 6 классе
Формирование коммуникативных универсальных учебных действий на уроках математики в 6 классе Исследование органов пищеварения
Исследование органов пищеварения Керування на мережах зв'язку
Керування на мережах зв'язку Урок химии в 10 классе Получение и применение карбоновых кислот
Урок химии в 10 классе Получение и применение карбоновых кислот Цикл занятий Деревья. Береза
Цикл занятий Деревья. Береза Научно-педагогическая практика в гимназии Альма-матер и гимназии №239. Основные трудности в педагогической деятельности
Научно-педагогическая практика в гимназии Альма-матер и гимназии №239. Основные трудности в педагогической деятельности MSC. Contracts 2022
MSC. Contracts 2022 Избирательная система
Избирательная система Сюжетно-ролевая игра как средство нравственного воспитания старших дошкольников
Сюжетно-ролевая игра как средство нравственного воспитания старших дошкольников Показатели и характеристики поршневых ДВС. (Тема 4)
Показатели и характеристики поршневых ДВС. (Тема 4) слова и звуки
слова и звуки Индивидуальная гигиена полости рта. Профессиональная гигиена полости рта
Индивидуальная гигиена полости рта. Профессиональная гигиена полости рта Божья коровка
Божья коровка Опыт воспитательной работы
Опыт воспитательной работы