Содержание
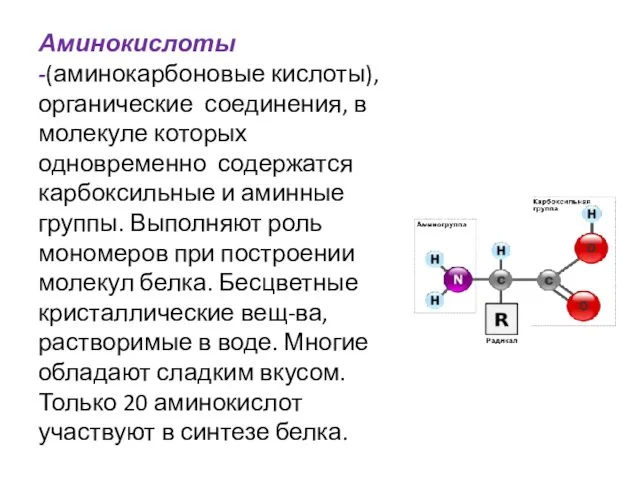
- 2. Аминокислоты -(аминокарбоновые кислоты), органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы. Выполняют роль
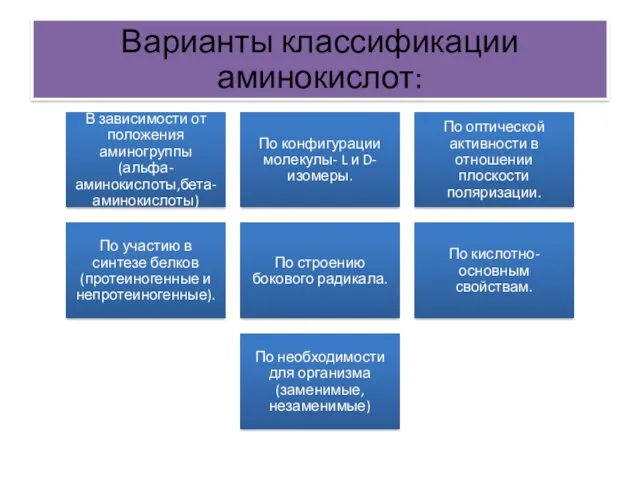
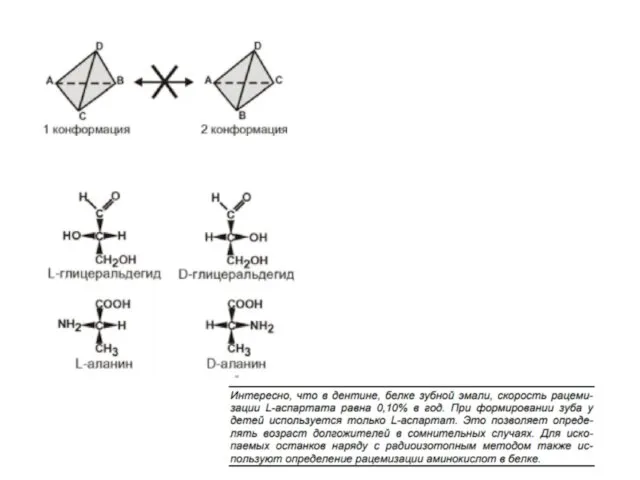
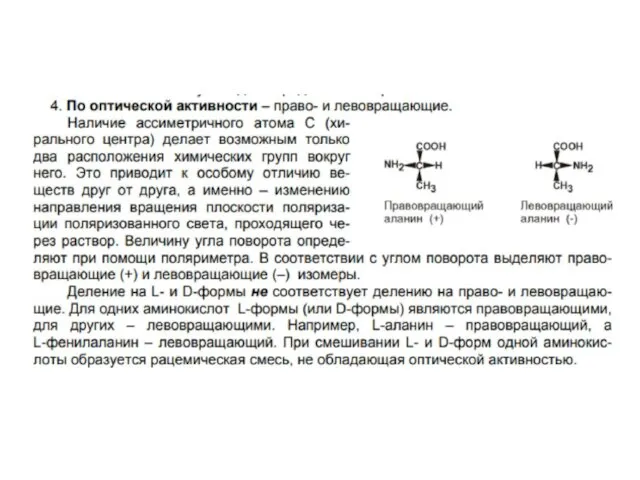
- 4. Варианты классификации аминокислот:
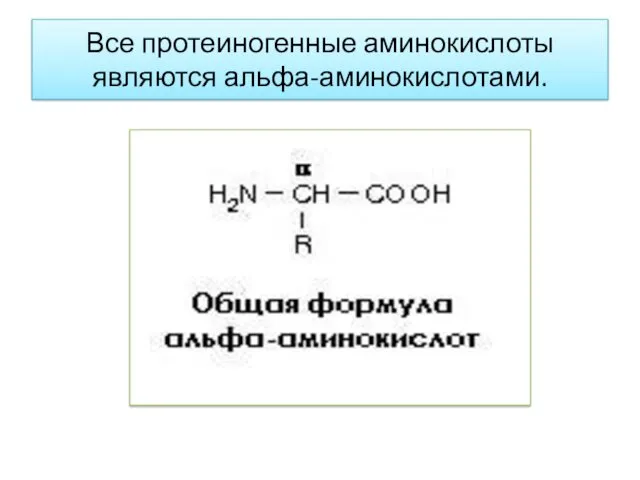
- 6. Все протеиногенные аминокислоты являются альфа-аминокислотами.
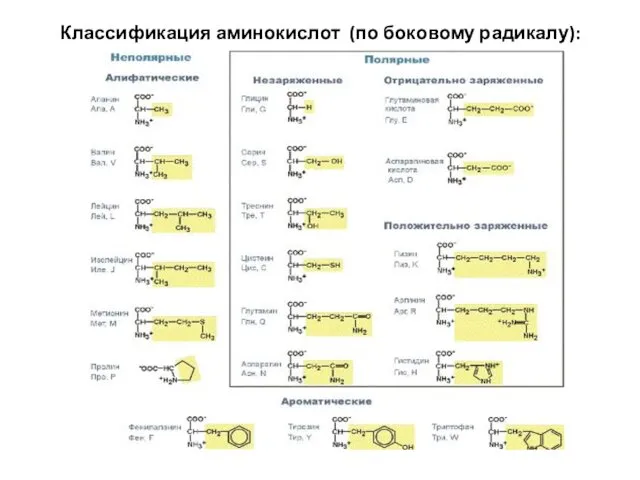
- 10. Классификация аминокислот (по боковому радикалу):
- 11. Незаменимые: лейцин (ЛЕЙ, L), изолейцин (ИЛЕ, J), валин (ВАЛ,V), фенилаланин (ФЕН, F), триптофан (ТРИ, W), треонин
- 12. Валин: зерновые, бобовые, мясо, грибы, молочные продукты, арахис. Изолейцин: миндаль, кешью, куриное мясо, турецкий горох (нут),
- 13. Отдельные представители аминокислот и их свойства. Алифатические: Глицин(ГЛИ), или гликокол, аминоуксусная кислота. Единственная оптически неактивная. Участвует
- 14. Серосодержащие: Цистеин (ЦИС) -благодаря активной группе –SH легко вступает в окислительно-восстановительные реакции, защищая клетку от действия
- 15. Содержащие -ОН группу (гидроксиаминокислоты) Группа -ОН легко взаимодействует с фосфорной кислотой , что бывает необходимо для
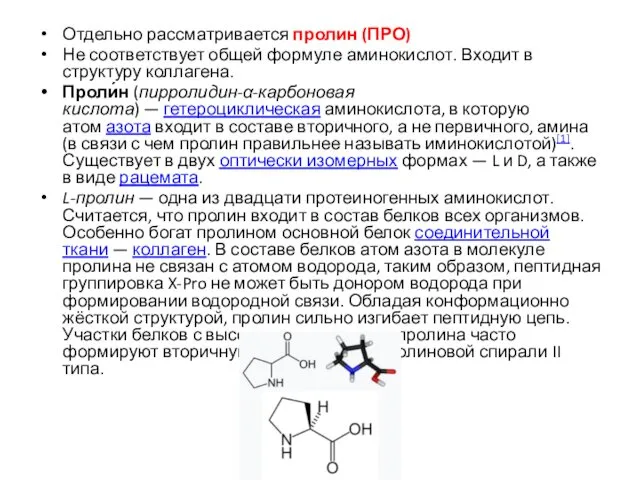
- 16. Отдельно рассматривается пролин (ПРО) Не соответствует общей формуле аминокислот. Входит в структуру коллагена. Проли́н (пирролидин-α-карбоновая кислота)
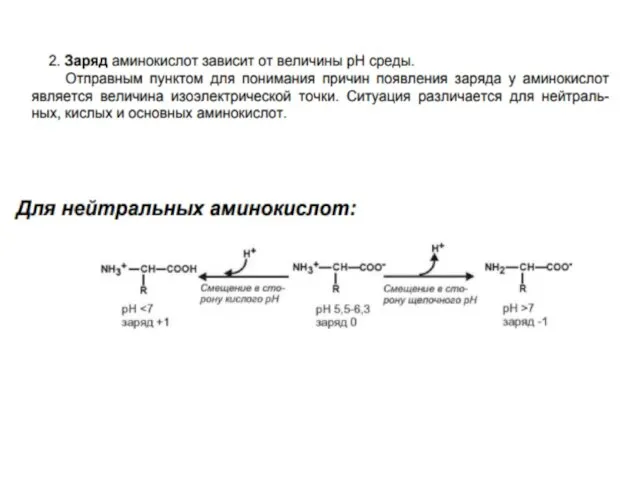
- 18. Общие свойства аминокислот. Кислотноосновные свойства аминокислот определяют многие свойства белков.Все аминокислоты-амфотерные соединения , они могут проявлять
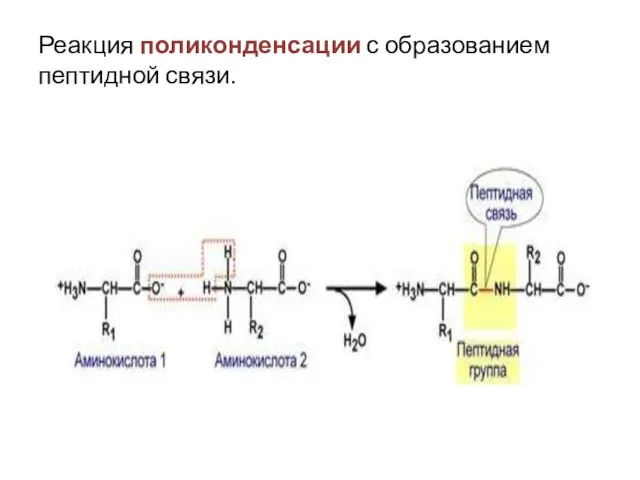
- 20. Реакция поликонденсации с образованием пептидной связи.
- 21. Получают аминокислоты гидролизом белков или с помощью химических реакций в присутствии катализатора.
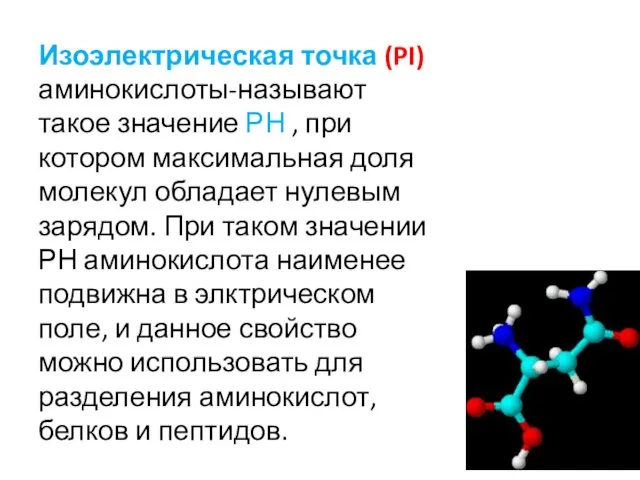
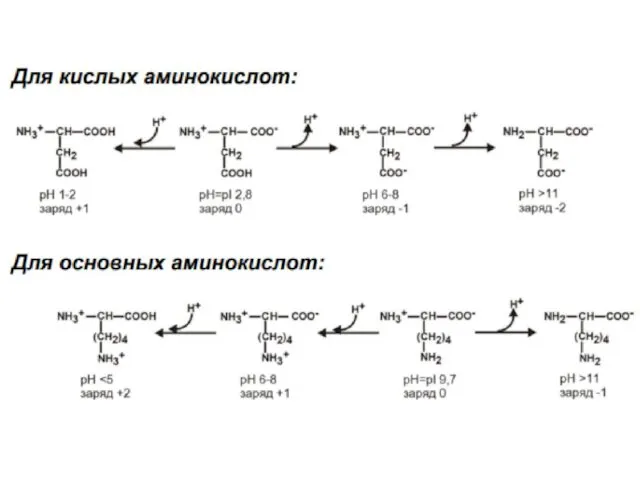
- 22. Изоэлектрическая точка (PI) аминокислоты-называют такое значение РН , при котором максимальная доля молекул обладает нулевым зарядом.
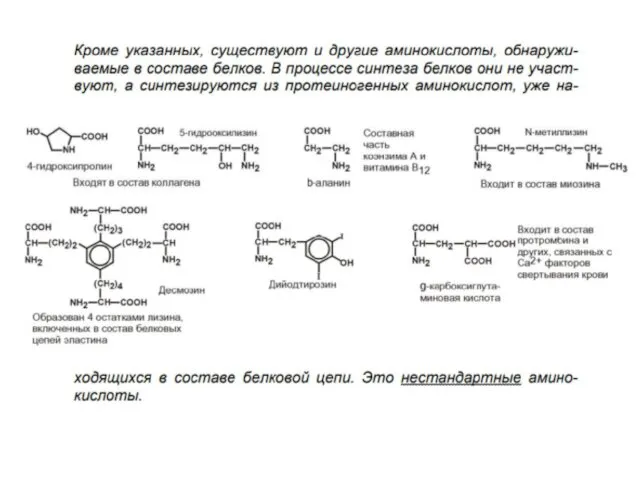
- 26. Биологическое значение аминокислот. Входят в состав белков и пептидов. Образуют биол. активные вещества (биогенные амины). Часть
- 29. Пептиды (от греч. “питательный”) – семейство веществ, молекулы которых построены из остатков альфа-аминокислот, соединённых в цепь
- 30. На сегодняшний день известно > 1500 видов пептидов. Пептиды постоянно синтезируются во всех живых организмах. Свойства
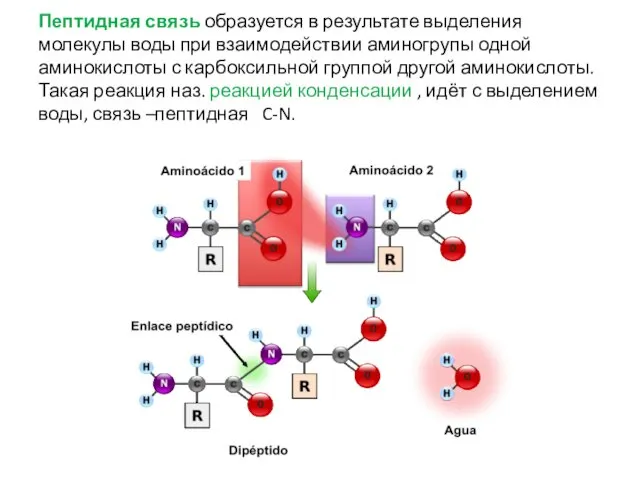
- 31. Пептидная связь образуется в результате выделения молекулы воды при взаимодействии аминогрупы одной аминокислоты с карбоксильной группой
- 32. Классификация пептидов. Их биологическая роль. Группа пептидов, содержащих глутаминовую кислоту, образующих пептидную связь своей гамма-карбоксильной группой.
- 33. 5. Пептиды-нейромедиаторы-существуют группы нейронов, связанных между собой молекулами-посредниками пептидной природы (“субстанция Р”). 6. Нейропептиды –секретируются нервными
- 34. Хроматография При всех хроматографических методах разделения молекулы распределяются между стационарной и подвижной фазами (табл. 3.6). Разделение
- 36. Скачать презентацию



















 Социальные иституты
Социальные иституты Гемолитические анемии. Клиника, диагностика, лечение
Гемолитические анемии. Клиника, диагностика, лечение Требования к оформлению исследовательской работы для научно-исследовательской конференции
Требования к оформлению исследовательской работы для научно-исследовательской конференции Презентация, классный час Новый год в разных странах
Презентация, классный час Новый год в разных странах презентация Виды сказок в работе с детьми дошкольного возраста
презентация Виды сказок в работе с детьми дошкольного возраста Влияние телевизора на здоровье младшего школьника
Влияние телевизора на здоровье младшего школьника Первоцветы 1 класс внеурочная деятельность Я и мой мир
Первоцветы 1 класс внеурочная деятельность Я и мой мир Воспитательный час Семья и Отечество
Воспитательный час Семья и Отечество Заболевания носа, придаточных пазух
Заболевания носа, придаточных пазух Медицинская деонтология и этика. Основные термины и понятия
Медицинская деонтология и этика. Основные термины и понятия Воспаление: определение, сущность, биологическое значение
Воспаление: определение, сущность, биологическое значение phpOdviwa_rozhdestvo
phpOdviwa_rozhdestvo Проект Сказки Г.Х.Андерсена
Проект Сказки Г.Х.Андерсена Перспективы развития агроэкотуризма в Витебской области в соответствии с международным экологическим стандартом качества ЕСЕАТ
Перспективы развития агроэкотуризма в Витебской области в соответствии с международным экологическим стандартом качества ЕСЕАТ Путешествие по островам природы
Путешествие по островам природы Разработка технологического процесса изготовления детали Крышка
Разработка технологического процесса изготовления детали Крышка Каспий маңы мұнай-газды бассейнінің оңтүстік-шығыс бөлігінің шоғырлар бойынша жіктемесі
Каспий маңы мұнай-газды бассейнінің оңтүстік-шығыс бөлігінің шоғырлар бойынша жіктемесі Про те, якими ми не є
Про те, якими ми не є История применения математических методов в экономике
История применения математических методов в экономике Таблица сложения. 1 класс
Таблица сложения. 1 класс каверин
каверин Вибрато. Виды
Вибрато. Виды Кинезиология. Развивающая программа
Кинезиология. Развивающая программа Экологический анализ предприятий
Экологический анализ предприятий Жизнь класса
Жизнь класса Герметизация фиссур
Герметизация фиссур Картотека игр на участке в летний период
Картотека игр на участке в летний период New York is the most populous city in US
New York is the most populous city in US