Содержание
- 2. Открытие электрона Многие исследователи изучали поток частиц в стеклянных трубках, наполненных газом при низких давлениях. Такие
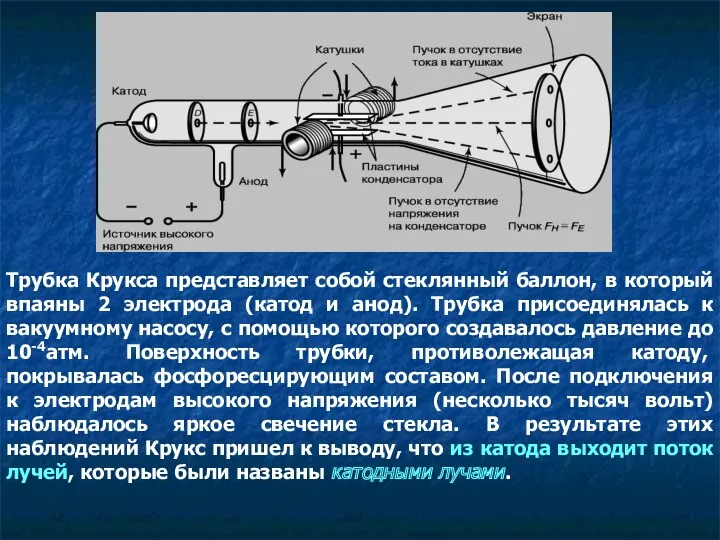
- 3. Трубка Крукса представляет собой стеклянный баллон, в который впаяны 2 электрода (катод и анод). Трубка присоединялась
- 4. Если на пути катодных лучей находится какое-либо препятствие, то на фосфоресцирующей поверхности наблюдается тень этого предмета.
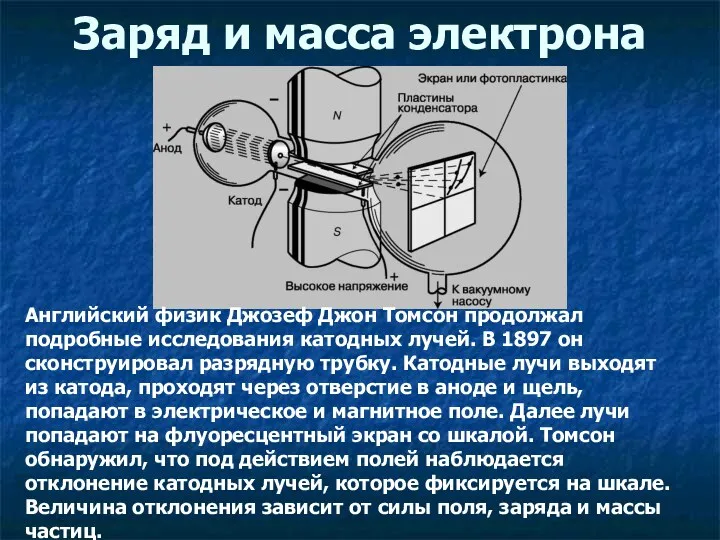
- 5. Заряд и масса электрона Английский физик Джозеф Джон Томсон продолжал подробные исследования катодных лучей. В 1897
- 6. Джозеф Джон Томсон (1856 –1940) Заряд и масса электрона Измеряя отклонение пучка электронов в зависимости от
- 7. Точно величина заряда электрона была измерена Милликеном, который в своих опытах добивался, чтобы заряженные капельки масла
- 8. Другие доказательства сложной структуры атома Вильгельм Конрад Рентген (1845 – 1923) В 1895 В.Рентген случайно обнаружил
- 9. Модель атома У.Томсона Уильям Томсон (1824 – 1907) Уильям Томсон представляет атом как некую положительно заряженную
- 10. Модель атома Дж.Томсона Джозеф Джон Томсон (1856 –1940) Джозеф Джон Томсон представил свою модель строения атома
- 11. Модель атома Ленарда Филипп Фон Ленард (1862 – 1947) Ленард предложил свою модель строения атома в
- 12. Модель атома Нагаока Хантаро Нагаока (1865 – 1950) Хантаро Нагаока предложил свою модель строения атома в
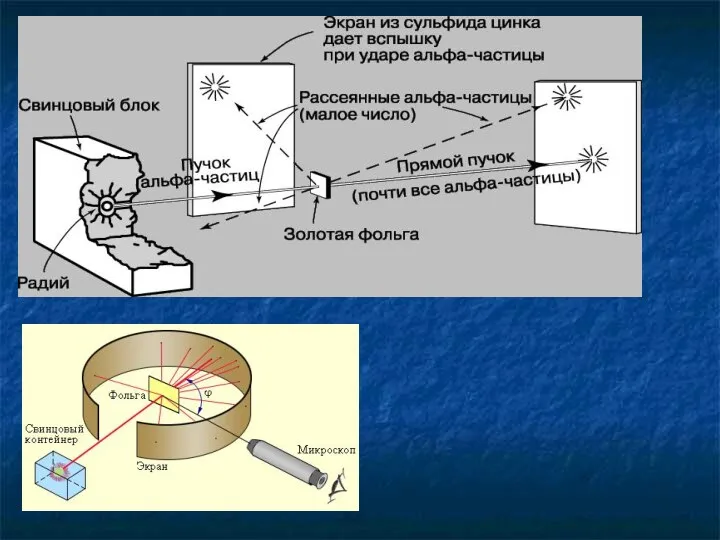
- 13. Опыт Резерфорда Эрнест Резерфорд (1871-1937) Ганс Вильгельм Гейгер (1882 – 1945) Эрнест Марсден (1889 – 1970)
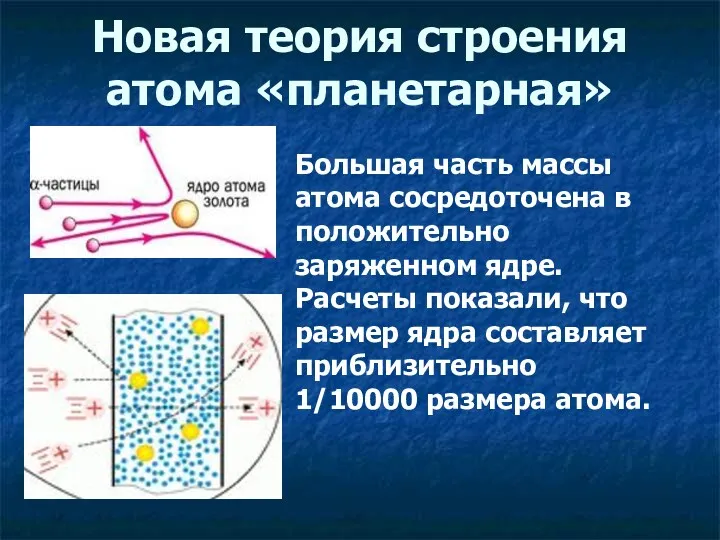
- 15. Новая теория строения атома «планетарная» Большая часть массы атома сосредоточена в положительно заряженном ядре. Расчеты показали,
- 16. Постулаты Бора Нильс Хенрик Давид Бор (1885-1962) Электроны находятся на определенных стационарных орбитах, двигаясь по которым
- 18. Скачать презентацию











 Общественное движение в 70-80- х гг. 19 века. 8 класс
Общественное движение в 70-80- х гг. 19 века. 8 класс Россия в начале XX века
Россия в начале XX века Электронагревательные приборы. Лампы накаливания
Электронагревательные приборы. Лампы накаливания экология
экология Проект на тему : Игра как средство развития речи
Проект на тему : Игра как средство развития речи Классный час во 2 классе Страна, в которой я хочу жить
Классный час во 2 классе Страна, в которой я хочу жить Презентация: Утренняя гимнастика
Презентация: Утренняя гимнастика Презентация Подготовка к обучению грамоте детей с ОНР
Презентация Подготовка к обучению грамоте детей с ОНР Классный час, 3 класс, Тема Здоровые дети в здоровой семье
Классный час, 3 класс, Тема Здоровые дети в здоровой семье Игра Подари картинки Боре
Игра Подари картинки Боре Повышение экономичности газотурбинных установок
Повышение экономичности газотурбинных установок Вирусные и бактериальные воздушно-капельные инфекции. Грипп. Корь. Скарлатина. Менингококковая инфекция. Дифтерия. Легионеллез
Вирусные и бактериальные воздушно-капельные инфекции. Грипп. Корь. Скарлатина. Менингококковая инфекция. Дифтерия. Легионеллез Киіз үй
Киіз үй Домашние занятия фортепиано. Правила и советы.
Домашние занятия фортепиано. Правила и советы. Мать солдата, пропавшего без вести
Мать солдата, пропавшего без вести История международных отношений в Тихоокеанском регионе
История международных отношений в Тихоокеанском регионе Портфолио начальных классов
Портфолио начальных классов Строение клетки
Строение клетки Свойства океанической воды.
Свойства океанической воды. Методика развития двигательной сферы детей с нарушением речи
Методика развития двигательной сферы детей с нарушением речи Презентация Проблемы преемственности дошкольного и начального общего образования в условиях введения ФГОС
Презентация Проблемы преемственности дошкольного и начального общего образования в условиях введения ФГОС Презентация Свойства воздуха и воды
Презентация Свойства воздуха и воды Обрезка яблони и груши
Обрезка яблони и груши Идентификационная экспертиза вяленых рыбных товаров
Идентификационная экспертиза вяленых рыбных товаров Как прекрасно все то, что Твое,
Как прекрасно все то, что Твое,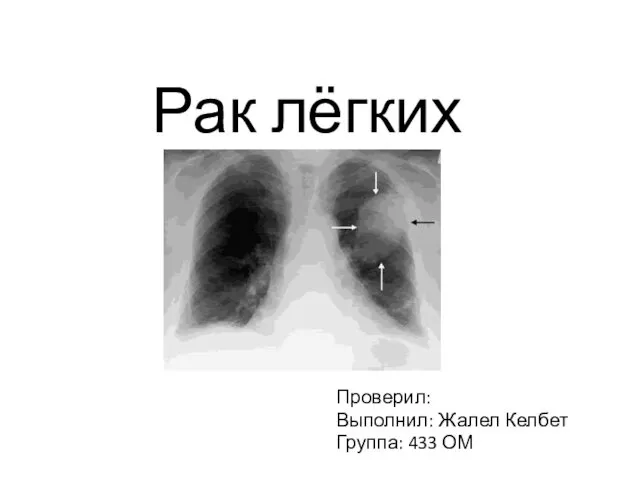 Рак лёгких
Рак лёгких Уроки вежливости.
Уроки вежливости. 20230204_himicheskiy_istochnik_pitaniya_-_svoimi_rukami
20230204_himicheskiy_istochnik_pitaniya_-_svoimi_rukami