Содержание
- 2. Проверка знаний
- 3. 1.Определите, о каком веществе идёт речь I вариант Бесцветный газ, плохо растворим в воде, легко соединяется
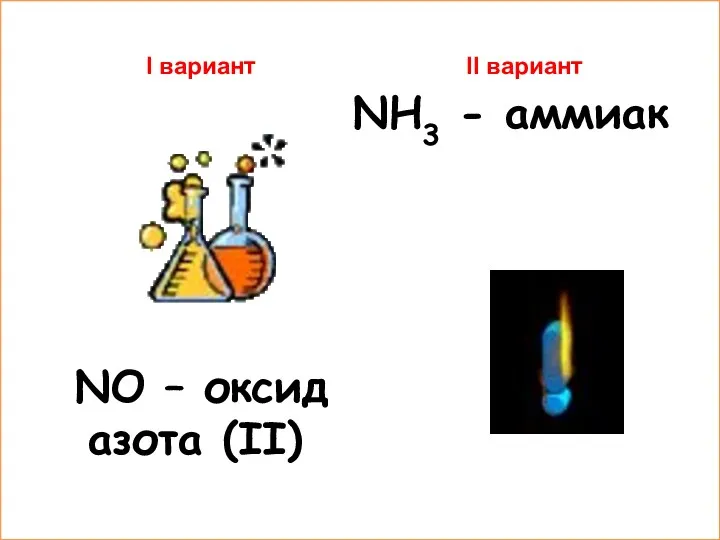
- 4. I вариант NO – оксид азота (II) II вариант NH3 - аммиак
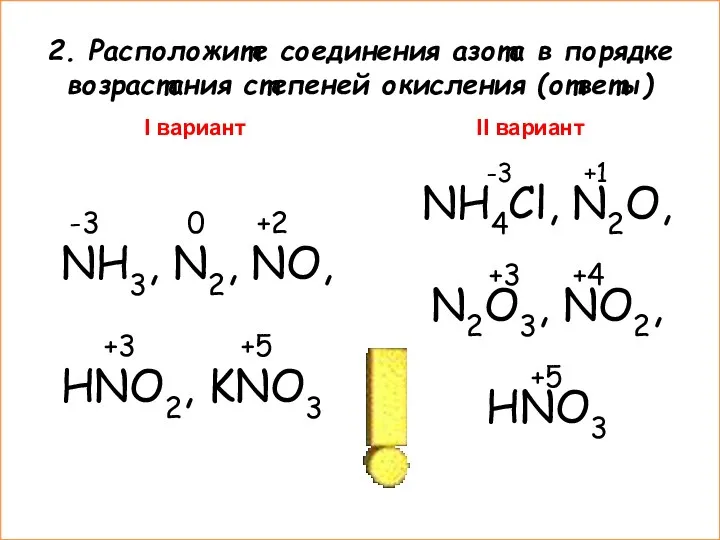
- 5. 2. Расположите соединения азота в порядке возрастания степеней окисления I вариант N2, NH3, KNO3, NO, HNO2
- 6. 2. Расположите соединения азота в порядке возрастания степеней окисления (ответы) I вариант -3 0 +2 NH3,
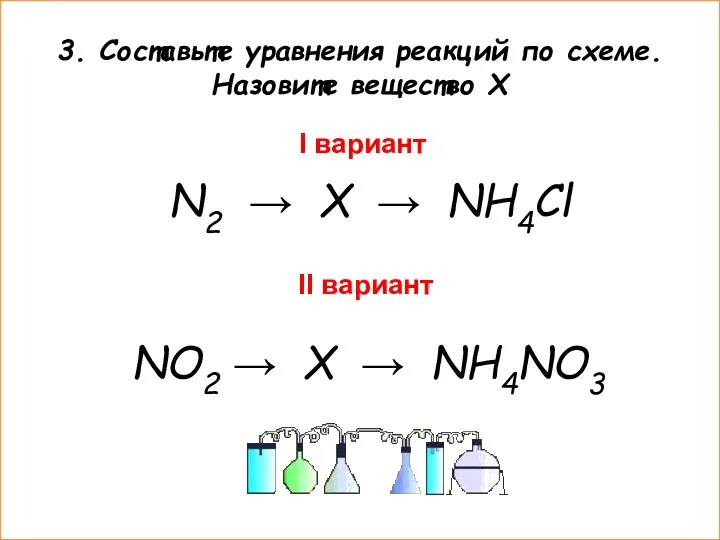
- 7. 3. Составьте уравнения реакций по схеме. Назовите вещество Х I вариант N2 → X → NH4Cl
- 8. 3. Составьте уравнения реакций по схеме. Назовите вещество Х (ответы) I вариант X – NH3 (аммиак)
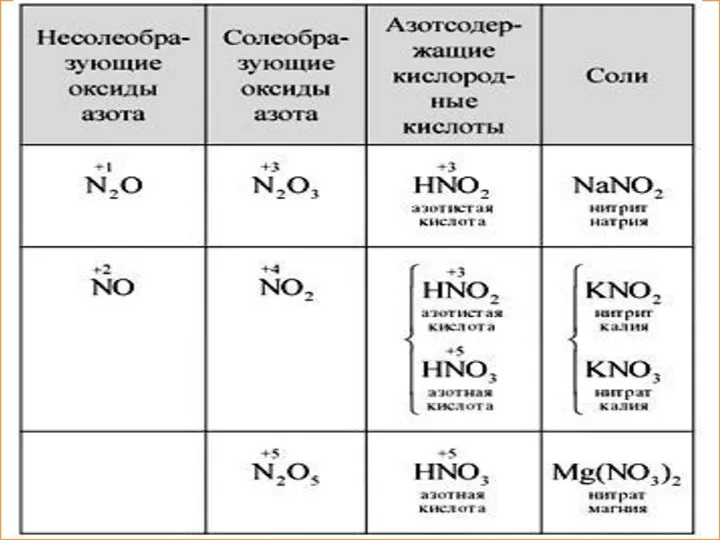
- 9. Кислородные соединения азота. Азотная кислота План изучения: I. Оксиды азота. Физические свойства азотной кислоты; II. Характеристика
- 11. I. Физические свойства азотной кислоты Агрегатное состояние – жидкость; Цвет – отсутствует; Запах – едкий, кислотный;
- 12. II. Характеристика HNO3 По основности: одноосновная 2. По содержанию «О»: кислородсодержащая 3. По растворимости в воде:
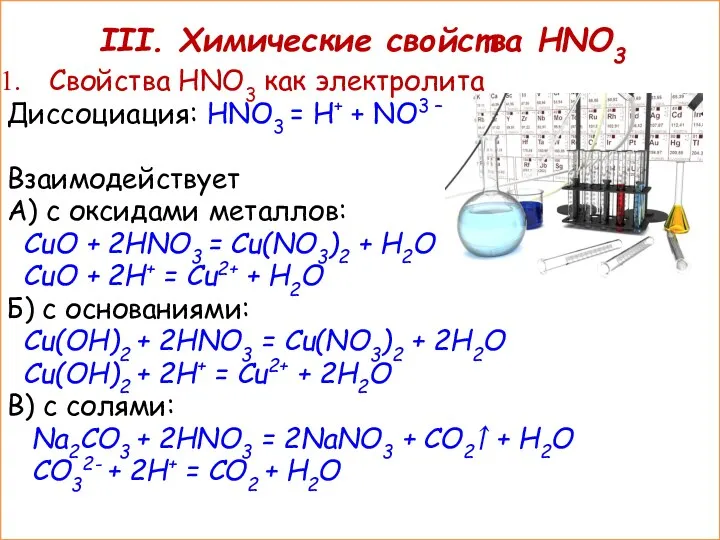
- 13. III. Химические свойства HNO3 Свойства HNO3 как электролита Диссоциация: HNO3 = H+ + NO3 – Взаимодействует
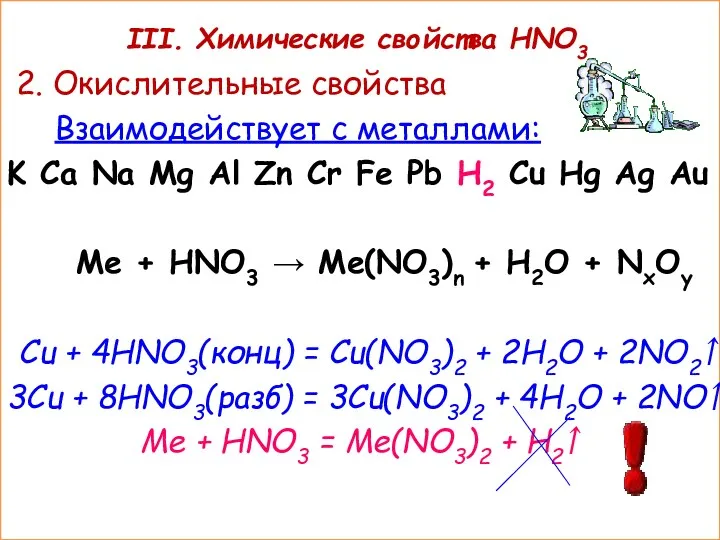
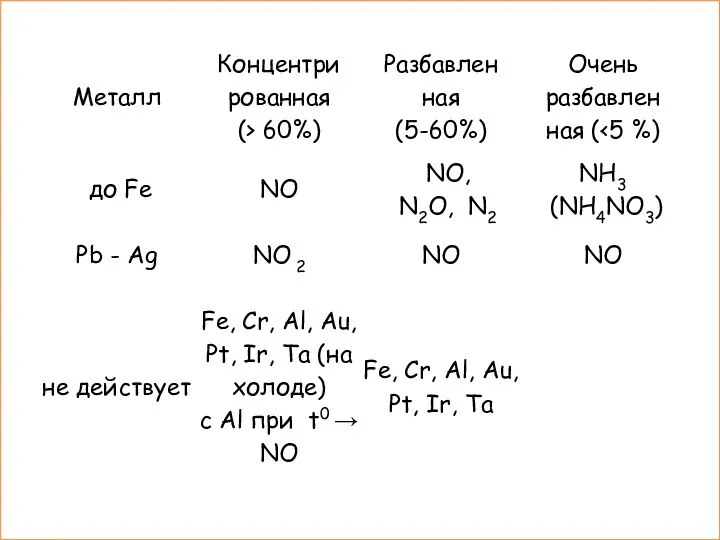
- 14. III. Химические свойства HNO3 2. Окислительные свойства Взаимодействует с металлами: K Ca Na Mg Al Zn
- 16. III. Химические свойства HNO3 2. Окислительные свойства Взаимодействует с неметаллами: (S, P, C) C + 4HNO3
- 17. IV. Применение азотной кислоты HNO3
- 18. Вопросы на закрепление I. Назовите вещества, с которыми может реагировать азотная кислота как электролит: SO2 H2
- 20. Скачать презентацию









 ФГТ В ДОУ
ФГТ В ДОУ Нефтяная компания ЛУКОЙЛ
Нефтяная компания ЛУКОЙЛ Понятие, сущность и основные функции менеджмента
Понятие, сущность и основные функции менеджмента 12 апреля - Всемирный день авиации и космонавтики
12 апреля - Всемирный день авиации и космонавтики Праздник Масленица Диск
Праздник Масленица Диск Презентация родительское собрание Моя первая оценка
Презентация родительское собрание Моя первая оценка Онлайн и офлайн маркетинг для заведения. HIWIFI market solutions
Онлайн и офлайн маркетинг для заведения. HIWIFI market solutions 20150518051140223_4VEXMP26
20150518051140223_4VEXMP26 Медицинская документация, используемая в стационарах и поликлиниках. Требования к заполнению
Медицинская документация, используемая в стационарах и поликлиниках. Требования к заполнению Путешествие по городу профессий.
Путешествие по городу профессий. Посвящаю тебе мой Родной
Посвящаю тебе мой Родной урок
урок ПРЕЗЕНТАЦИЯ для 11АБ классов ФУНКЦИИ
ПРЕЗЕНТАЦИЯ для 11АБ классов ФУНКЦИИ Пуск электродвигателя насоса пресной воды судна
Пуск электродвигателя насоса пресной воды судна Урок-праздник По дорогам страны Знаний
Урок-праздник По дорогам страны Знаний Преподобный Даниил Шужгорский
Преподобный Даниил Шужгорский Типтік технологиялық үрдістерді автоматтандырудың техникалық құралдары. 2-дәріс
Типтік технологиялық үрдістерді автоматтандырудың техникалық құралдары. 2-дәріс Презентация к 1 ур Экономика 1990г
Презентация к 1 ур Экономика 1990г Брахма - Самхита
Брахма - Самхита классный час Путешествие по стране экологии
классный час Путешествие по стране экологии Нефтяные проблемы на Каспии и вопросы преодоления экологических угроз и рисков Прикаспийского региона
Нефтяные проблемы на Каспии и вопросы преодоления экологических угроз и рисков Прикаспийского региона История развития волейбола, 5-6 класс
История развития волейбола, 5-6 класс Интернет зависимость среди молодежи
Интернет зависимость среди молодежи урок, Презентация
урок, Презентация Профессиональный имидж современного педагога (статья и презентация)
Профессиональный имидж современного педагога (статья и презентация) Научно-технический прогресс
Научно-технический прогресс Акция Дари добро
Акция Дари добро Диссоциация электролитов
Диссоциация электролитов