Содержание
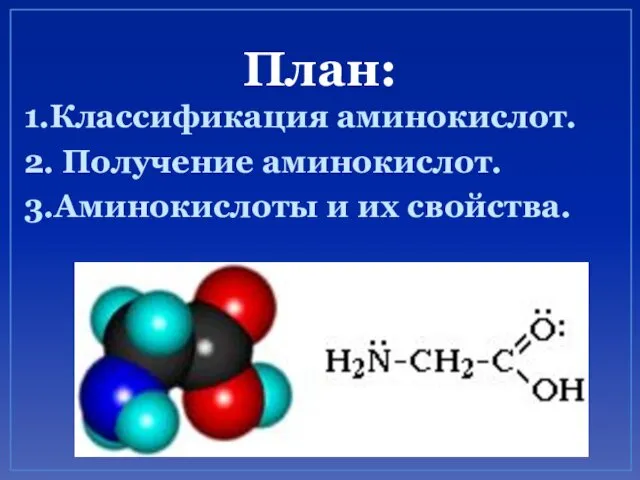
- 2. План: 1.Классификация аминокислот. 2. Получение аминокислот. 3.Аминокислоты и их свойства.
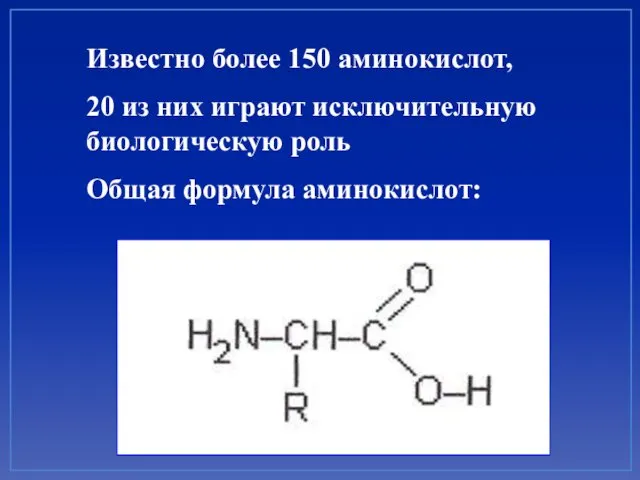
- 3. Известно более 150 аминокислот, 20 из них играют исключительную биологическую роль Общая формула аминокислот:
- 4. Аминокислоты – органические соединения, содержащие два типа функциональных групп с противоположными свойствами: аминогруппу (–NH2) и карбоксильную
- 8. 1.Классификация аминокислот
- 9. Аминокислоты классифицируют по двум структурным признакам. В зависимости от взаимного расположения амино- и карбоксильной групп аминокислоты
- 10. По функциональным группам Алифатические Моноаминомонокарбоновые: глицин, аланин, валин, изолейцин, лейцин Оксимоноаминокарбоновые: серин, треонин Моноаминодикарбоновые: аспартат, глутамат,
- 11. Незаменимые аминокислоты — необходимые аминокислоты, которые не могут быть синтезированы в том или ином организме. Поэтому
- 12. Содержание самых важных аминокислот: триптофана, метионина и лизина в некоторых продуктах, наиболее близкое к идеальному составу:
- 13. Незаменимые кислоты содержатся в следующих продуктах: Валин – в зерновых, грибах, мясе, молочных продуктах, сое, арахисе.
- 14. 2. Получение аминокислот.
- 15. 1. Замещение галогена на аминогруппу в соответствующих галогензамещенных кислотах:
- 16. 2. Присоединение аммиака к α-, β-непредельным кислотам с образованием β-аминокислот: CH2=CH–COOH + NH3 → H2N–CH2–CH2–COOH.
- 17. 3. Восстановление нитрозамещенных карбоновых кислот (применяется обычно для получения ароматических аминокислот): O2N–C6H4–COOH + 3H2 → H2N–C6H4–COOH
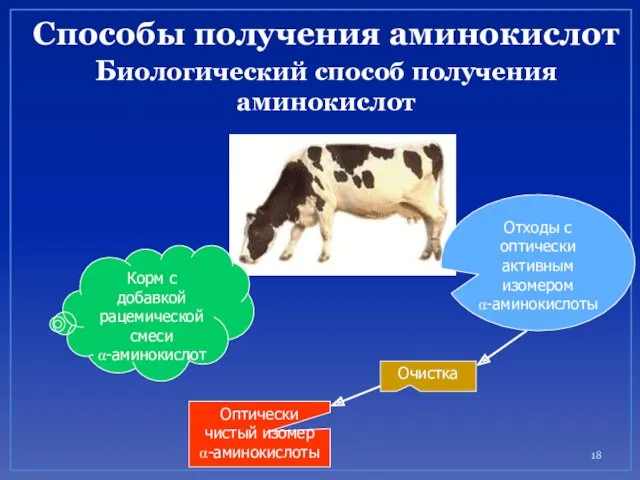
- 18. Способы получения аминокислот Биологический способ получения аминокислот Корм с добавкой рацемической смеси α-аминокислот Отходы с оптически
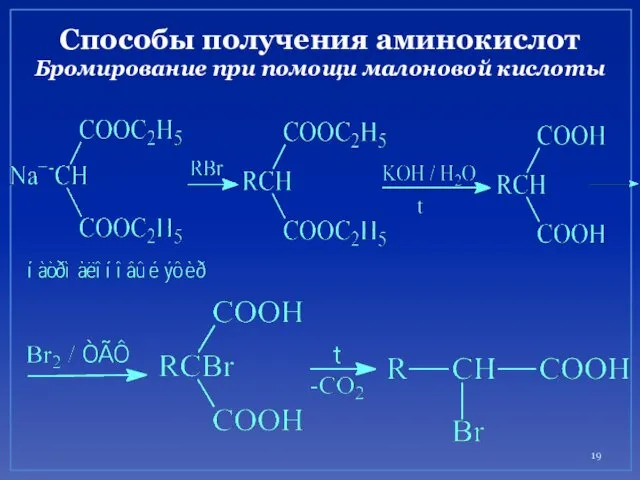
- 19. Способы получения аминокислот Бромирование при помощи малоновой кислоты
- 20. 3.Аминокислоты и их свойства.
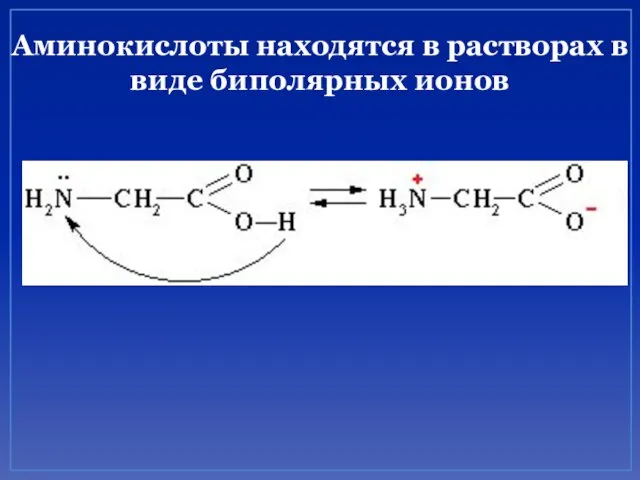
- 21. Аминокислоты находятся в растворах в виде биполярных ионов
- 22. Изменение суммарного заряда аминокислот в зависимость от рН среды
- 23. Аминокислоты проявляют свойства оснований за счет аминогруппы и свойства кислот за счет карбоксильной группы, т. е.
- 24. Межмолекулярное взаимодействие α-аминокислот приводит к образованию пептидов.
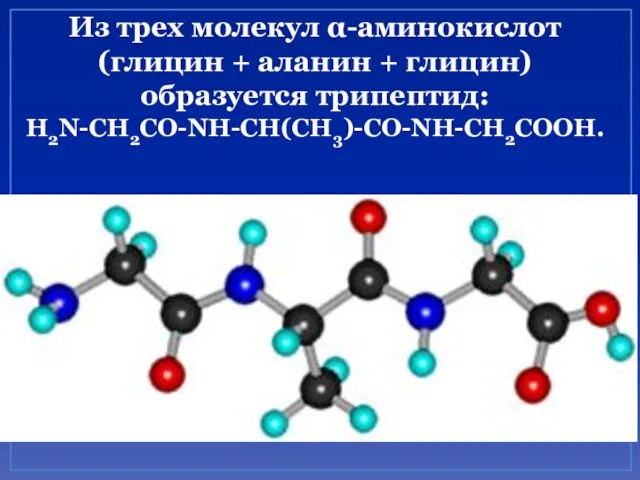
- 25. Из трех молекул α-аминокислот (глицин + аланин + глицин) образуется трипептид: H2N-CH2CO-NH-CH(CH3)-CO-NH-CH2COOH.
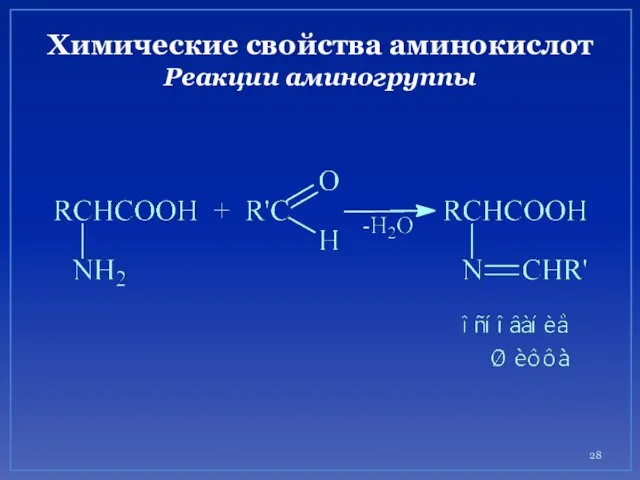
- 26. Реакции, обусловленные аминогруппой
- 27. Химические свойства аминокислот Реакции аминогруппы Метод Ван-Слайка
- 28. Химические свойства аминокислот Реакции аминогруппы
- 29. Реакции, обусловленные карбоксильной группой
- 30. Реакции декарбоксилирования Декарбоксилирование α-аминокислот, содержащих в качестве заместителя +NH3-группу, приводит к образованию биогенных аминов. В живом
- 31. Химические свойства аминокислот Реакции карбоксильной группы
- 32. Образование комплексов с металлами
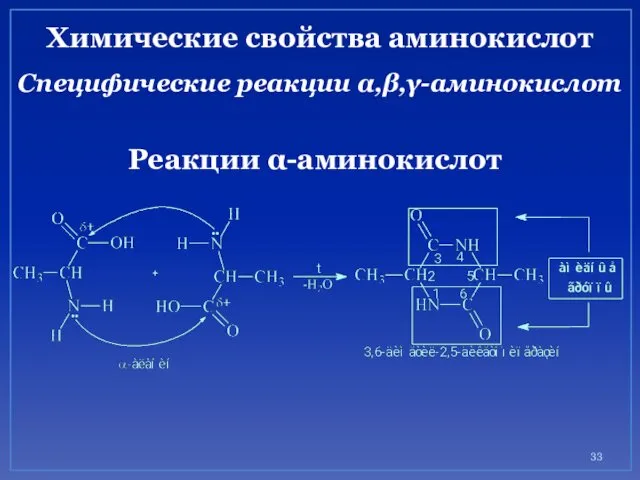
- 33. Химические свойства аминокислот Специфические реакции α,β,γ-аминокислот Реакции α-аминокислот
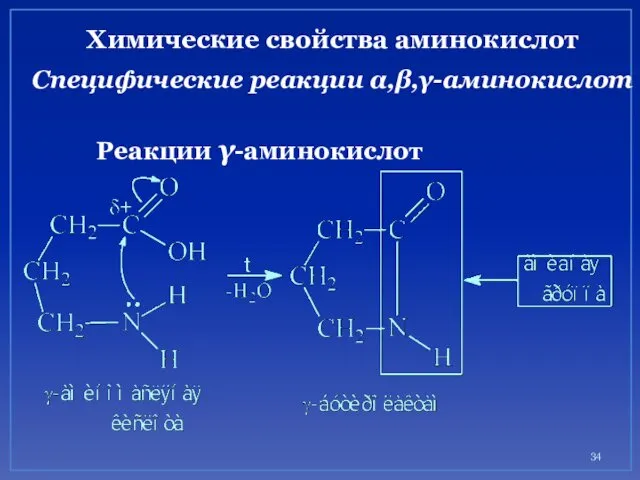
- 34. Химические свойства аминокислот Специфические реакции α,β,γ-аминокислот Реакции γ-аминокислот
- 35. Действие азотистой кислоты Образование гидроксикислот:
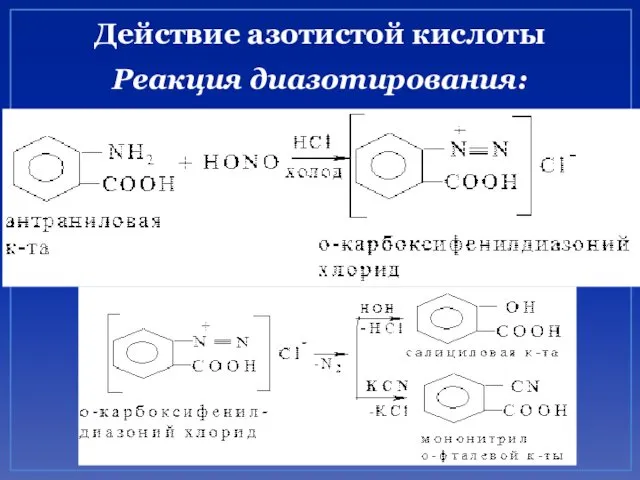
- 36. Действие азотистой кислоты Реакция диазотирования:
- 37. ЛЕКЦИЯ Пептиды и белки
- 38. Белки (полипептиды) – биополимеры, построенные из остатков α-аминокислот, соединенных пептидными (амидными) связями.
- 39. Пептиды и белки ПОСЛЕДОВАТЕЛЬНОЕ СОЕДИНЕНИЕ АМИНОКИСЛОТ
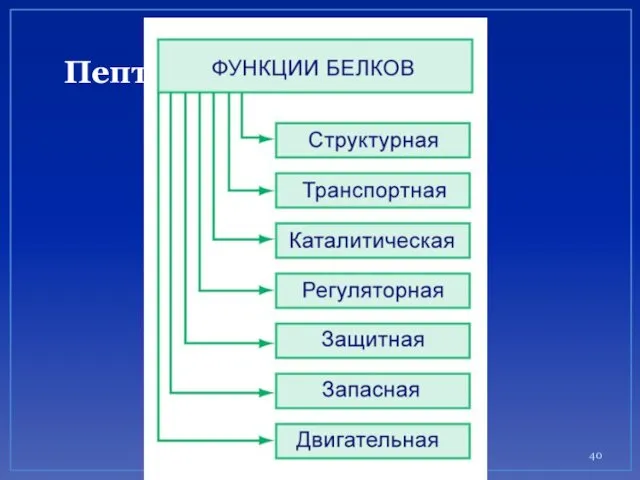
- 40. Пептиды и белки
- 41. Выделяют четыре уровня структурной организации белков. Первичная структура Вторичная структура Третичная структура Четвертичная структура
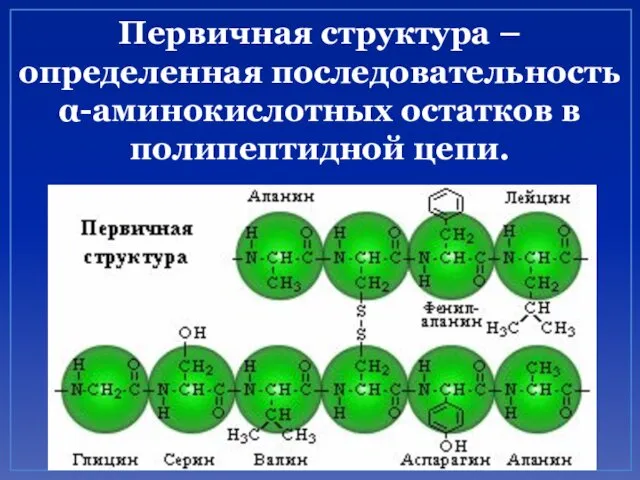
- 42. Первичная структура – определенная последовательность α-аминокислотных остатков в полипептидной цепи.
- 43. Пептиды и белки Первичная структура белка инсулина.
- 44. Вторичная структура – конформация полипептидной цепи, закрепленная множеством водородных связей между группамиN–H и С=О. Одна из
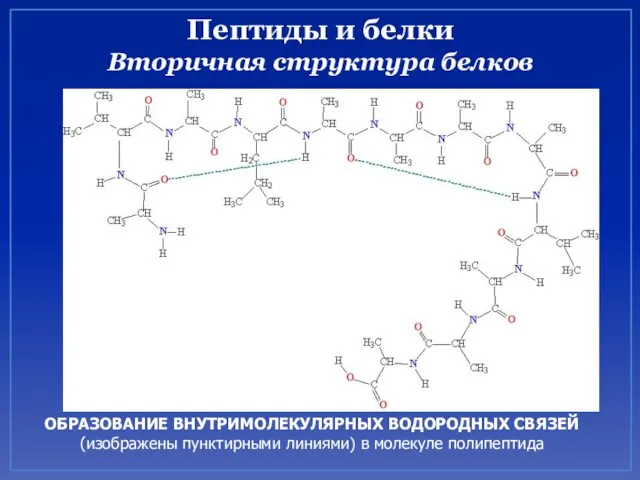
- 45. Пептиды и белки Вторичная структура белков ОБРАЗОВАНИЕ ВНУТРИМОЛЕКУЛЯРНЫХ ВОДОРОДНЫХ СВЯЗЕЙ (изображены пунктирными линиями) в молекуле полипептида
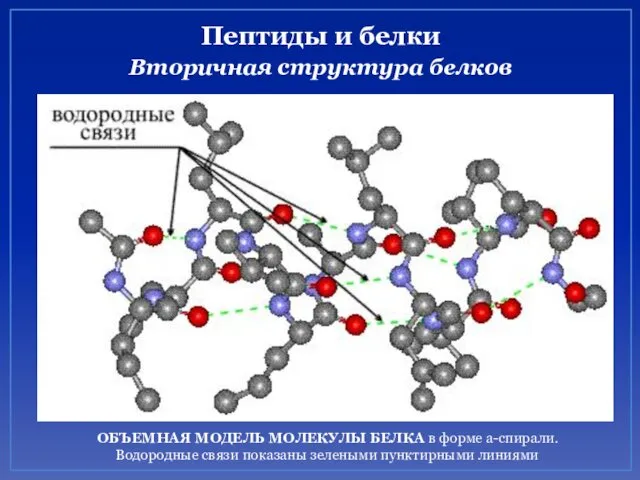
- 46. Пептиды и белки Вторичная структура белков ОБЪЕМНАЯ МОДЕЛЬ МОЛЕКУЛЫ БЕЛКА в форме a-спирали. Водородные связи показаны
- 47. Пептиды и белки Вторичная структура белков α-спираль молекулы белка
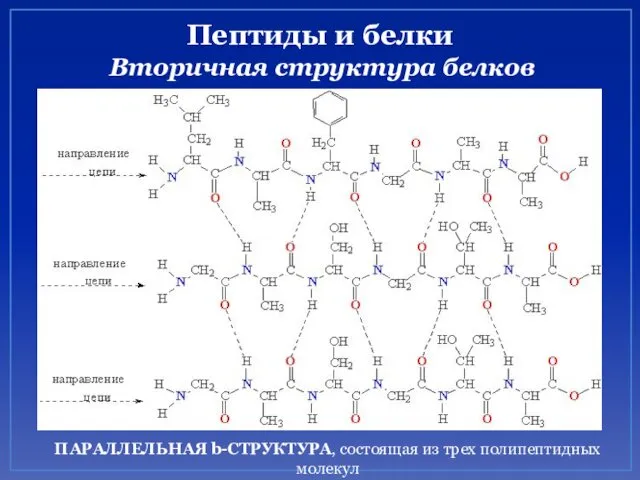
- 48. Пептиды и белки Вторичная структура белков ПАРАЛЛЕЛЬНАЯ b-СТРУКТУРА, состоящая из трех полипептидных молекул
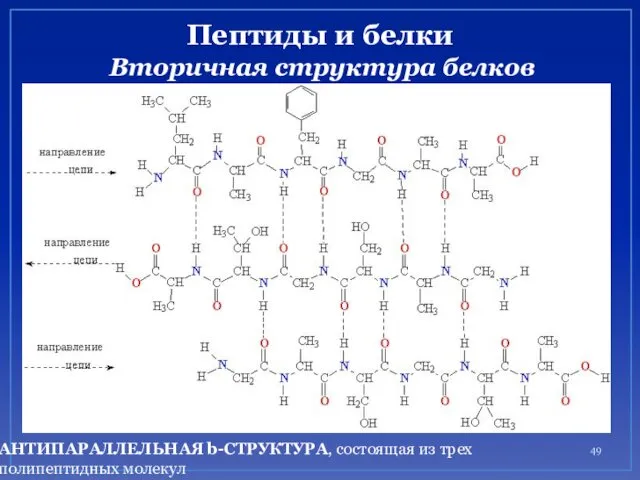
- 49. Пептиды и белки Вторичная структура белков АНТИПАРАЛЛЕЛЬНАЯ b-СТРУКТУРА, состоящая из трех полипептидных молекул
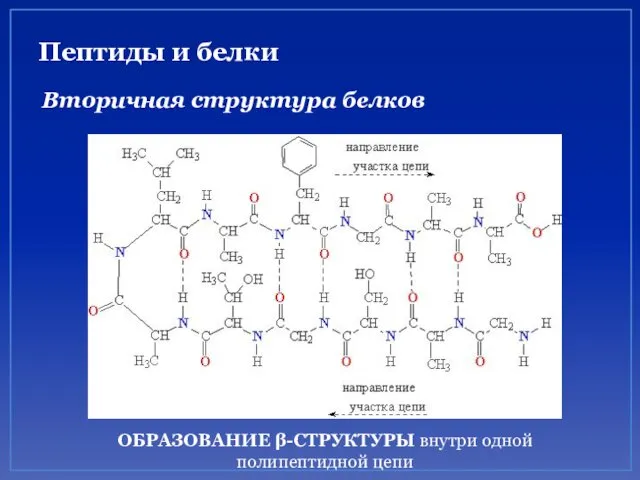
- 50. Пептиды и белки Вторичная структура белков ОБРАЗОВАНИЕ β-СТРУКТУРЫ внутри одной полипептидной цепи
- 51. Пептиды и белки Вторичная структура белков β-структура белка
- 52. Третичная структура – форма закрученной спирали в пространстве, образованная главным образом за счет дисульфидных мостиков –S–S–,
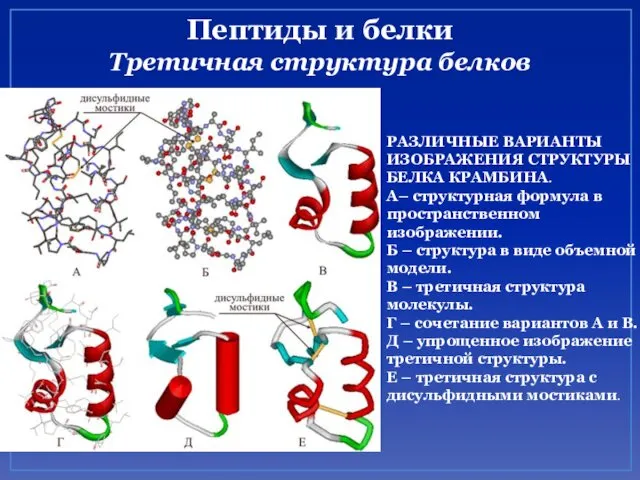
- 53. Пептиды и белки Третичная структура белков РАЗЛИЧНЫЕ ВАРИАНТЫ ИЗОБРАЖЕНИЯ СТРУКТУРЫ БЕЛКА КРАМБИНА. А– структурная формула в
- 54. Пептиды и белки Глобулярные белки ГЛОБУЛЯРНАЯ СТРУКТУРА АЛЬБУМИНА (белок куриного яйца). В структуре помимо дисульфидных мостиков
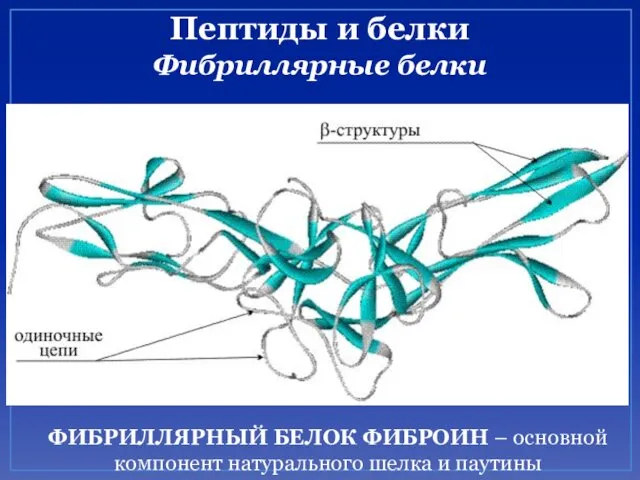
- 55. Пептиды и белки Фибриллярные белки ФИБРИЛЛЯРНЫЙ БЕЛОК ФИБРОИН – основной компонент натурального шелка и паутины
- 56. Четвертичная структура – агрегаты нескольких белковых макромолекул (белковые комплексы), образованные за счет взаимодействия разных полипептидных цепей.
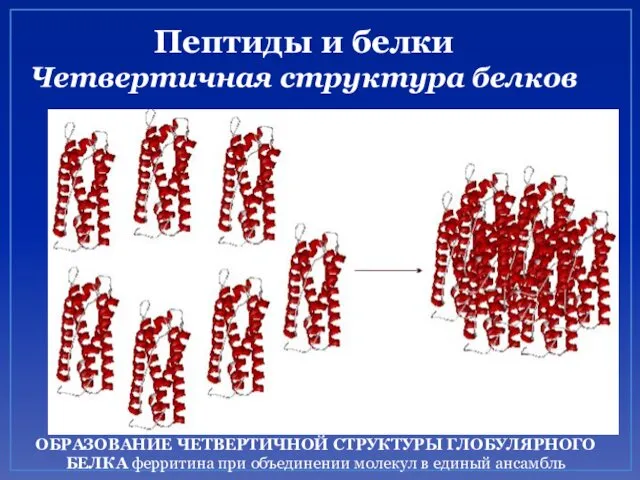
- 57. Пептиды и белки Четвертичная структура белков ОБРАЗОВАНИЕ ЧЕТВЕРТИЧНОЙ СТРУКТУРЫ ГЛОБУЛЯРНОГО БЕЛКА ферритина при объединении молекул в
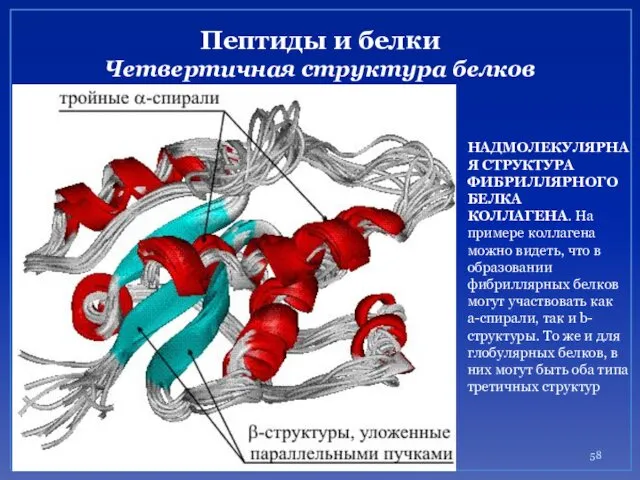
- 58. Пептиды и белки Четвертичная структура белков НАДМОЛЕКУЛЯРНАЯ СТРУКТУРА ФИБРИЛЛЯРНОГО БЕЛКА КОЛЛАГЕНА. На примере коллагена можно видеть,
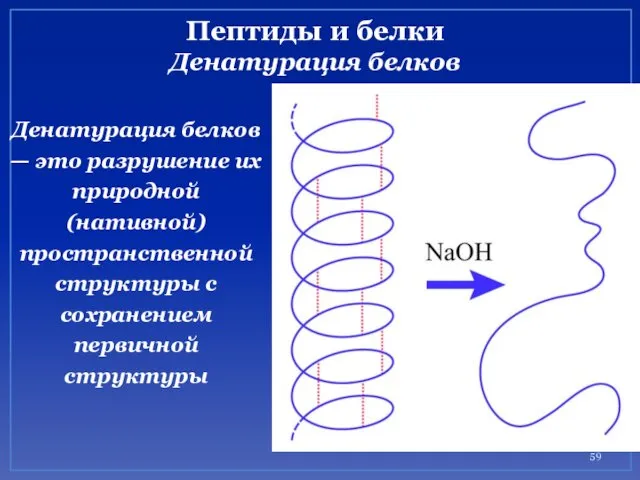
- 59. Пептиды и белки Денатурация белков Денатурация белков — это разрушение их природной (нативной) пространственной структуры с
- 60. Цветные реакции белков Качественные реакции на остатки аминокислот
- 61. Указатель реакций Биуретовая Уравнение реакции Проведение опыта Нингидриновая Ксантопротеиновая Уравнение реакции Проведение опыта Миллона Гопкинса-Коле Диазореакция
- 62. Функция качественных реакций Для аминокислот, постоянно встречающихся в составе белков, разработано множество цветных (в том числе
- 63. Биуретовая реакция Определяет наличие пептидной связи в растворе исследуемого соединения. пептидная связь
- 64. Биуретовая реакция Реакция обусловлена образованием биуретового комплекса в результате соединения меди с пептидной группировкой белка. В
- 65. Биуретовая реакция Биуретовая реакция протекает так: +CuSO4 +NaOH
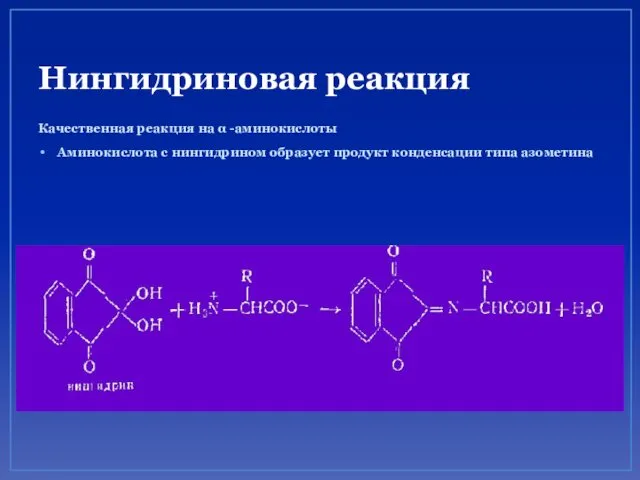
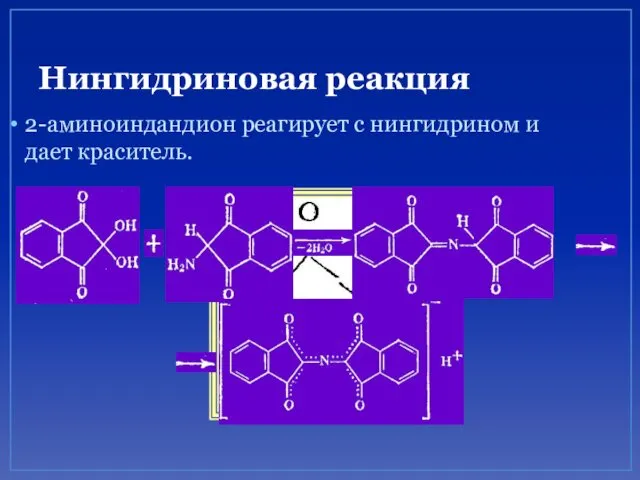
- 66. Нингидриновая реакция Качественная реакция на α -аминокислоты Аминокислота с нингидрином образует продукт конденсации типа азометина
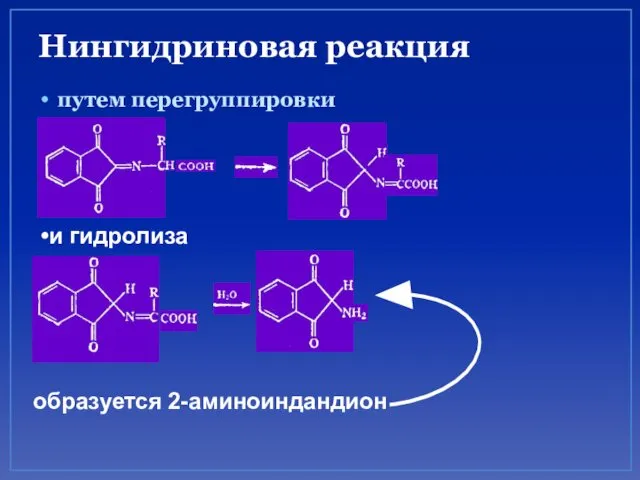
- 67. Нингидриновая реакция путем перегруппировки и гидролиза образуется 2-аминоиндандион
- 68. Нингидриновая реакция 2-аминоиндандион реагирует с нингидрином и дает краситель.
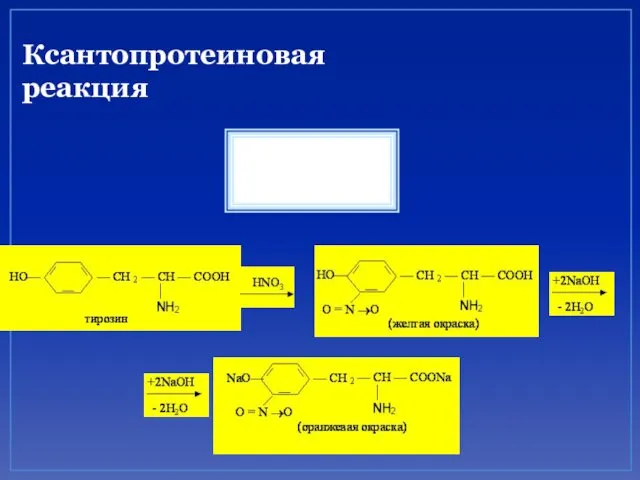
- 69. Ксантопротеиновая реакция Определяет присутствие в белке ароматических и гетероциклических α - аминокислот : триптофана, фенилаланина, тирозина,
- 70. Ксантопротеиновая реакция +HNO3
- 71. Реакция Миллона Это реакция на аминокислоту тирозин
- 72. Реакция Миллона Реактив Миллона (раствор HgNO3 и Hg(NO2)2 в разбавленной HNO3, содержащей примесь HNO2) взаимодействует с
- 73. Рекомендации к проведению опыта К 2 мл концентрированного раствора тирозина прибавляют ~1 мл реактива Миллона встряхивают
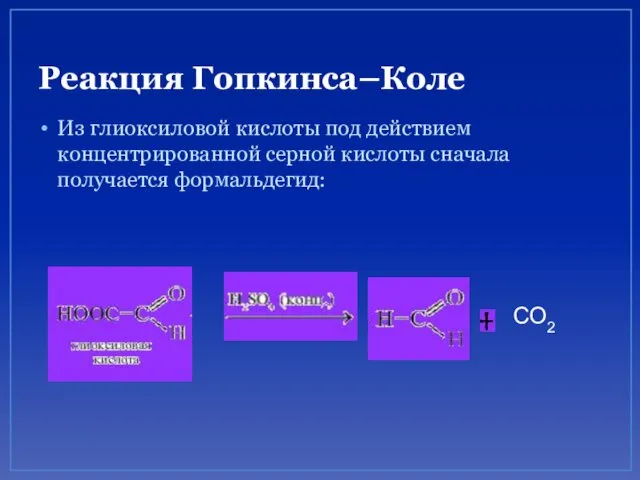
- 74. Реакция Гопкинса–Коле Эта реакция определяет аминокислоту триптофан.
- 75. Реакция Гопкинса–Коле Из глиоксиловой кислоты под действием концентрированной серной кислоты сначала получается формальдегид: СО2
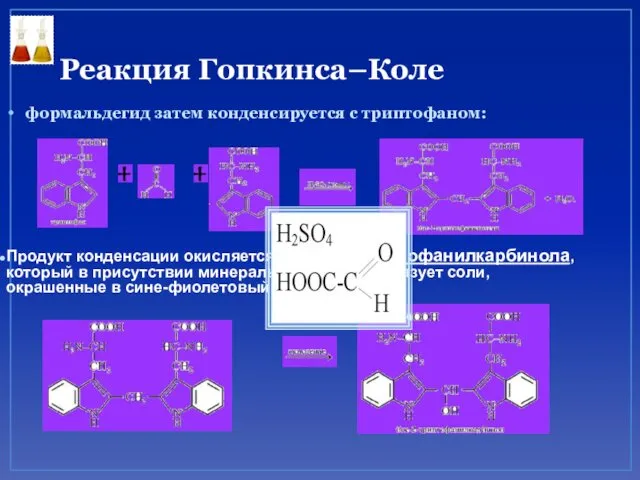
- 76. Реакция Гопкинса–Коле формальдегид затем конденсируется с триптофаном: Продукт конденсации окисляется до бис-2-триптофанилкарбинола, который в присутствии минеральных
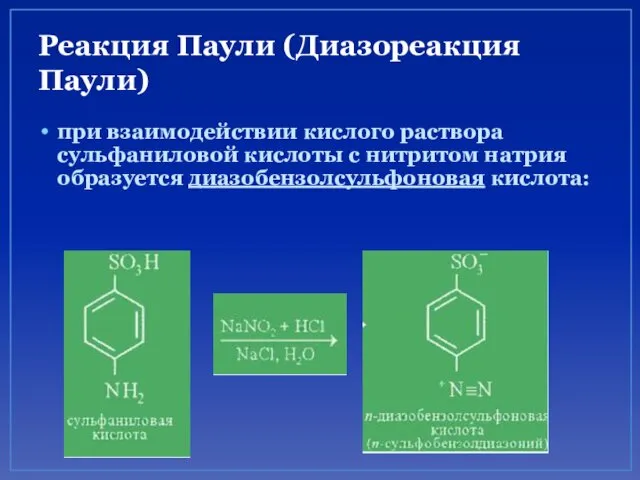
- 77. Реакция Паули (Диазореакция Паули) Эта реакция аминокислоту гистидин.
- 78. Реакция Паули (Диазореакция Паули) при взаимодействии кислого раствора сульфаниловой кислоты с нитритом натрия образуется диазобензолсульфоновая кислота:
- 80. Скачать презентацию
















































 Сестринский процесс при хроническом энтероколите
Сестринский процесс при хроническом энтероколите Методы синтеза и анализа цифровых фильтров. Введение
Методы синтеза и анализа цифровых фильтров. Введение Systemy transportowe – transport globalny
Systemy transportowe – transport globalny Колонизация Сибири русским народом
Колонизация Сибири русским народом Дедуктивные выводы из сложных суждений. Логика
Дедуктивные выводы из сложных суждений. Логика Михаил Васильевич Ломоносов
Михаил Васильевич Ломоносов Вербальная модель в сервисе
Вербальная модель в сервисе Глаз, как оптическая система
Глаз, как оптическая система 2015.03.20.Open house.Odesa.Application
2015.03.20.Open house.Odesa.Application Паровой двигатель
Паровой двигатель Организация объединенных наций (ООН)
Организация объединенных наций (ООН) Пластиковый Апокалипсис
Пластиковый Апокалипсис Развитие коммуникативных игр
Развитие коммуникативных игр Мини Мастер конструктор керамический Печь для итальянской пиццы, как настоящий, 1 : 10
Мини Мастер конструктор керамический Печь для итальянской пиццы, как настоящий, 1 : 10 Литосфера. Основные особенности литосферы. Влияние деятельности человека
Литосфера. Основные особенности литосферы. Влияние деятельности человека Дикорастущие плодовые и орехоплодные растения разных типов леса, их запасы и заготовка
Дикорастущие плодовые и орехоплодные растения разных типов леса, их запасы и заготовка Стипендия. Виды стипендий
Стипендия. Виды стипендий Классификация извещателей пожарных (ИП)
Классификация извещателей пожарных (ИП) Манометры и гидравлическое оборудование
Манометры и гидравлическое оборудование Презентация Стихийные бедствия 2 часть
Презентация Стихийные бедствия 2 часть Числа 3 и 8 (1 класс)
Числа 3 и 8 (1 класс) Увольнение с военной службы
Увольнение с военной службы Интерактивный тренажер Процент от числа
Интерактивный тренажер Процент от числа Материалы и изделия из древесины. Тема 2
Материалы и изделия из древесины. Тема 2 Кишечный шов
Кишечный шов Мотивация учения- основное условие успешного обучения Выступление на педсовете
Мотивация учения- основное условие успешного обучения Выступление на педсовете Салтыков – Щедрин История одного города
Салтыков – Щедрин История одного города Строительство высокоскоростной магистрали ВСМ-2 Москва-Казань
Строительство высокоскоростной магистрали ВСМ-2 Москва-Казань