Содержание
- 2. 1.СОДЕРЖАНИЕ БЕЛКОВ В МЕМБРАНЕ 2. КЛАССИФИКАЦИЯ МЕМБРАННЫХ БЕЛКОВ 3. ПОДВИЖНОСТЬ БЕЛКОВ В МЕМБРАНЕ 4. БЕЛОК –
- 3. СОДЕРЖАНИЕ БЕЛКОВ В МЕМБРАНАХ МЕМБРАНЫ СОДЕРЖАТ ОТ 20 ДО 80% БЕЛКА ПО ВЕСУ. В РАЗНЫХ МЕМБРАНАХ
- 4. КЛАССИФИКАЦИЯ МЕМБРАННЫХ БЕЛКОВ основана на прочности взаимодействия белка с мембраной Топологическая классификация Биохимическая классификация основана на
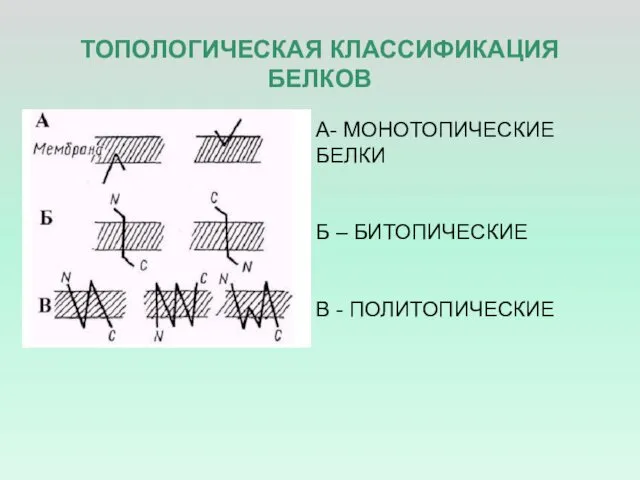
- 5. ТОПОЛОГИЧЕСКАЯ КЛАССИФИКАЦИЯ БЕЛКОВ А- МОНОТОПИЧЕСКИЕ БЕЛКИ Б – БИТОПИЧЕСКИЕ В - ПОЛИТОПИЧЕСКИЕ
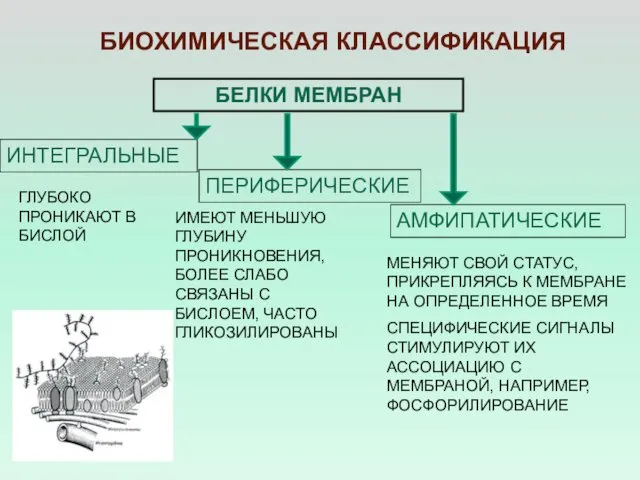
- 6. БЕЛКИ МЕМБРАН ИНТЕГРАЛЬНЫЕ ПЕРИФЕРИЧЕСКИЕ БИОХИМИЧЕСКАЯ КЛАССИФИКАЦИЯ МЕНЯЮТ СВОЙ СТАТУС, ПРИКРЕПЛЯЯСЬ К МЕМБРАНЕ НА ОПРЕДЕЛЕННОЕ ВРЕМЯ СПЕЦИФИЧЕСКИЕ
- 7. ДЕЛЕНИЕ БЕЛКОВ НА ИНТЕГРАЛЬНЫЕ И ПЕРИФЕРИЧЕСКИЕ ОПРЕДЕЛЯЕТСЯ СТРУКТУРОЙ КОЛИЧЕСТВОМ И РАСПОЛОЖЕНИЕ ГИДРОФОБНЫХ ОСТАТКОВ
- 8. МЕМБРАННЫЕ БЕЛКИ СОСТОЯТ ИЗ ДВУХ ЧАСТЕЙ: УЧАСТКИ, БОГАТЫЕ ПОЛЯРНЫМИ АМИНОКИСЛОТНЫМИ ОСТАТКАМИ, ОБРАЩЕННЫЕ ВО ВНЕКЛЕТОЧНУЮ СРЕДУ ЧАСТО
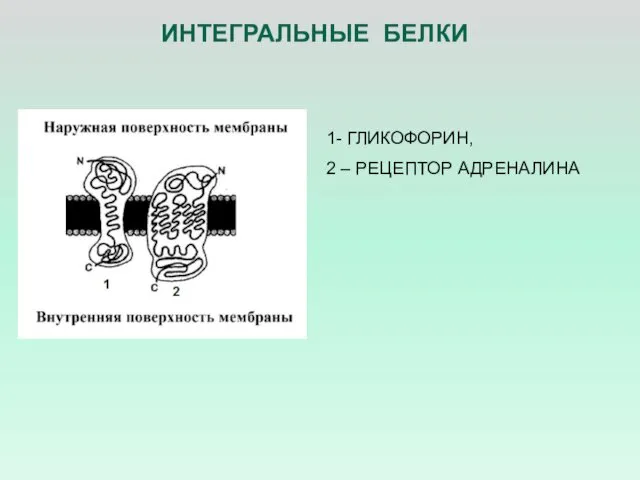
- 9. ИНТЕГРАЛЬНЫЕ БЕЛКИ 1- ГЛИКОФОРИН, 2 – РЕЦЕПТОР АДРЕНАЛИНА
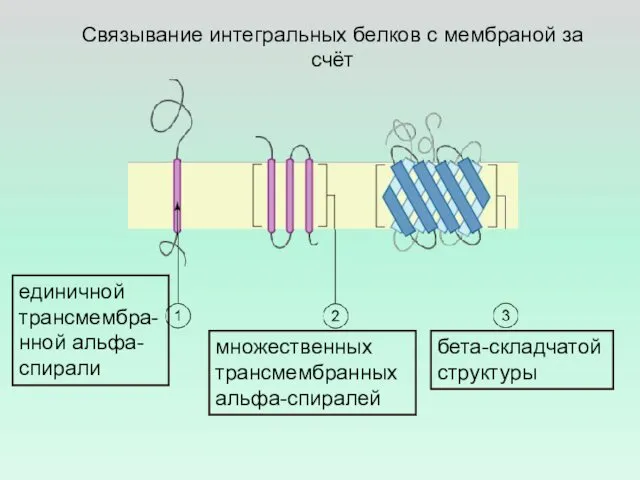
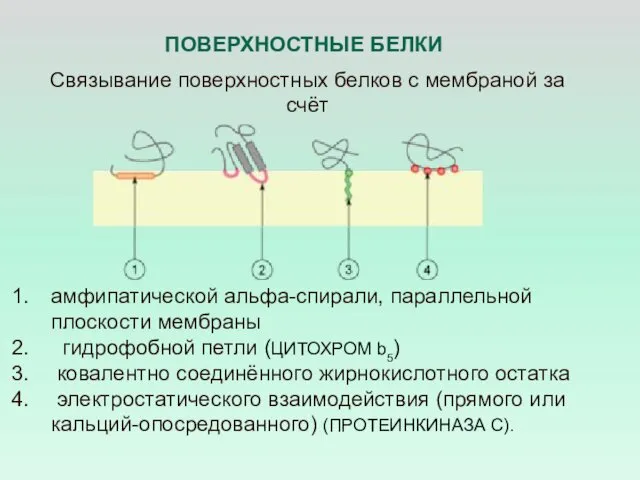
- 10. Связывание интегральных белков с мембраной за счёт единичной трансмембра-нной альфа-спирали множественных трансмембранных альфа-спиралей бета-складчатой структуры
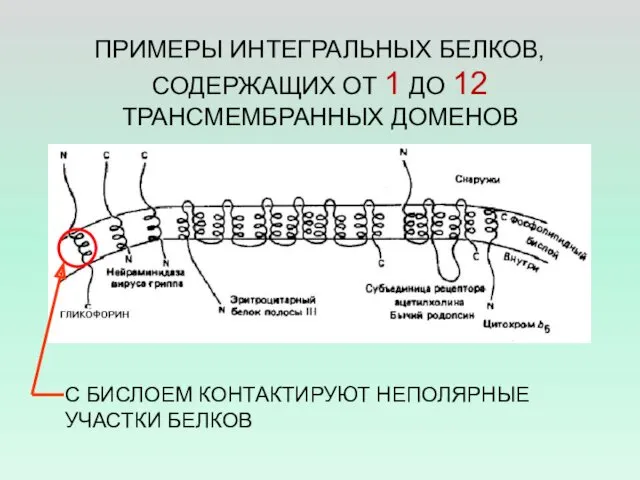
- 11. ПРИМЕРЫ ИНТЕГРАЛЬНЫХ БЕЛКОВ, СОДЕРЖАЩИХ ОТ 1 ДО 12 ТРАНСМЕМБРАННЫХ ДОМЕНОВ С БИСЛОЕМ КОНТАКТИРУЮТ НЕПОЛЯРНЫЕ УЧАСТКИ БЕЛКОВ
- 12. 1. КОЛИЧЕСТВО ГИДРОФИЛЬНЫХ АМИНОКИСЛОТ ПРИМЕРНО ТАКОЕ ЖЕ, КАК И В ОБЫЧНЫХ ВОДОРАСТВОРИМЫХ БЕЛКАХ, НО В ВОДЕ
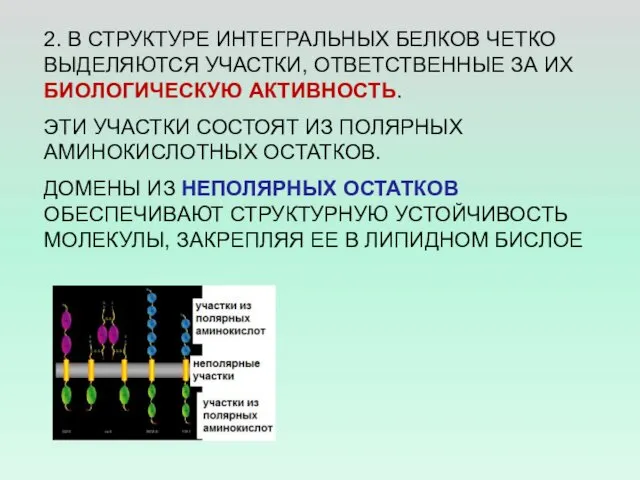
- 13. 2. В СТРУКТУРЕ ИНТЕГРАЛЬНЫХ БЕЛКОВ ЧЕТКО ВЫДЕЛЯЮТСЯ УЧАСТКИ, ОТВЕТСТВЕННЫЕ ЗА ИХ БИОЛОГИЧЕСКУЮ АКТИВНОСТЬ. ЭТИ УЧАСТКИ СОСТОЯТ
- 14. амфипатической альфа-спирали, параллельной плоскости мембраны гидрофобной петли (ЦИТОХРОМ b5) ковалентно соединённого жирнокислотного остатка электростатического взаимодействия (прямого
- 15. 5 – БЕЛКИ, СВЯЗАННЫЕ С ИНТЕГРАЛЬНЫМИ БЕЛКАМИ,
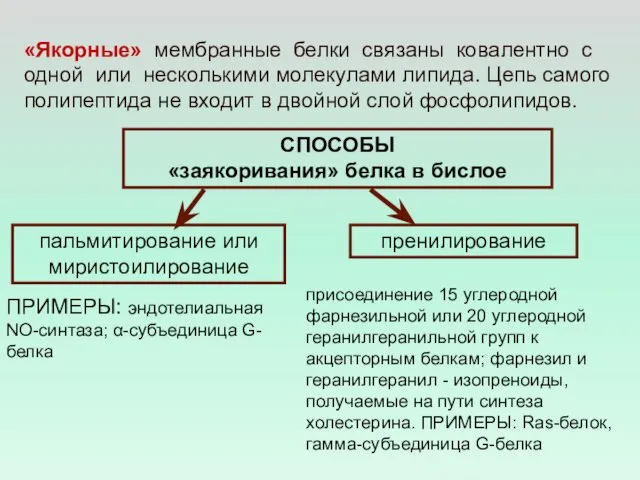
- 16. «Якорные» мембранные белки связаны ковалентно с одной или несколькими молекулами липида. Цепь самого полипептида не входит
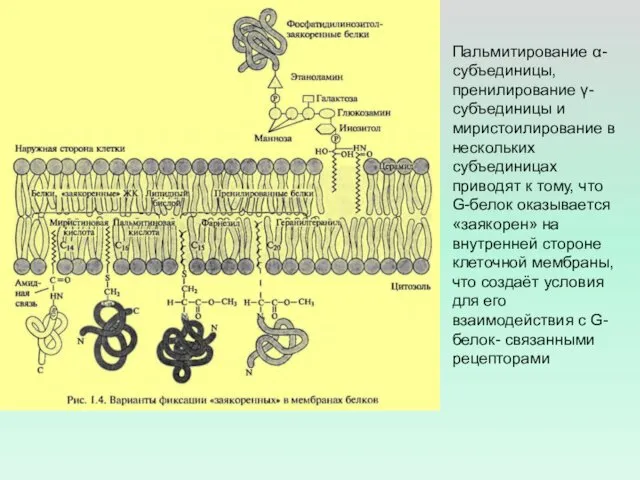
- 17. Пальмитирование α-субъединицы, пренилирование γ-субъединицы и миристоилирование в нескольких субъединицах приводят к тому, что G-белок оказывается «заякорен»
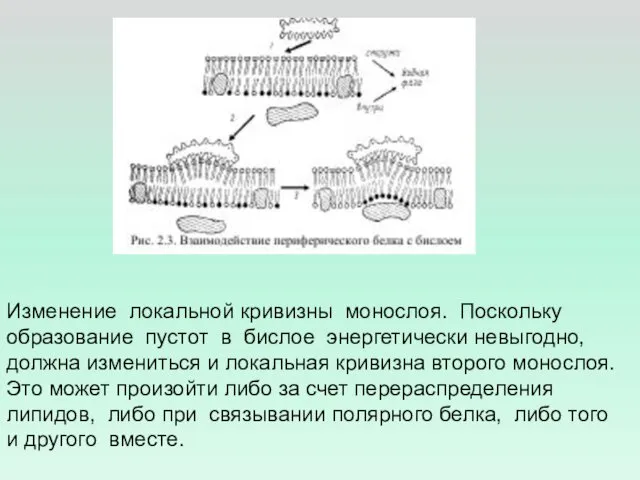
- 18. Изменение локальной кривизны монослоя. Поскольку образование пустот в бислое энергетически невыгодно, должна измениться и локальная кривизна
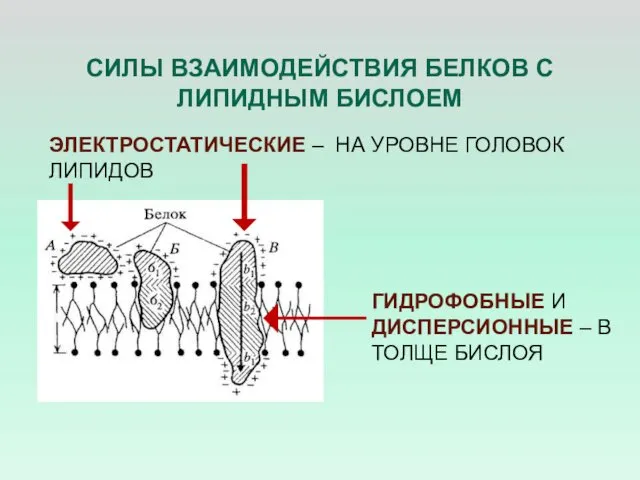
- 19. СИЛЫ ВЗАИМОДЕЙСТВИЯ БЕЛКОВ С ЛИПИДНЫМ БИСЛОЕМ ЭЛЕКТРОСТАТИЧЕСКИЕ – НА УРОВНЕ ГОЛОВОК ЛИПИДОВ ГИДРОФОБНЫЕ И ДИСПЕРСИОННЫЕ –
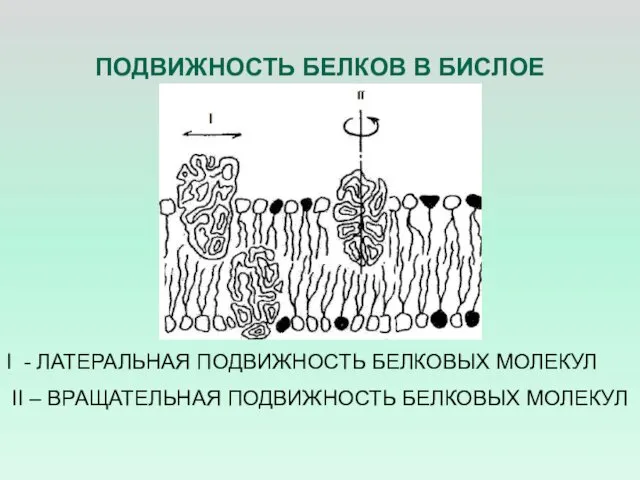
- 20. ПОДВИЖНОСТЬ БЕЛКОВ В БИСЛОЕ I - ЛАТЕРАЛЬНАЯ ПОДВИЖНОСТЬ БЕЛКОВЫХ МОЛЕКУЛ II – ВРАЩАТЕЛЬНАЯ ПОДВИЖНОСТЬ БЕЛКОВЫХ МОЛЕКУЛ
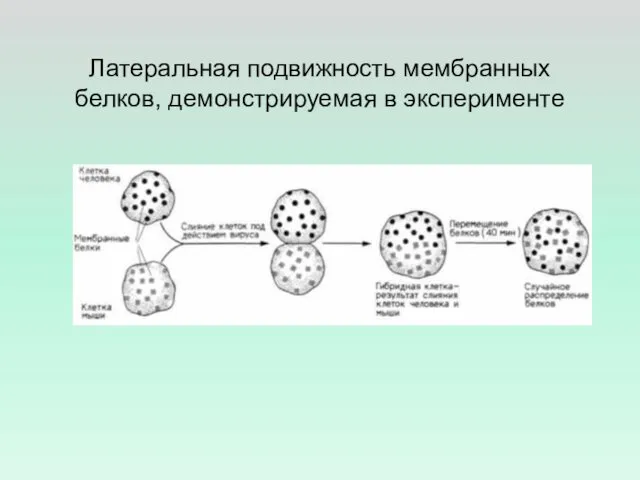
- 21. Латеральная подвижность мембранных белков, демонстрируемая в эксперименте
- 22. ПОДВИЖНОСТЬ БЕЛКОВ В БИСЛОЕ И ИХ ВЛИЯНИЕ НА ЛИПИДЫ МЕМБРАН БОЛЕЕ ПОДВИЖНЫМИ ОКАЗЫВАЮТСЯ ПЕРИФЕРИЧЕСКИЕ БЕЛКИ. ОНИ
- 23. ЛАТЕРАЛЬНАЯ ДИФФУЗИЯ ИНТЕГРАЛЬНЫХ БЕЛКОВ ОГРАНИЧЕНА ИХ РАЗМЕРАМИ, ВЗАИМОДЕЙСТВИЕМ С ДРУГИМИ БЕЛКАМИ И ЭЛЕМЕНТАМИ ЦИТОСКЕЛЕТА Времена вращательной
- 24. ИНТЕГРАЛЬНЫЕ БЕЛКИ СИЛЬНО ОГРАНИЧИВАЮТ ПОДВИЖНОСТЬ АННУЛЯРНЫХ ЛИПИДОВ. ПО СВОЕЙ ПОДВИЖНОСТИ ОНИ ОТЛИЧАЮТСЯ ОТ ОБЩИХ ЛИПИДОВ: АННУЛЯРНЫЕ
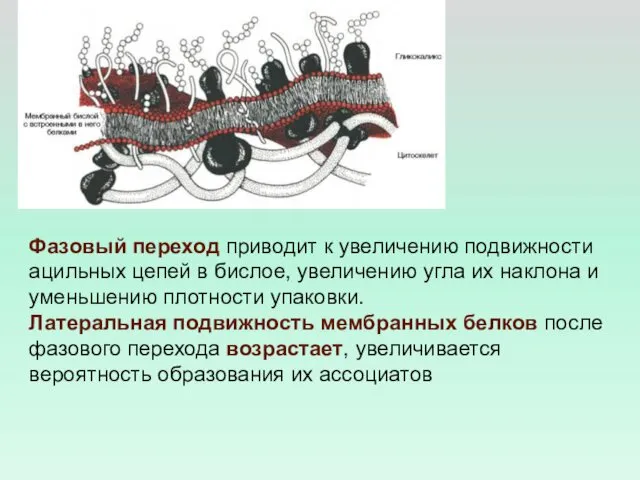
- 25. Фазовый переход приводит к увеличению подвижности ацильных цепей в бислое, увеличению угла их наклона и уменьшению
- 26. МОДИФИКАЦИЯ БИСЛОЯ БЕЛКАМИ ВЫДЕЛЯЮТ 4 ОСНОВНЫХ ТИПА БЕЛОК-ЛИПИДНЫХ КОНТАКТОВ
- 27. ЛОКАЛЬНОЕ ВОЗРАСТАНИЕ УПОРЯДОЧЕННОСТИ АННУЛЯРНЫХ ЛИПИДОВ ПРИМЕРЫ: бактериородопсин
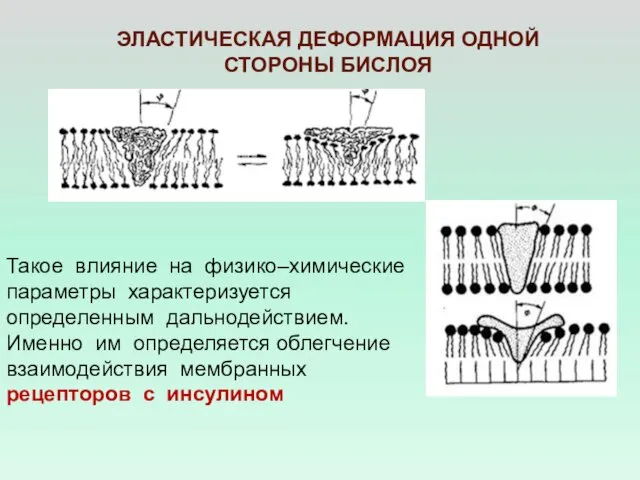
- 28. ЭЛАСТИЧЕСКАЯ ДЕФОРМАЦИЯ ОДНОЙ СТОРОНЫ БИСЛОЯ Такое влияние на физико–химические параметры характеризуется определенным дальнодействием. Именно им определяется
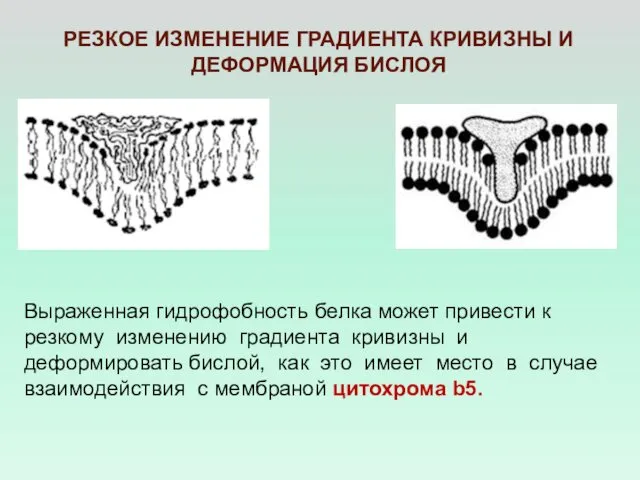
- 29. РЕЗКОЕ ИЗМЕНЕНИЕ ГРАДИЕНТА КРИВИЗНЫ И ДЕФОРМАЦИЯ БИСЛОЯ Выраженная гидрофобность белка может привести к резкому изменению градиента
- 30. ИЗМЕНЕНИЕ ГЕОМЕТРИИ БИСЛОЯ ВСЛЕДСТВИЕ НЕСОВПАДЕНИЯ ДЛИНЫ ГИДРОФОБНЫХ УЧАСТКОВ ЛИПИДНЫХ МОЛЕКУЛ И ВСТРАИВАЕМОГО БЕЛКА Сочетание гидрофильных и
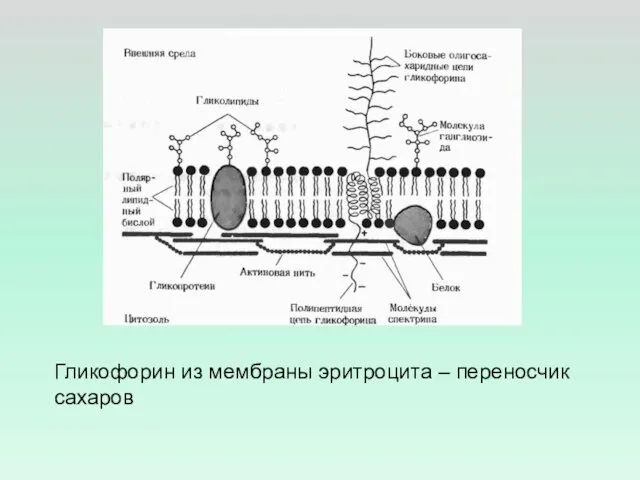
- 31. Гликофорин из мембраны эритроцита – переносчик сахаров
- 33. Скачать презентацию













 Использование мультимедийных технологий в работе учителя-логопеда
Использование мультимедийных технологий в работе учителя-логопеда Русское искусство в.п.18 века. Архитектура. Живопись. Скульптура
Русское искусство в.п.18 века. Архитектура. Живопись. Скульптура Технология. К урокам. Диск Диск Диск Диск Диск Диск
Технология. К урокам. Диск Диск Диск Диск Диск Диск Вычитание, умножение и деление рациональных чисел
Вычитание, умножение и деление рациональных чисел Основные законы в химии
Основные законы в химии Презентация конспекта урока по теме Мягкий знак vol.2
Презентация конспекта урока по теме Мягкий знак vol.2 Практическая работа Определение ГП реки, обозначение рек на контурной карте (6 кл.)
Практическая работа Определение ГП реки, обозначение рек на контурной карте (6 кл.) 20230921_urok_3.poschety_i_vychisleniya_v_tablitsah
20230921_urok_3.poschety_i_vychisleniya_v_tablitsah Презентация Климат и климатические ресурсы
Презентация Климат и климатические ресурсы Прокуратура Российской Федерации. Организационно-правовые основы деятельности прокуратуры
Прокуратура Российской Федерации. Организационно-правовые основы деятельности прокуратуры Как читать карту
Как читать карту Музыкальный инструмент - заместитель РУБЕЛЬ
Музыкальный инструмент - заместитель РУБЕЛЬ Симметрия многогранников
Симметрия многогранников Діни ағымдардың қоғамға кері әсері
Діни ағымдардың қоғамға кері әсері 10 социально-экономическое развитие страны в 1960-х – середине 1980-х гг
10 социально-экономическое развитие страны в 1960-х – середине 1980-х гг Библейские сказания. История Древнего мира
Библейские сказания. История Древнего мира Исследования на Международной космической станции
Исследования на Международной космической станции Схемо- и системотехника электронных средств
Схемо- и системотехника электронных средств Основные программные комплексы для создания геолого-геофизических моделей УВ сырья
Основные программные комплексы для создания геолого-геофизических моделей УВ сырья Обобщение знаний по теме Литосфера
Обобщение знаний по теме Литосфера Мистическое число 13
Мистическое число 13 Презентация к уроку химии в 8-м классе по теме Основания
Презентация к уроку химии в 8-м классе по теме Основания 20231011_oeni_-_konferentsiya_-_kopiya111
20231011_oeni_-_konferentsiya_-_kopiya111 Поняття про ораторську компетенцію
Поняття про ораторську компетенцію Напряженность электростатического поля
Напряженность электростатического поля Портрет в музыке и живописи
Портрет в музыке и живописи Молекулярная биология. Достижения, проблемы и перспективы. (Лекция 13-а)
Молекулярная биология. Достижения, проблемы и перспективы. (Лекция 13-а) Православная позиция
Православная позиция