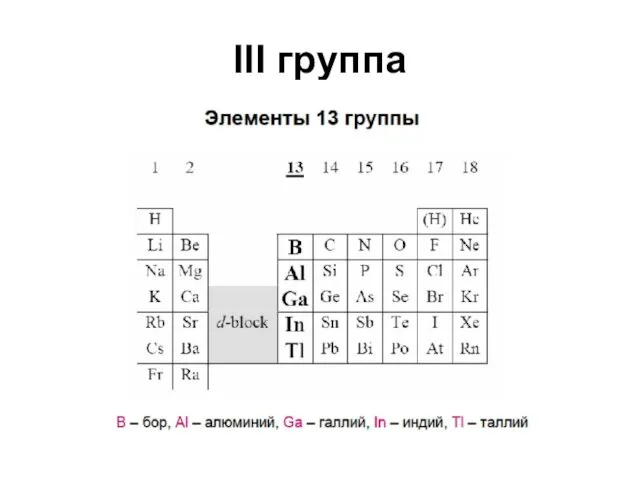
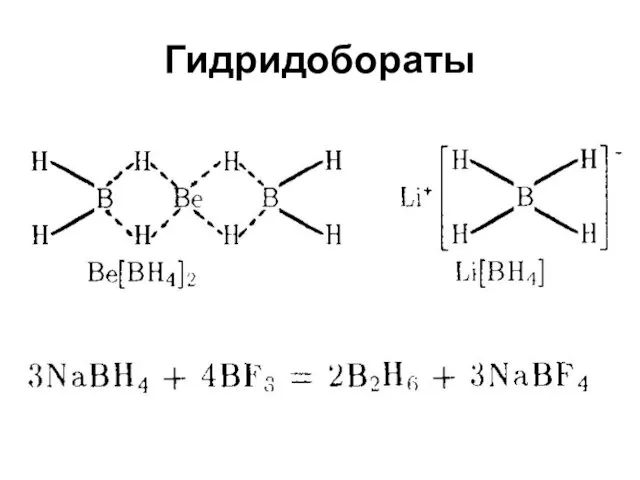
Слайд 2

Слайд 3

Слайд 4
Слайд 5

Слайд 6

Бор
Назвали в честь буры
В начале XIX века (1810...1815 гг.) этот элемент
называли на русский манер бурием и буротвором
В 1815 г. известный химик В.М. Севергин ввел в русскую научную литературу нынешнее имя элемента №5
Слайд 7

Бор
Известно > 80 минералов бора
Главные минералы бора:
бура Na2B4O7∙10H2О
кернит Na2B4O7∙4H2О
сассолин (борная кислота)
Слайд 8

Слайд 9

ПОЛУЧЕНИЕ
Аморфный бор выделяют металлотермически:
Na2B4O7 + 12 Na = 4 В +
7 Na2O
2 Na2B4O7 + 3 Na = В + 7 NaBO2
Слайд 10
Слайд 11

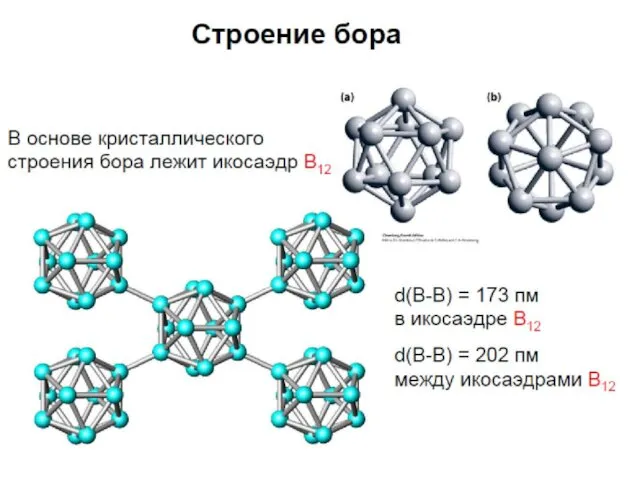
Модификации
Аморфный бор имеет вид коричневого порошка, кристаллический бор окрашен в серо-черный
цвет с металлическим блеском
По твердости В (крист) не уступает алмазу
Слайд 12

Слайд 13

Бор
Природный бор состоит только из двух изотопов
На долю легкого бора-10 в
природной смеси приходится около 19%, остальное – тяжелый бор-11 (эти цифры в разных изданиях несколько варьируются)
Слайд 14

Бор
По величине сечения захвата тепловых нейтронов легкий изотоп бора занимает одно
из первых мест среди всех элементов и изотопов, а тяжелый – одно из самых последних
Это значит, что материалы на основе обоих изотопов элемента №5 весьма интересны для реакторостроения
Слайд 15

Бор
Способностью бора активно захватывать нейтроны пользуются и для защиты от нейтронного
излучения
Широкое распространение получили борные счетчики нейтронов
Слайд 16
Слайд 17

Сходные физические и химические свойства:
B и Si
Слайд 18

Бор
Химически инертен
С кислородом при > 700оС (В2О3)
С водой не реагирует
С азотом
при > 1200оС (BN)
С водородом не реагирует
Слайд 19

Бор
Со фтором при комнатной температуре, с хлором при 400оС, с бромом
при 600оС
С концентрированной азотной кислотой, серной кислотой, царской водкой (окисляется до борной кислоты)
Слайд 20

Бор
При сильном нагревании взаимодействует с оксидами кремния, фосфора
3 SiO2 + 4
B → 2 B2O3 + 3 Si
Слайд 21

Слайд 22

Соединения
бора
(+3, редко отрицательные)
Слайд 23

Конкуренты алмаза
Карбид бора В4С –один из материалов для изготовления регулирующих стержней
По
твердости В4С и кристаллический бор (AlB12) уступают лишь углероду в виде алмаза
Слайд 24

Карбид бора
Карбид бора – полимер
Правильнее его формулу писать не В4С, а
(B12C3)n
Элементарная ячейка – ромбоэдрическая, ее каркас образуют 12 ковалентно связанных атомов бора, внутри этого каркаса располагается линейная группа из трех связанных между собой атомов углерода
Слайд 25

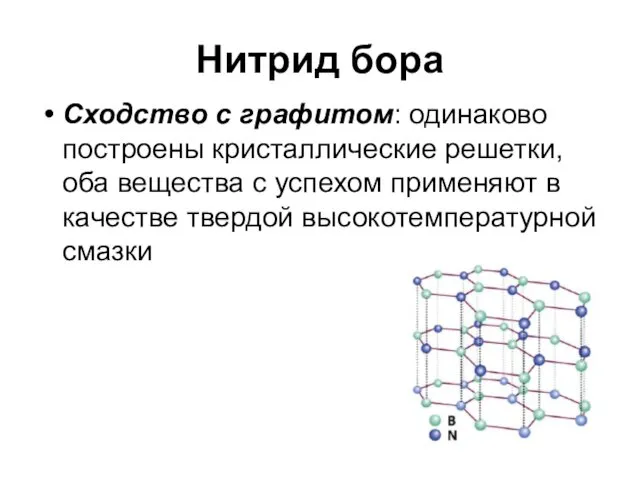
Нитрид бора
BN –иногда называют белым графитом
Получают, прокаливая технический бор или окись
бора в атмосфере аммиака
Белый, похожий внешне на тальк порошок (полимерное строение)
Слайд 26
Нитрид бора
Сходство с графитом: одинаково построены кристаллические решетки, оба вещества с
успехом применяют в качестве твердой высокотемпературной смазки
Слайд 27

Боразон
(кубический нитрид бора)
Получение из нитрида бора: температура 1350°C, давление 62
тыс. атм.
Неопределенного цвета кристаллы, царапают алмаз, нитрид бора
Слайд 28
Слайд 29

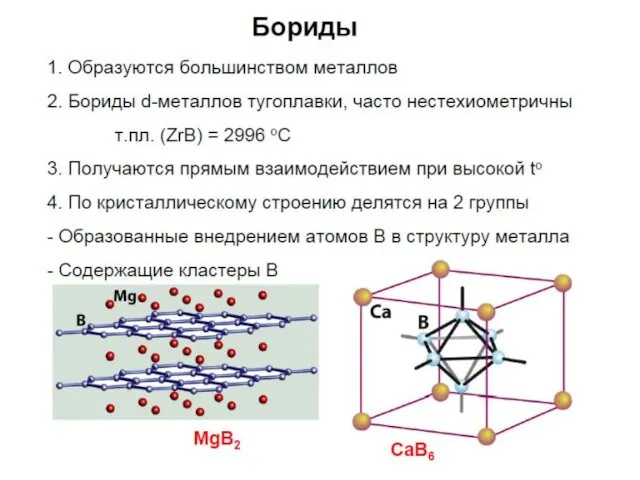
Бориды
Самый термостойкий – диборид гафния HfB2 (плавится при 3250°C)
«Рекордист» по химической
стойкости – диборид тантала TaB2 (на него не действуют никакие кислоты, даже кипящая царская водка)
Слайд 30

Бориды
Разлагаются под действием кислот с образованием бороводородов
Слайд 31

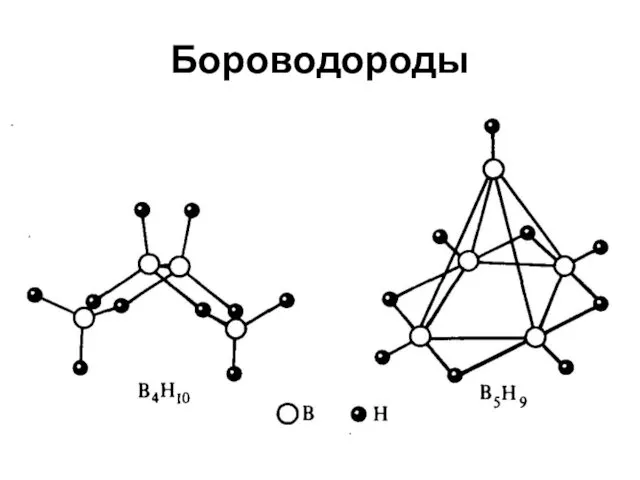
Бороводороды (бораны)
Нестойки, самовоспламеняются, ядовиты, скверно пахнут
B2H6, В4Н10, B5H9, В10Н14
Водородные
и мостиковые связи
Слайд 32
Слайд 33

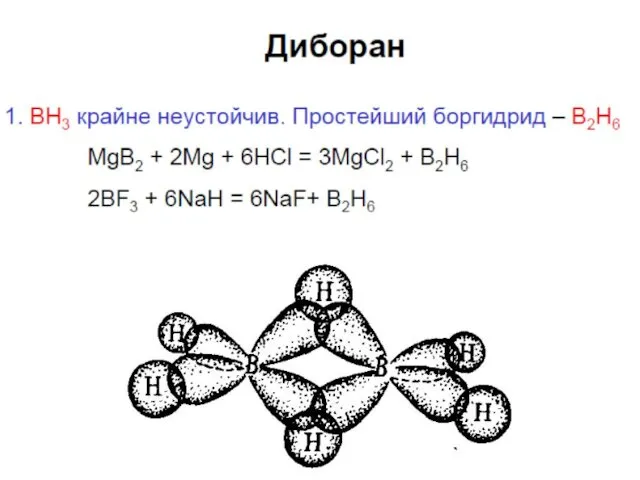
Диборан
В промышленности диборан получают
2 BF3 + 6 NaH → B2H6 +
6 NaF
В лабораторных условиях
4 BCl3 + 3 LiAlH4 → 2 B2H6 + 3 LiAlCl4
4 BF3 + 3 NaBH4 → 2 B2H6 + 3 NaBF4
Слайд 34
Слайд 35
Слайд 36

Диборан
Бораны разлагаются водой, спиртами и щелочами с выделением водорода
B2Н6 + 6
H2О → 2 H3BO3 + 6 H2
Слайд 37
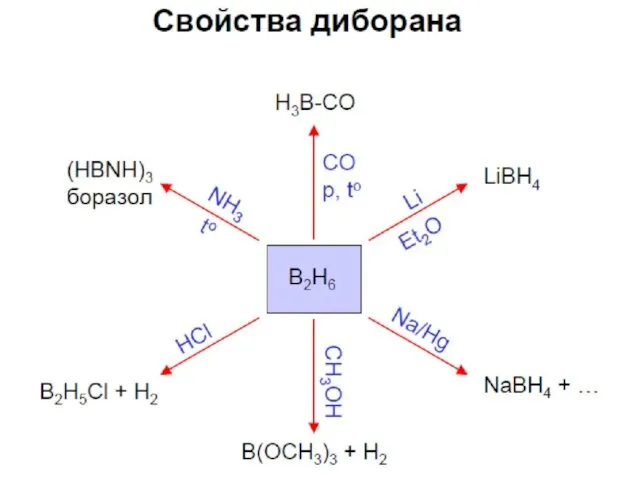
Слайд 38
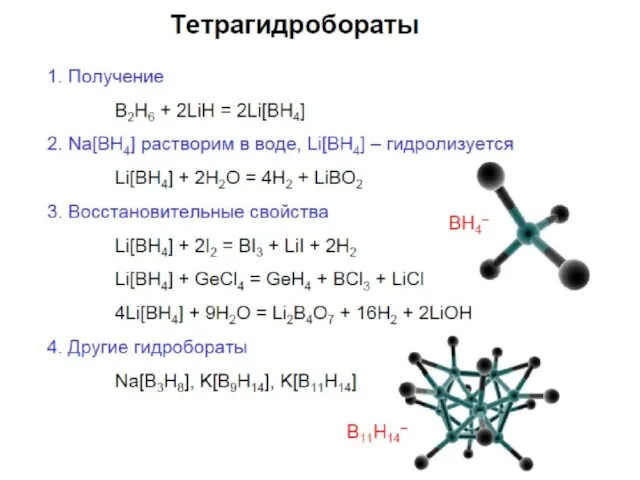
Слайд 39

Бороуглеводороды
Барен и необарен – вещества состава В10Н8(СН2)2
Отличаются взаиморасположением составляющих их атомов
Слайд 40

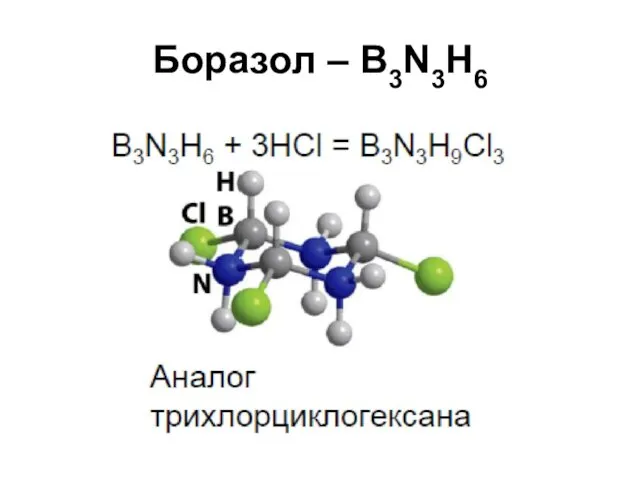
Боразол – B3N3H6
Неорганический бензол
У бензола и боразола почти идентичное строение, близкие
физические и химические свойства (правда, в большинстве реакций боразол ведет себя активнее бензола), причем не только у самих веществ, но и у аналогичных их производных
Слайд 41
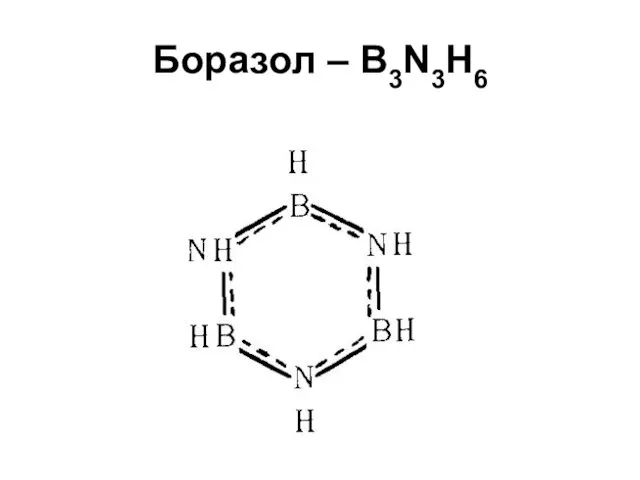
Слайд 42
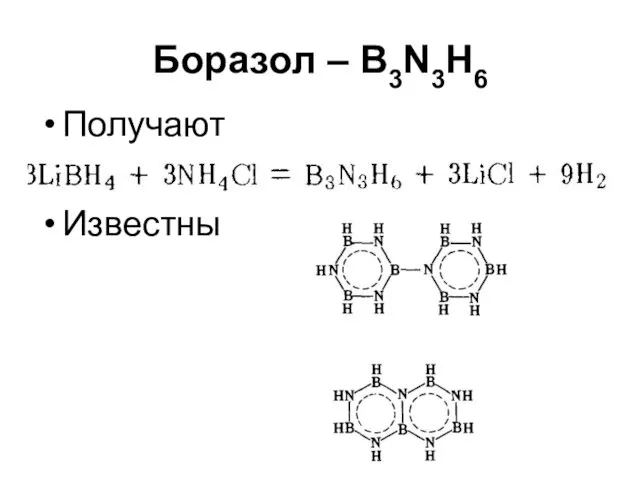
Боразол – B3N3H6
Получают
Известны
Слайд 43
Слайд 44
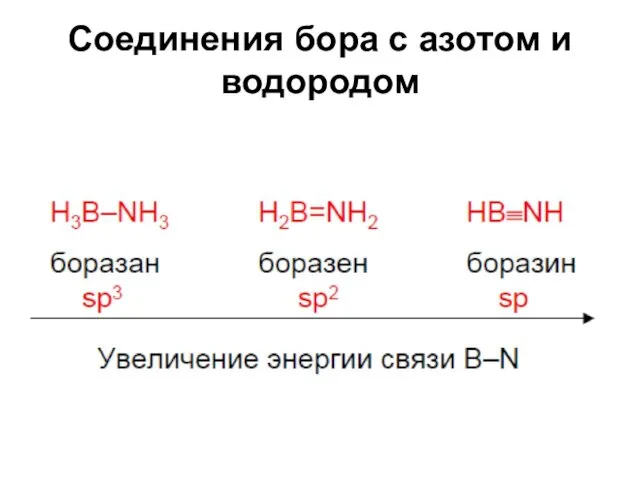
Соединения бора с азотом и водородом
Слайд 45

Слайд 46

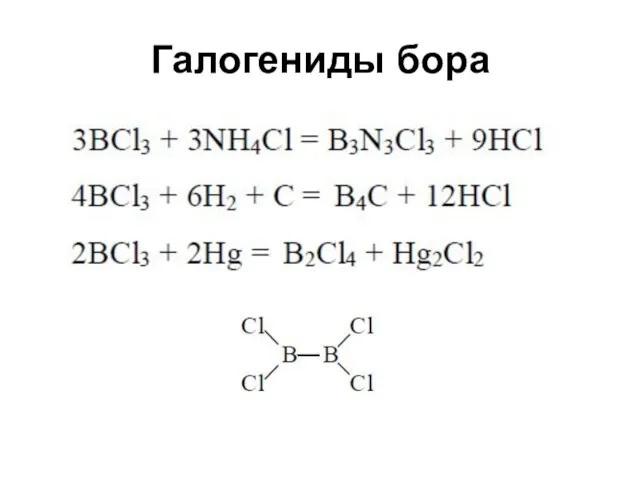
Галогениды бора
Плоское строение, молекулярные решетки
Термическое разложение в присутствии водорода – самый
чистый бор получают
2 BBr3 + 3 H2 → 2 B + 6 HBr
Слайд 47
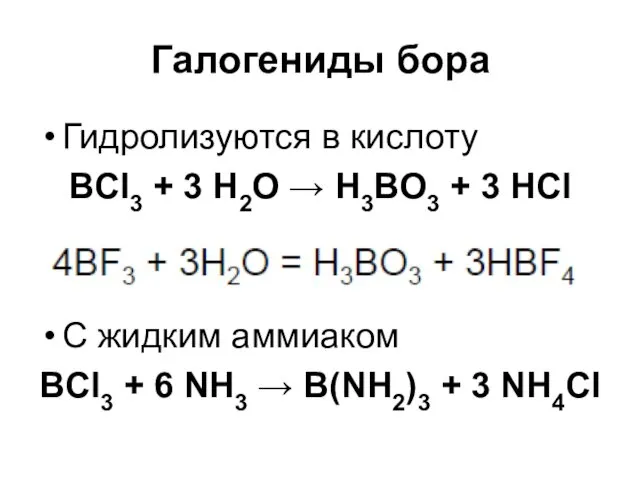
Галогениды бора
Гидролизуются в кислоту
BCl3 + 3 H2O → H3BO3 + 3
HCl
C жидким аммиаком
BCl3 + 6 NH3 → B(NH2)3 + 3 NH4Cl
Слайд 48
Слайд 49
![Галогениды бора Образование анионных комплексов (в эфире) BF3 + NaH → Na[BF3H]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/54920/slide-48.jpg)
Галогениды бора
Образование анионных комплексов (в эфире)
BF3 + NaH → Na[BF3H]
Слайд 50
Слайд 51
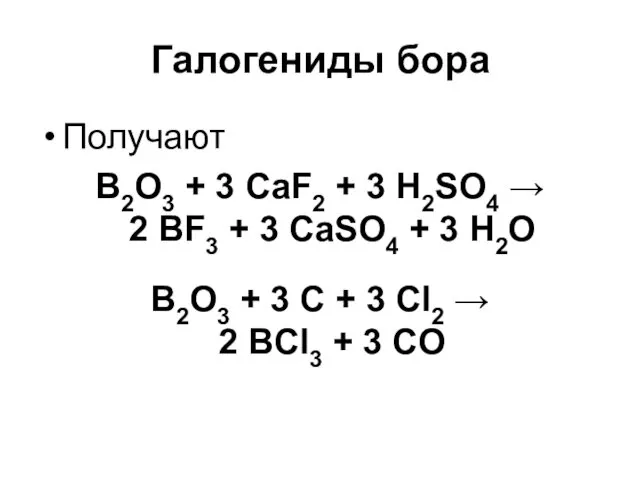
Галогениды бора
Получают
B2O3 + 3 CaF2 + 3 H2SO4 →
2 BF3
+ 3 CaSO4 + 3 H2O
B2O3 + 3 C + 3 Cl2 →
2 BCl3 + 3 CO
Слайд 52

Слайд 53
Слайд 54
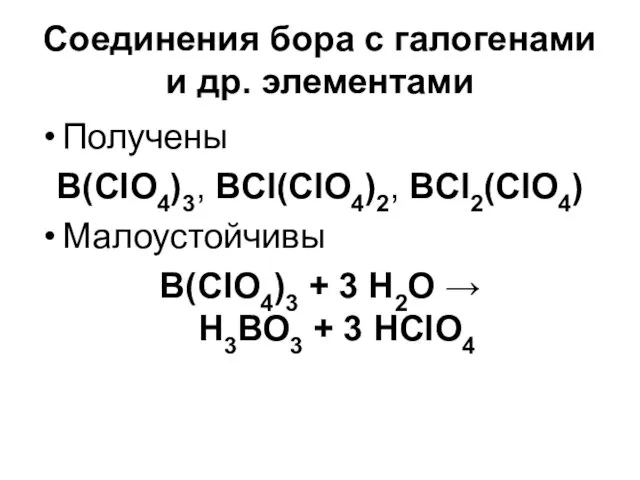
Соединения бора с галогенами и др. элементами
Получены
B(ClO4)3, BCl(ClO4)2, BCl2(ClO4)
Малоустойчивы
B(ClO4)3 +
3 H2O → Н3ВО3 + 3 HClO4
Слайд 55
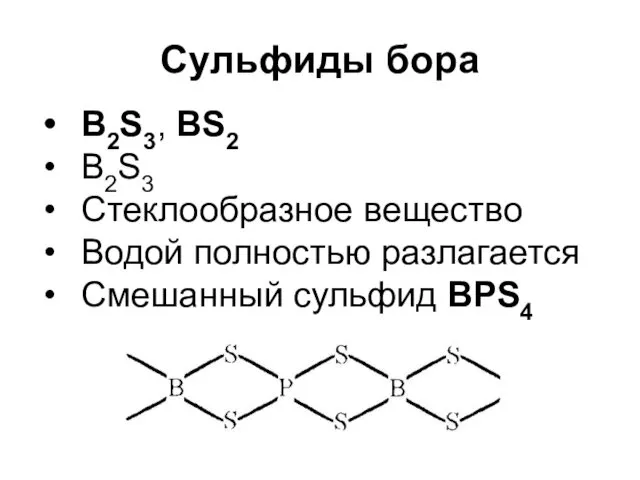
Сульфиды бора
B2S3, BS2
B2S3
Стеклообразное вещество
Водой полностью разлагается
Смешанный сульфид BPS4
Слайд 56

Оксид бора
Кислотный оксид, полимерное строение
(низкая Тпл - молекулярная структура)
Стекловидное труднолетучее
вещество, с большим трудом переходящее в кристаллическое состояние
Слайд 57

Борный ангидрид В2О3
Аморфный (стекловидный) В2О3 построен из беспорядочно расположенных плоских групп
[ВО3], где все атомы кислорода мостиковые
Углы ОВО составляют 120°. что указывает на sp2-гибридизацию АО атомов бора
Слайд 58
![Кристаллический борный ангидрид Фрагментами структуры являются тетраэдры [ВО4] (sp3-гибридизация АО](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/54920/slide-57.jpg)
Кристаллический борный ангидрид
Фрагментами структуры являются тетраэдры [ВО4] (sp3-гибридизация АО атомов бора),
связанные друг с другом в спиральные цепи
Слайд 59

Оксид бора
Медленно реагирует с водой с образованием борной кислоты
Слайд 60

Оксид бора
B2O3 + 2 KOH →
2 KBO2 + H2O
Слайд 61

Борная кислота Н3ВО3
В природе ее обнаружили в 1777 г., а получать
из буры научились на 75 лет раньше
Используется довольно широко: в медицине, в производстве эмалей, как сырье для получения других соединений бора
Слайд 62
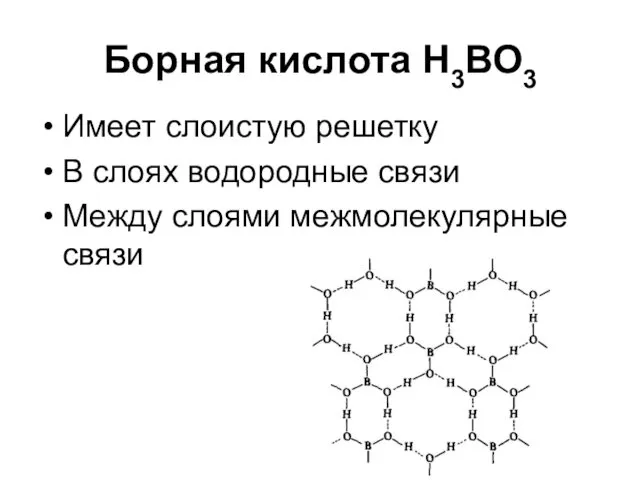
Борная кислота Н3ВО3
Имеет слоистую решетку
В слоях водородные связи
Между слоями межмолекулярные связи
Слайд 63

Борная кислота Н3ВО3
Одна из самых слабых кислот,
одноосновная
Н3ВО3 + HOH → H+
+ [B(OH)4]-
При нагревании выше 100°C теряет молекулу воды и превращается в тоже очень слабую метаборную кислоту НВО2
Слайд 64

Борная кислота Н3ВО3
Последовательные переходы в мета- и тетраборную кислоты, в борный
ангидрид
Н3ВО3 ↔ НВО2 + Н2О (100 0C)
4НВО2 ↔ Н2В4О7 + Н2О (1400C)
Н2В4О7 ↔ 2В2О3 + Н2O (5000 C)
Слайд 65

Водные растворы борной кислоты
Сладковатого вкуса, обладают дезинфицирующим действием и используются в
медицине (для полоскания горла и в качестве глазных капель)
Слайд 66

Борная кислота Н3ВО3
При нейтрализации щелочами образуются не ортобораты, а тетрабораты (соли
кислоты не известной в свободной форме)
В избытке щелочи тетрабораты переходят в метабораты
Слайд 67
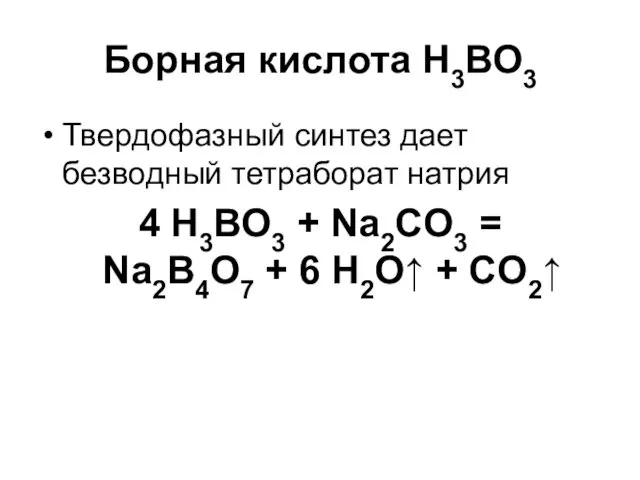
Борная кислота Н3ВО3
Твердофазный синтез дает безводный тетраборат натрия
4 Н3ВО3 + Na2CO3
=
Na2B4O7 + 6 H2O↑ + CO2↑
Слайд 68

Парадоксы комплексообразования
Обменные реакции типа «соль + кислота = новая соль +
новая кислота» идут до конца в том случае, если в результате реакции получается новая кислота, более слабая, чем исходная
Можно ли себе представить, чтобы слабая кислота вытесняла из соли... сильное основание?
Слайд 69
![Борная кислота Н3ВО3 В(ОН)3 + 4 KF = K[BF4] +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/54920/slide-68.jpg)
Борная кислота Н3ВО3
В(ОН)3 + 4 KF =
K[BF4] + 3 КОН
B(OH)3
+ 3 KF = BF3 + 3 КОН
BF3 + KF = K[BF4]
Слайд 70
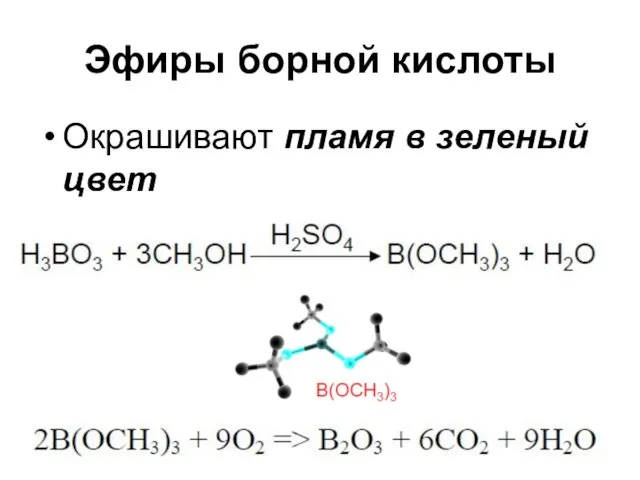
Эфиры борной кислоты
Окрашивают пламя в зеленый цвет
Слайд 71

Тетраборная кислота Н2В4О7
По силе сходна с уксусной
Ка 1= 2 • 10-4,
Ка2 = 2 • 10-5
Это позволяет рассматривать кислотные свойства тетраборной кислоты как результат депротонизации
Н2В4О7 = 2 Н+ + В4О72-
Слайд 72

Тетраборная кислота Н2В4О7
Разница в значениях констант диссоциации у Н2В4О7 невелика, поэтому
отщепление первого и второго протонов происходит практически одновременно, вследствие чего образуются двухзамещенные (средние) соли типа Na2B4O7
Слайд 73
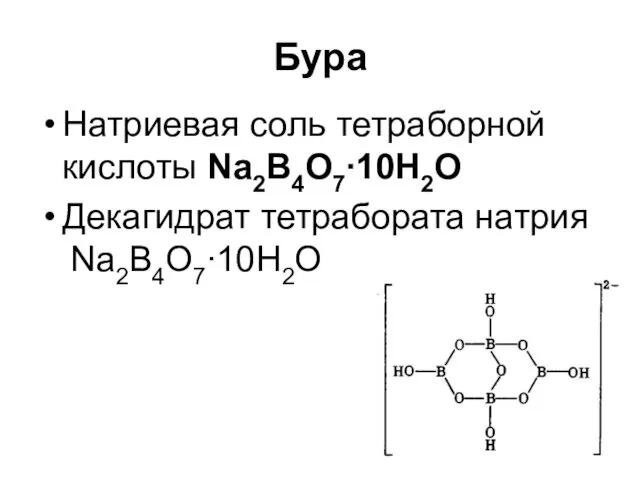
Бура
Натриевая соль тетраборной кислоты Na2B4O7∙10Н2О
Декагидрат тетрабората натрия Na2B4O7∙10H2O
Слайд 74
![Na2[B4O5(OH)4] • 8Н2О Формулу буры, записываемую как Na2B4O7 • 10Н2О,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/54920/slide-73.jpg)
Na2[B4O5(OH)4] • 8Н2О
Формулу буры, записываемую как Na2B4O7 • 10Н2О, правильнее изображать
в виде
Na2[B4O5(OH)4] • 8Н2О, что точнее отражает структуру тетраядерного аниона [В4О5(ОН)4]2-
Слайд 75

Бура
При действии кислот выделяется борная кислота
Слайд 76

Установка молярной концентрации раствора соляной кислоты по стандартному раствору буры
Слайд 77
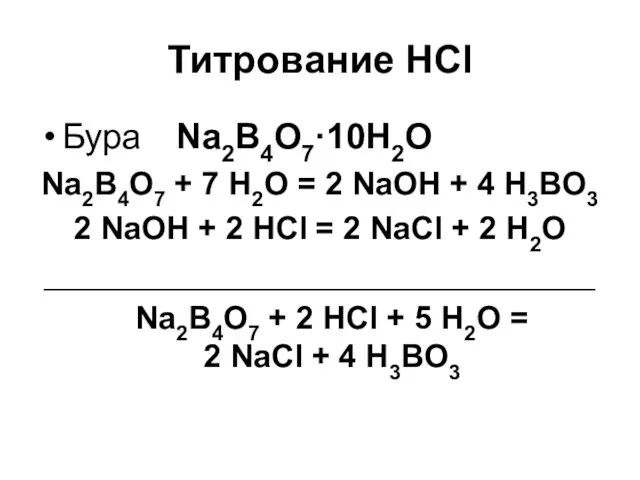
Титрование HCl
Бура Na2B4O7·10H2O
Na2B4O7 + 7 H2O = 2 NaOH + 4
H3BO3
2 NaOH + 2 HCl = 2 NaCl + 2 H2O
_______________________________
Na2B4O7 + 2 HCl + 5 H2O =
2 NaCl + 4 H3BO3
Слайд 78

Бура
При прокаливании с солями или оксидами металлов образуются двойные высокомолекулярные полиметабораты
– стекла окрашенные
синий
Слайд 79

Бура
Стеклообразный «перл»
Na2B4O7 + NiO = 2 NaBO2 · Ni(BO2)2
Перлы хрома,
никеля и железа имеют зеленую окраску, кобальта — синюю и т. д.
«Пробу на перлы буры» широко используют геологи, особенно при полевом анализе минералов
Слайд 80
Слайд 81
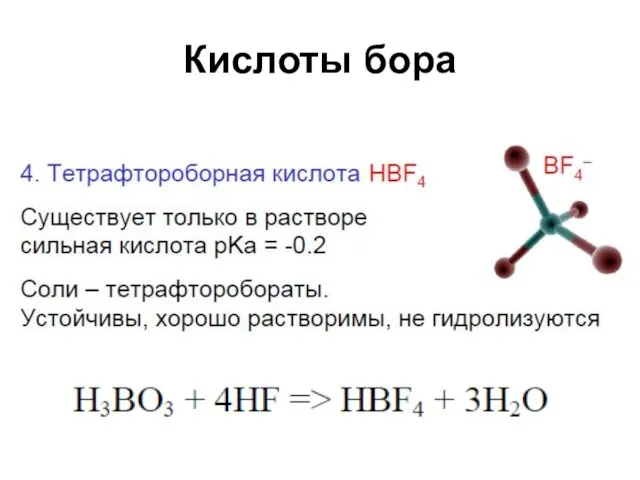
![Кислоты бора Комплексная фтороборная кислота H[BF4] – продукт присоединения HF](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/54920/slide-80.jpg)
Кислоты бора
Комплексная фтороборная кислота H[BF4] – продукт присоединения HF к ВF3
– сильнее плавиковой, серной и азотной кислот (получена только в растворах)
Слайд 82
Слайд 83
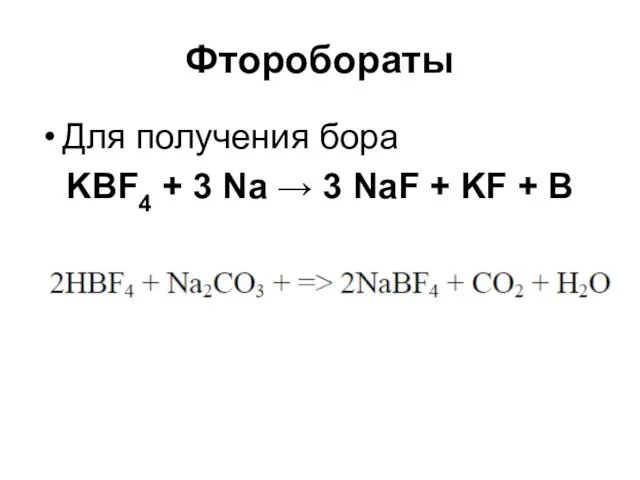
Фторобораты
Для получения бора
KBF4 + 3 Na → 3 NaF + KF
+ B
Слайд 84
Слайд 85















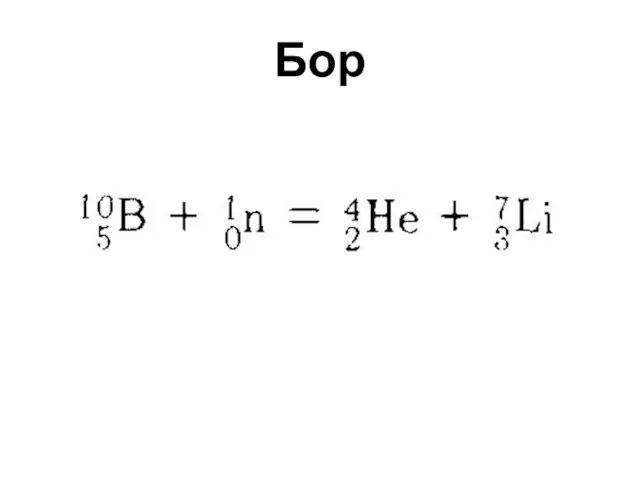
































![Галогениды бора Образование анионных комплексов (в эфире) BF3 + NaH → Na[BF3H]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/54920/slide-48.jpg)








![Кристаллический борный ангидрид Фрагментами структуры являются тетраэдры [ВО4] (sp3-гибридизация АО](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/54920/slide-57.jpg)










![Борная кислота Н3ВО3 В(ОН)3 + 4 KF = K[BF4] +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/54920/slide-68.jpg)




![Na2[B4O5(OH)4] • 8Н2О Формулу буры, записываемую как Na2B4O7 • 10Н2О,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/54920/slide-73.jpg)






![Кислоты бора Комплексная фтороборная кислота H[BF4] – продукт присоединения HF](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/54920/slide-80.jpg)




 Инструктаж по охране труда для уборщиков служебных и подсобных помещений.
Инструктаж по охране труда для уборщиков служебных и подсобных помещений. London zoo
London zoo Постоянный ток. Закон Ома для однородного участка цепи
Постоянный ток. Закон Ома для однородного участка цепи Урок-игра Поле чудес
Урок-игра Поле чудес Методика проведения специсследований съемных носителей USB 3.0
Методика проведения специсследований съемных носителей USB 3.0 Свобода вероисповедания
Свобода вероисповедания МЕТОДОЛОГИЧЕСКАЯ КУЛЬТУРА ПЕДАГОГА КАК УСЛОВИЕ ПОВЫШЕНИЯ КАЧЕСТВА ОБРАЗОВАНИЯ ВОСПИТАННИКОВ
МЕТОДОЛОГИЧЕСКАЯ КУЛЬТУРА ПЕДАГОГА КАК УСЛОВИЕ ПОВЫШЕНИЯ КАЧЕСТВА ОБРАЗОВАНИЯ ВОСПИТАННИКОВ Презентация для родителей будущих первоклассников
Презентация для родителей будущих первоклассников Методы зондирования окружающей среды. Радиофизические характеристики атмосферы Земли
Методы зондирования окружающей среды. Радиофизические характеристики атмосферы Земли Основные течения протестантизма
Основные течения протестантизма Правоотношения. Правоотношения
Правоотношения. Правоотношения Шалкан әкиятенә презентация
Шалкан әкиятенә презентация Зәршығару. Қажетсіз заттарды денесінен шығару
Зәршығару. Қажетсіз заттарды денесінен шығару Система технического обслуживания и ремонта оборудования
Система технического обслуживания и ремонта оборудования Русская музыка. Первая половина XIX века
Русская музыка. Первая половина XIX века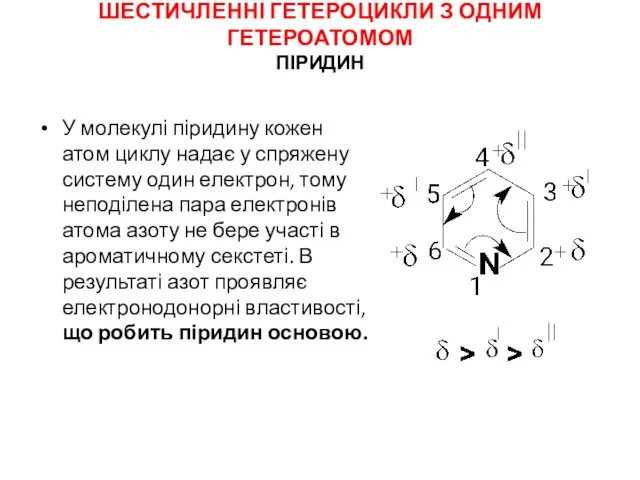 Шестичленні гетероцикли з одним гетероатомом. Піридин
Шестичленні гетероцикли з одним гетероатомом. Піридин Английская философия 17 века. Джон Локк и Томас Гоббс
Английская философия 17 века. Джон Локк и Томас Гоббс Колониальная политика европейских стран
Колониальная политика европейских стран Поздравления юношей
Поздравления юношей Контражур
Контражур Федеральный Государственный Образовательный Стандарт Дошкольного Образования
Федеральный Государственный Образовательный Стандарт Дошкольного Образования Традиции и обычаи народов мира
Традиции и обычаи народов мира Алгебра передаточных функций
Алгебра передаточных функций День флага ДНР
День флага ДНР ЕГЭ. Профильная математика. № 3
ЕГЭ. Профильная математика. № 3 Теория и методика социального развития дошкольника
Теория и методика социального развития дошкольника 22 июня 1941 года. Начало Великой Отечественной войны
22 июня 1941 года. Начало Великой Отечественной войны Портфолио воспитателя детского сада
Портфолио воспитателя детского сада