Содержание
- 2. БРОНХИАЛЬНАЯ АСТМА – это хроническое воспалительное заболевание дыхательных путей, в патогенезе которого принимают участие многие клетки
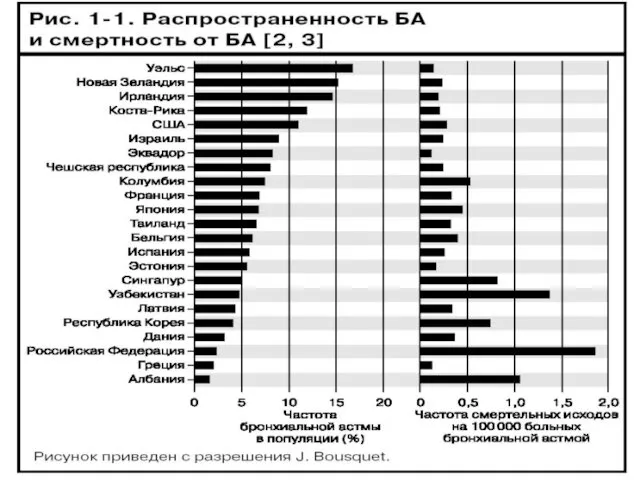
- 3. эпидемиология В мире БА страдают 5% взрослого населения. У детей в разных странах распространенность варьирует от
- 5. Факторы риска Внутренние факторы: Генетическая предрасположенность Изучение генов, связанных с развитием БА, касается 4 ключевых вопросов:
- 6. Факторы риска Внутренние факторы: Ожирение Фактором риска возникновения БА считается также ожирение. Некоторые медиаторы, например лептины,
- 7. Факторы риска Внутренние факторы: Пол Мужской пол является фактором риска развития астмы у детей. До 14-летнего
- 8. Факторы риска Внешние факторы: АЛЛЕРГЕНЫ помещений: домашние клещи, животные (собаки, коты, мыши и др.), тараканы, грибы
- 9. Факторы риска Внешние факторы: 2. ИНФЕКЦИИ Согласно «гигиенической» гипотезе, перенесенные в детском возрасте инфекции способствуют развитию
- 10. Факторы риска Внешние факторы: 2. ИНФЕКЦИИ С другой стороны, вирусы могут оказывать влияние на развитие аллергической
- 11. Факторы риска Внешние факторы: ПРОФЕССИОНАЛЬНЫЕ СЕНСИБИЛИЗИРУЮЩИЕ ВЕЩЕСТВА - Профессиональные сенсибилизаторы ответственны за 1 из 10 случаев
- 12. Примеры веществ, вызывающих БА у лиц определенных профессий
- 13. Факторы риска Внешние факторы: АКТИВНОЕ КУРЕНИЕ - Табачный дым содержит около 4500 веществ, среди которых более
- 14. Факторы риска Внешние факторы: 4. ПАССИВНОЕ КУРЕНИЕ - Единственным доказанным и признанным вмешательством, способным предупредить развитие
- 15. Факторы риска Внешние факторы: 5. ЗАГРЯЗНЕНИЕ АТМОСФЕРЫ И ВОЗДУХА ПОМЕЩЕНИЙ - Наблюдения показали, что развитие обострений
- 16. Факторы риска Внешние факторы: ПИТАНИЕ - дети, получавшие смеси на основе коровьего молока или белков сои,
- 17. домашние и внешние аллергены воздушные поллютанты респираторные инфекции физическая нагрузка и гипервентиляция изменение погодных условий пища,
- 18. Патогенез Спектр клинических проявлений БА чрезвычайно широк, а в патогенез вовлечены разнообразные клеточные структуры, однако неизменным
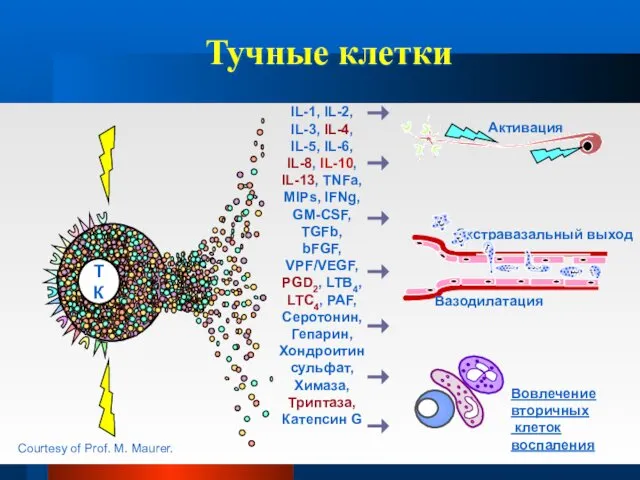
- 19. Тучные клетки IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-8, IL-10, IL-13, TNFa, MIPs, IFNg, GM-CSF, TGFb,
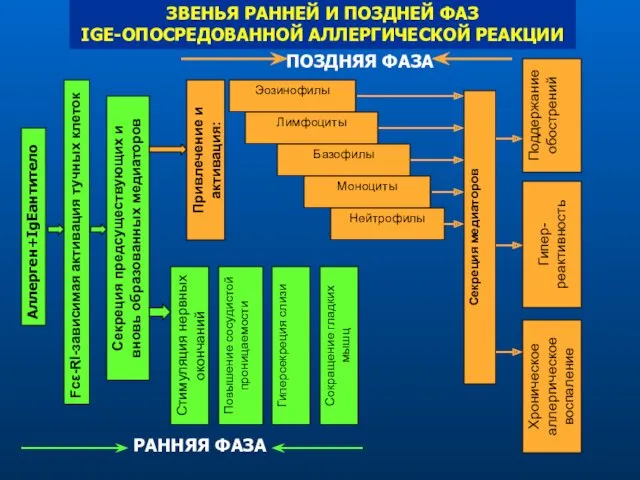
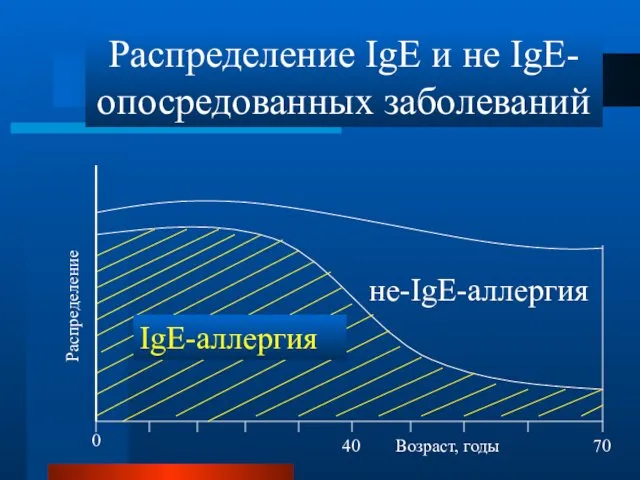
- 20. ЗВЕНЬЯ РАННЕЙ И ПОЗДНЕЙ ФАЗ IGE-ОПОСРЕДОВАННОЙ АЛЛЕРГИЧЕСКОЙ РЕАКЦИИ Аллерген+IgEантитело Fcε-Rl-зависимая активация тучных клеток Секреция предсуществующих и
- 21. Патогенез Клетки, участвующие в воспалении дыхательных путей при БА ТУЧНЫЕ КЛЕТКИ Активируются аллергенами через высокоаффинные рецепторы
- 22. Патогенез Клетки, участвующие в воспалении дыхательных путей при БА ЭОЗИНОФИЛЫ - Выделяют протеины (основной и катионный
- 23. Патогенез Клетки, участвующие в воспалении дыхательных путей при БА Т-ЛИМФОЦИТЫ - выделяют специфические цитокины, например интерлейкин
- 24. Клетки, участвующие в воспалении дыхательных путей при БА МАКРОФАГИ - активируются аллергенами опосредованно через низкоаффинные рецепторы
- 25. Патогенез Структурные клетки дыхательных путей, участвующие в патогенезе БА Эпителиальные клетки дыхательных путей в ответ на
- 26. Структурные клетки дыхательных путей, участвующие в патогенезе БА Фибробласты и миофибробласты вырабатывают вещества – компоненты соединительной
- 27. Ключевые медиаторы воспаления при БА известно более 100 различных медиаторов, принимающих участие в процессах воспаления при
- 28. Ключевые медиаторы воспаления при БА Цистеиниловые лейкотриены, продуцируемые в основном тучными клетками и эозинофилами, являются медиаторами
- 29. Ключевые медиаторы воспаления при БА Цитокины стимулируют развитие воспалительной реакции, определяя таким образом тяжесть БА. Ключевыми
- 30. Патогенез Ключевые медиаторы воспаления при БА Гистамин, выделяемый тучными клетками, способствует бронхоконстрикции и принимает участие в
- 31. Патогенез Структурные изменения дыхательных путей БА характеризуется не только развитием воспалительных реакций, но и специфическими структурными
- 32. Патогенез Структурные изменения дыхательных путей 1. субэпителиальный фиброз - Связан с активацией фибробластов и отложением коллагена
- 33. Патогенез Структурные изменения дыхательных путей 2. Увеличение массы гладких мышц происходит за счет их гипертрофии (увеличения
- 34. Патогенез Патофизиологические изменения Сужение просвета дыхательных путей, связано с влиянием нескольких факторов: 1. Спазм гладкой мускулатуры
- 35. Патогенез Патофизиологические изменения 2. Отек бронхов развивается под влиянием провоспалительных медиаторов вследствие повышенной проницаемости сосудов микроциркуляторного
- 36. Патогенез Гиперреактивность дыхательных путей - – характерное функциональное нарушение при БА – служит причиной сужения дыхательных
- 37. Патогенез Механизмы гиперреактивности дыхательных путей Чрезмерное сокращение гладкой мускулатуры бронхов в результате увеличения размера и/или сократительной
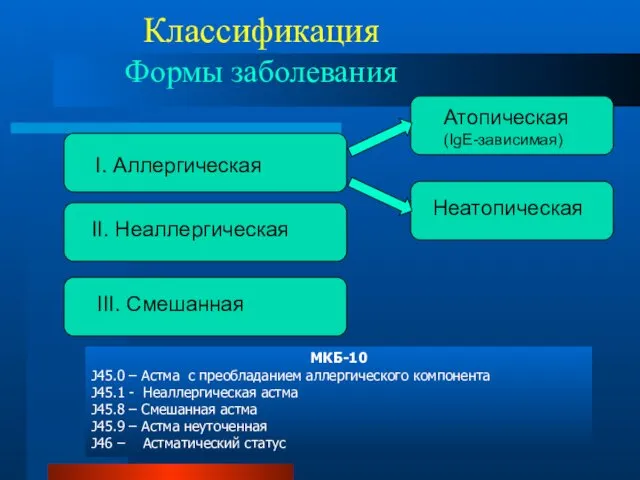
- 38. Классификация Формы заболевания МКБ-10 J45.0 – Астма с преобладанием аллергического компонента J45.1 - Неаллергическая астма J45.8
- 40. Симптомы реже 1 раза в неделю Короткие обострения Ночные симптомы не чаще 2 раз в месяц
- 41. Классификация астмы по степени тяжести с выделением интермиттирующей, легкой хронической, умеренной хронической и тяжелой хронической форм
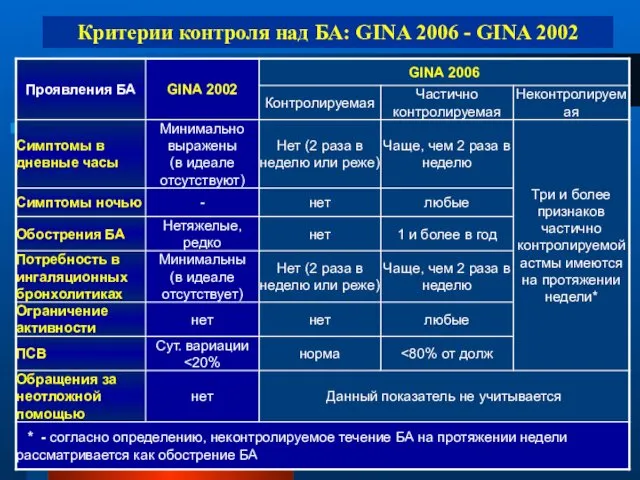
- 42. Предложение GINA 2006 классифицировать астму в зависимости от степени контроля над заболеванием: Контролируемая Частично контролируемая Неконтролируемая
- 43. Критерии контроля над БА: GINA 2006 - GINA 2002
- 44. Классификация Фазы течения заболевания Обострение Анализ, проведенный по материалам исследований FACET и INSPIRE, показал, что увеличение
- 45. Под обострением астмы понимается (GINA-2006) не только быстрое и значительное ухудшение состояния больного, но и отсутствие
- 46. Диагностика Бронхиальная астма – диагноз клинико-функциональный Анамнез Необходимо уточнять Последовательность возникновения симптомов: кашель – хрипы в
- 47. Диагностика II. Объективное обследование В период ремиссии и при отсутствии осложнений никаких отклонений от нормы может
- 48. Диагностика III. Лабораторное обследование Общий анализ крови (возможно наличие эозинофилии в период обострения)D Общий анализ мокроты
- 49. Диагностика Аллергологическое обследование Обязательное Кожные пробы с аллергенами (простота, низкая стоимость, высокая чувствительность) Дополнительное Провокационные ингаляционные
- 50. Диагностика Инструментальные исследования (обязательные) 1. Исследование ФВД – проводят с целью выявления обратимой бронхиальной обтрукции для
- 52. Диагностика Инструментальные исследования СПИРОМЕТРИЯ Наиболее информативные показатели ФВД : ОФВ1 - объем воздуха, который может выдохнуть
- 53. Диагностика Инструментальные исследования СПИРОМЕТРИЯ Для БА характерно: Снижение ОФВ1 и ФЖЕЛ (обструктивный тип нарушений ФВД) Увеличение
- 54. Для диагностики и мониторинга по-прежнему рекомендуется оценка функции легких с помощью спирометрии и измерение пиковой скорости
- 55. Диагностика Инструментальные исследования СПИРОМЕТРИЯ Дополнительные показатели: Средняя объемная скорость выдоха (СОС 25-75). Показатель особенно важен для
- 56. Диагностика Инструментальные исследования Бронхомоторные тесты Тест с бронхолитиками (сальбутамолом, фенотеролом) ДЛЯ ВЫЯВЛЕНИЯ ОБРАТИМОСТИ БРОНХИАЛЬНОЙ ОБСТРУКЦИИ: Доза
- 57. Диагностика Бронхомоторные тесты Тест с бронхоконстрикторами (ацетилхолином, карбахолом, гистамином): Тест проводят для подтверждения диагноза БА в
- 58. Диагностика Инструментальные исследования РЕНТГЕНОГРАФИЯ ОГК Метод малоинформативен для диагностики БА. Используется для дифференциальной диагностики с другими
- 59. Диагностика Инструментальные исследования РЕНТГЕНОГРАФИЯ ОКОНОСОВЫХ ПАЗУХ Позволяет выявить патологию, которая нередко сопутствует БА (ринит, синусит, а
- 60. Дифференциальный диагноз гипервентиляционный синдром и панические атаки обструкция верхних дыхательных путей и аспирация инородных тел дисфункция
- 61. Дифференциальная диагностика БА и ХОБЛ
- 62. концептуальная цель в лечении БА – достижение и поддержание клинического контроля над заболеванием Под контролем БА
- 63. схема ведения пациентов Рекомендации GINA, пересмотр 2006 г 1. Развитие партнерских отношений между врачом и пациентом.
- 64. 1. Доказано, что клинические проявления астмы – любые симптомы, нарушения сна, ограничения повседневной активности, нарушения функции
- 65. 2. Обновленные данные по эпидемиологии астмы позволяют сделать вывод о том, что затраты на лечение и
- 66. ОСНОВНЫЕ ГРУППЫ ЛЕКАРСТВЕННЫХ СРЕДСТВ ДЛЯ ЛЕЧЕНИЯ БА Ингаляционные глюкокортикостероиды (иГКС) Рекомендуются как препараты первой лини терапии
- 67. Ингаляционные препараты для лечения БА представлены в виде: дозирующих аэрозольных ингаляторов (ДАИ), активируемых дыханием ДАИ, дозирующих
- 68. Беклометазон дипропионат Беклазон Эко Легкое дыхание 50, 100, 250 мкг Беклождет 250мкг Кленил 50, 250 мкг
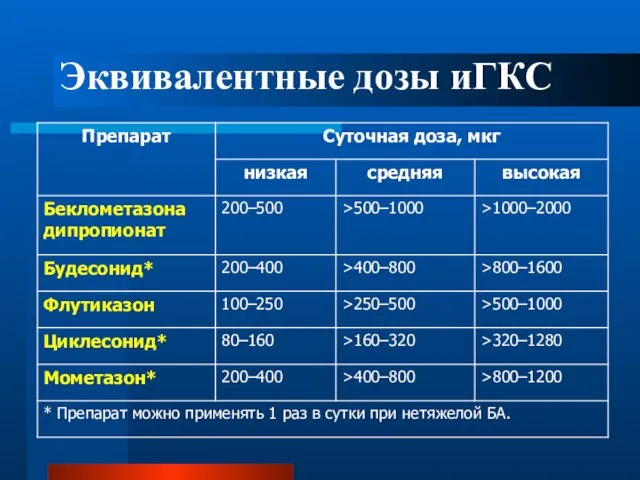
- 69. Эквивалентные дозы иГКС
- 70. Основной эффект ИГКС у взрослых достигается при применении сравнительно низких доз, эквивалентных 400 мкг будесонида в
- 71. Побочные эффекты иГКС Местные нежелательные эффекты: орофарингеальный кандидоз, дисфонию и иногда кашель из-за раздражения верхних дыхательных
- 72. Применяются в виде двух режимов: Поддерживающая доза СКС (5 ступень лечения) Должна быть минимальной, так как
- 73. Обладают бронходилатирующим эффектом продолжительностью 12 часов, подавляет раннюю и позднюю фазы аллергической реакции, уменьшают гиперреактивность бронхов,
- 74. 1. Сальметерол - - Серевент (ДАИ 25 мкг, пор/инг 50 мкг - диски) 2. Формотерол –
- 75. Возможна в 2-х режимах: При недостаточном контроле симптомов БА возможно добавление к применяемой дозе иГКС пролонгированного
- 76. Серетид – Сальметрол+Флутиказон ДАИ 25/50, 25/125, 25/250 мкг Мультидиск 50/100, 50/250, 50/500 мкг 2. Симбикорт –
- 77. Терапия фиксированными дозами - стартовая терапия комбинированным препаратом с увеличением дозы до достижения полного контроля астмы
- 78. Препараты применяют на любом этапе лечения БА с целью купирования бронхоспазма и восстановления проходимости дыхательных путей
- 79. Являются препаратами второго ряда и могут применяться при непереносимости β2-агонистов или совместно с ними для усиления
- 80. Обладают бронхорасширяющим и слабым противовоспалительным действием. Имеют высокий риск побочных эффектов (тошнота, рвота, тахикардия, нарушения сердечного
- 81. 1. Антагонисты лейкотриеновых LTC4-, LTD4-, LTE4-рецепторов: Подавляют сократительную активность гладкой мускулатуры дыхательных путей Предотвращают вызываемые лейкотриенами
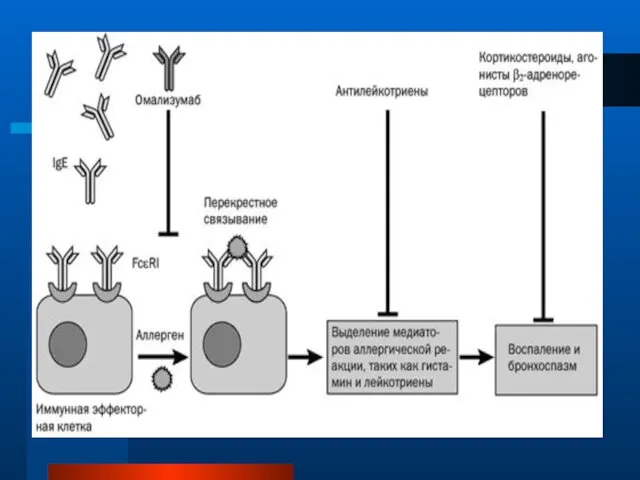
- 82. Омализумаб – моноклональные гуманизированные анти-IgE-антитела Способны связывать свободный IgE, предотвращая взаимодействие IgE с FcεR1-рецептором на эффекторных
- 85. Специфическая иммунотерапия играет вспомогательную роль в лечении взрослых пациентов с атопической БА Для адекватной иммунотерапии необходимо
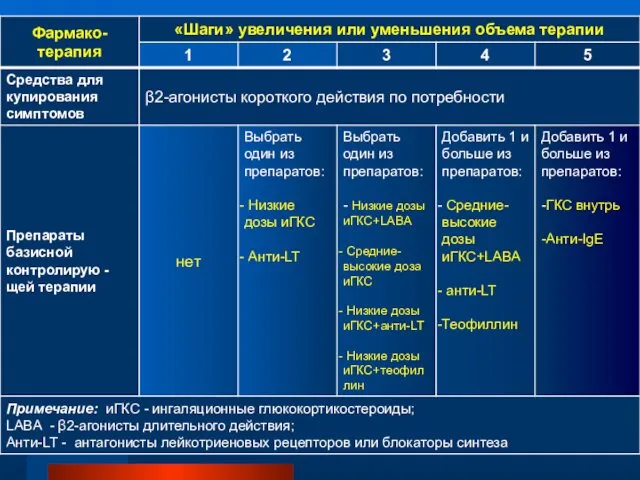
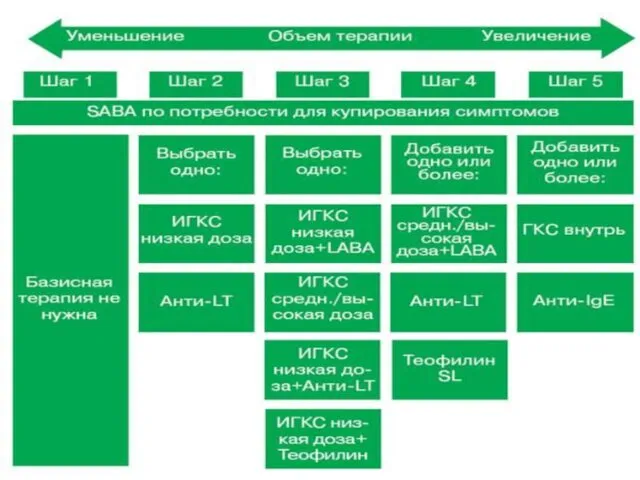
- 86. ТАКТИКА УМЕНЬШЕНИЯ ИЛИ УВЕЛИЧЕНИЯ ОБЪЕМА БАЗИСНОЙ (КОНТРОЛИРЮЩЕЙ) ТЕРАПИИ БРОНХИАЛЬНОЙ АСТМЫ
- 89. 7. Увеличение потребности в бронхолитиках, особенно ежедневное их применение - свидетельство ухудшения контроля над астмой и
- 90. для окончательной оценки эффективности низких доз ингаляционных ГКС и решения вопроса о переходе: с шага 2
- 91. В отношении снижения объема терапии новая редакция GINA предусматривает следующие положения: • У больных, получающих только
- 92. Если у больных, получающих низкие дозы ингаляционных ГКС, было достигнуто контролируемое течение заболевания, можно перейти на
- 93. Снижение объема терапии у больных, получающих ингаляционные ГКС и длительно действующие b2–агонисты: - Доза ингаляционных ГКС
- 94. Наконец, базисную терапию можно полностью отменить, если больной получает минимальную дозу препарата и в течение года
- 95. Новые представления о роли и месте различных препаратов, используемых в лечении астмы последние данные свидетельствуют о
- 96. Более важное место в достижении и поддержании контроля над астмой следует уделять модификаторам лейкотриенов
- 97. Ни на одной из стадий лечения не рекомендуется вводить пероральные β2-агонисты длительного действия, если только они
- 98. Монотерапия кромонами более не предлагается как альтернатива монотерапии низкими дозами ингаляционных глюкокортикостероидов у взрослых
- 100. Скачать презентацию






















































































 Technologies of the tomorrow
Technologies of the tomorrow Артериалды гипертонияның терапиясы және алдын алуы
Артериалды гипертонияның терапиясы және алдын алуы Эксплуатация и техническое обслуживание систем вентиляции и кондиционирования воздуха
Эксплуатация и техническое обслуживание систем вентиляции и кондиционирования воздуха Интерактивный справочник по технологии
Интерактивный справочник по технологии США в 1865-1914 гг
США в 1865-1914 гг Сымбат пиелонефрит
Сымбат пиелонефрит Молодежные беседы о православии. Сотворение мира. Христианский взгляд
Молодежные беседы о православии. Сотворение мира. Христианский взгляд Международный финансовый бизнес. Сегментация мирового финансового рынка и основных инструментов для проведения валютных операций
Международный финансовый бизнес. Сегментация мирового финансового рынка и основных инструментов для проведения валютных операций Творческий проект
Творческий проект Электронное портфолио к конкурсу Учитель года 2013 2 часть
Электронное портфолио к конкурсу Учитель года 2013 2 часть проект Влияние вредных привычек на здоровье человека
проект Влияние вредных привычек на здоровье человека Анализ и разработка конкурентных стратегий
Анализ и разработка конкурентных стратегий Конструкции печей
Конструкции печей English fashion
English fashion Добро
Добро Доклад на заседание облдумы. Состояние систем водоснабжения и водоотведения города Саратова
Доклад на заседание облдумы. Состояние систем водоснабжения и водоотведения города Саратова Запасы на зиму (2 часть) Диск
Запасы на зиму (2 часть) Диск Родительское собрание будущих первоклассников
Родительское собрание будущих первоклассников Банкротство физических лиц
Банкротство физических лиц Презентация Логопедические игры
Презентация Логопедические игры Презентация по здоровому питанию Жвачка: польза или вред
Презентация по здоровому питанию Жвачка: польза или вред Классный час Что мы едим.Быстрое питание.Презентация.
Классный час Что мы едим.Быстрое питание.Презентация. Основные методологические аспекты проектирования информационной системы
Основные методологические аспекты проектирования информационной системы Галогенпроизводные алифатических углеводородов
Галогенпроизводные алифатических углеводородов Презентація_Тема 0_Лекція _Вступ_до мови Pithon (2)
Презентація_Тема 0_Лекція _Вступ_до мови Pithon (2) Основы государственного регулирования внешнеторговой деятельности
Основы государственного регулирования внешнеторговой деятельности Индивидуальное сопровождение воспитанников Специальной общеобразовательной школы № 1 /закрытого типа/
Индивидуальное сопровождение воспитанников Специальной общеобразовательной школы № 1 /закрытого типа/ klass
klass