Содержание
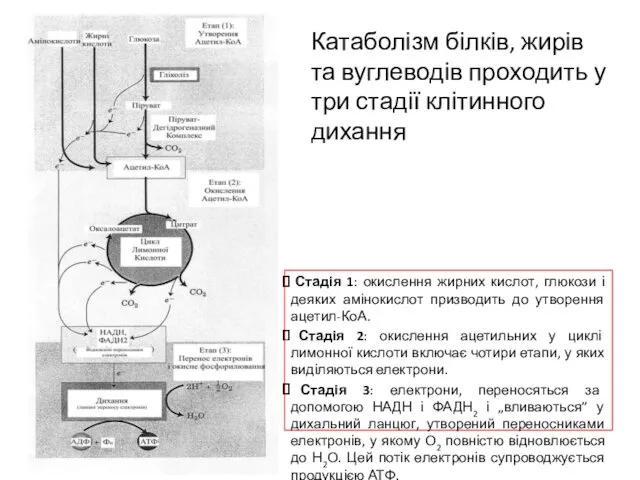
- 2. Стадія 1: окислення жирних кислот, глюкози і деяких амінокислот призводить до утворення ацетил-КоА. Стадія 2: окислення
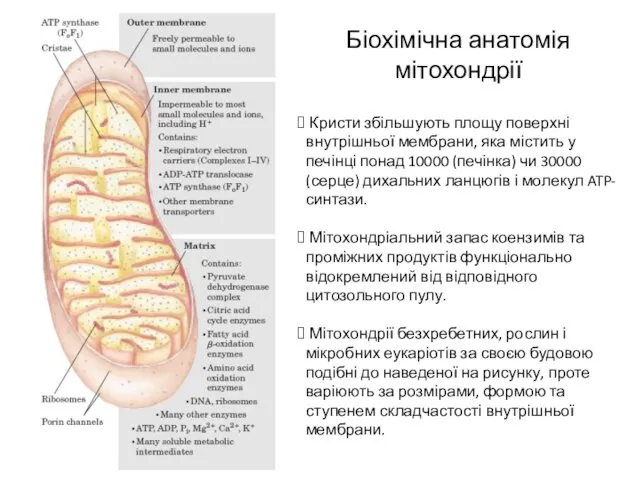
- 3. Біохімічна анатомія мітохондрії Кристи збільшують площу поверхні внутрішньої мембрани, яка містить у печінці понад 10000 (печінка)
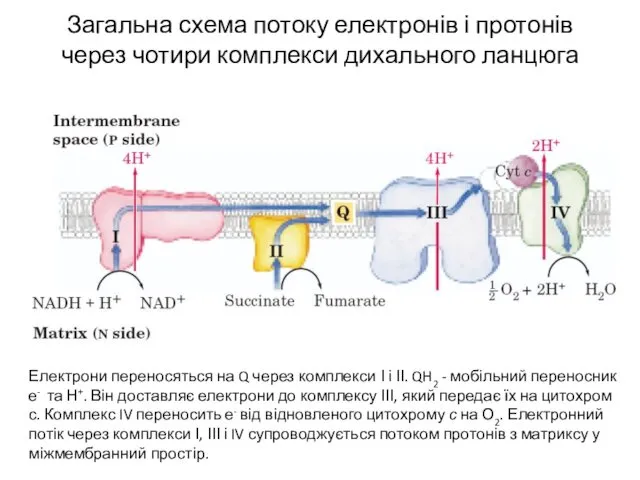
- 4. Загальна схема потоку електронів і протонів через чотири комплекси дихального ланцюга Електрони переносяться на Q через
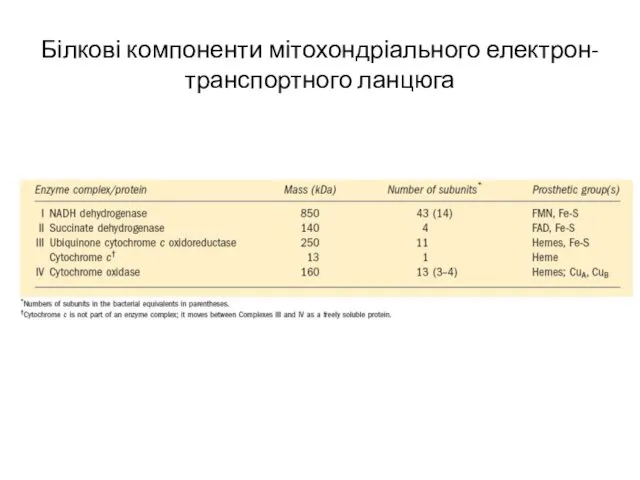
- 5. Білкові компоненти мітохондріального електрон-транспортного ланцюга
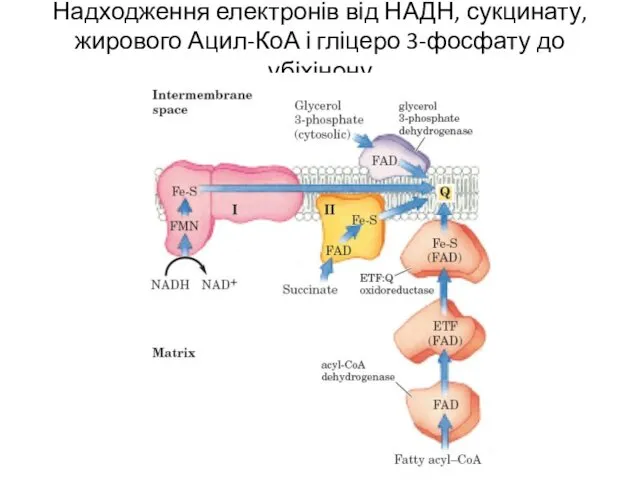
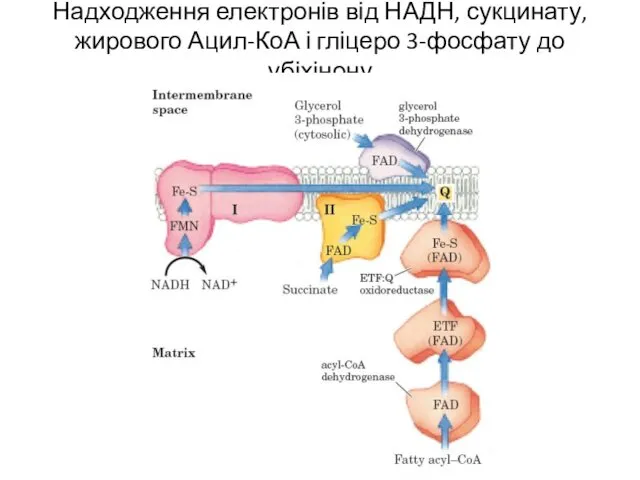
- 6. Надходження електронів від НАДН, сукцинату, жирового Ацил-КоА і гліцеро 3-фосфату до убіхінону
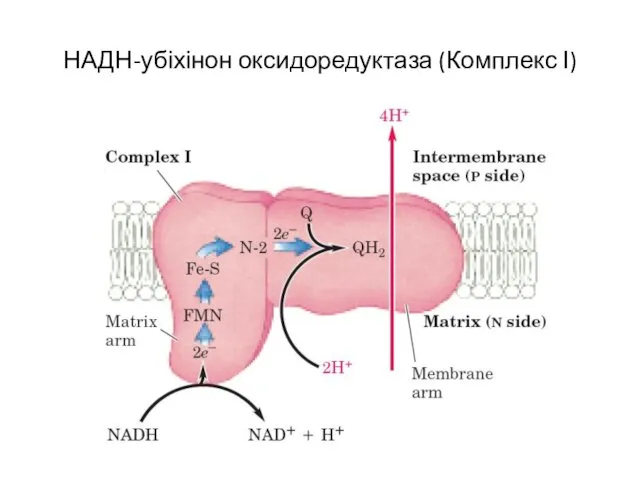
- 7. НАДН-убіхінон оксидоредуктаза (Комплекс І)
- 8. Деякі важливі реакції, що каталізуються НАД(Ф)Н-дегідрогеназами
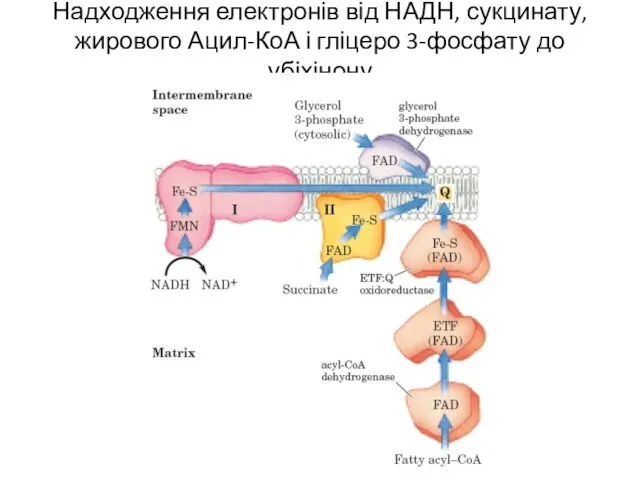
- 9. Надходження електронів від НАДН, сукцинату, жирового Ацил-КоА і гліцеро 3-фосфату до убіхінону
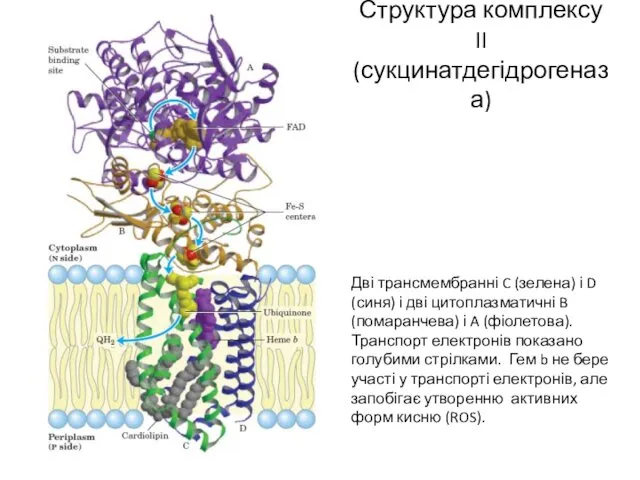
- 10. Структура комплексу II (сукцинатдегідрогеназа) Дві трансмембранні C (зелена) і D (синя) і дві цитоплазматичні B (помаранчева)
- 11. Надходження електронів від НАДН, сукцинату, жирового Ацил-КоА і гліцеро 3-фосфату до убіхінону
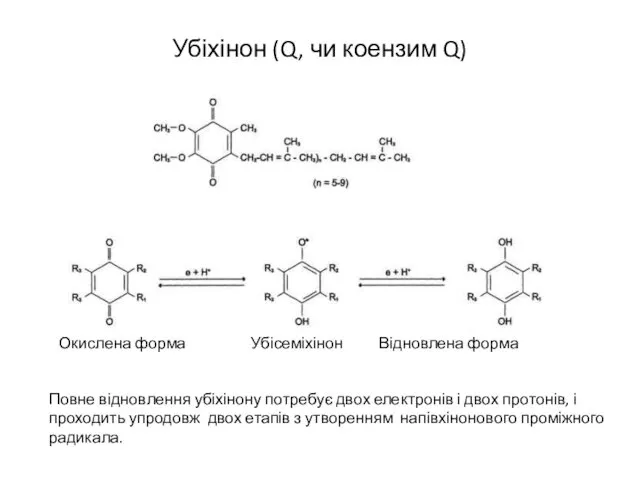
- 12. Убіхінон (Q, чи коензим Q) Повне відновлення убіхінону потребує двох електронів і двох протонів, і проходить
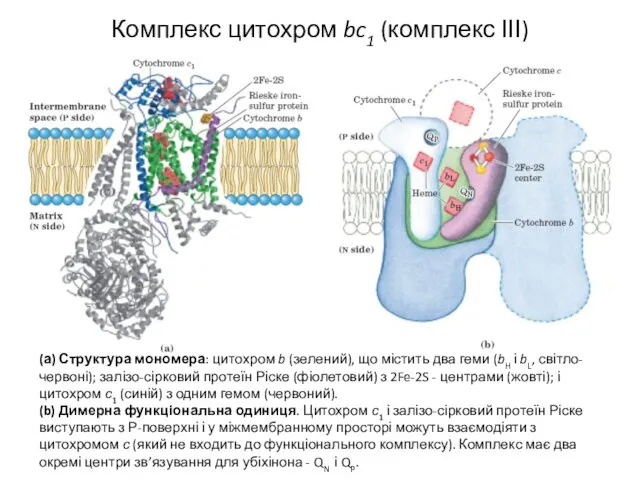
- 13. Комплекс цитохром bc1 (комплекс ІІІ) (а) Структура мономера: цитохром b (зелений), що містить два геми (bH
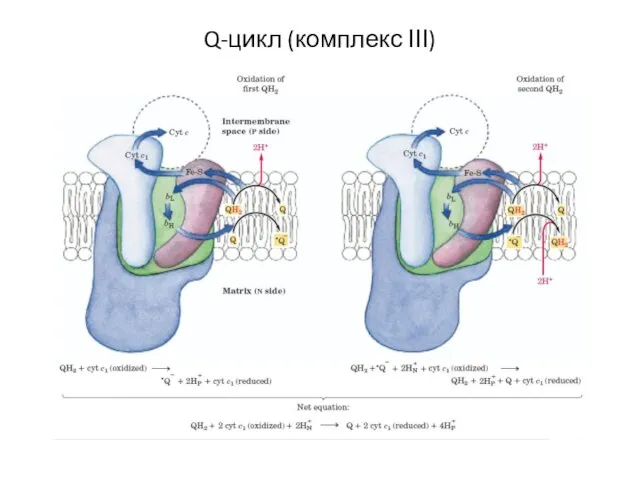
- 14. Q-цикл (комплекс ІІІ)
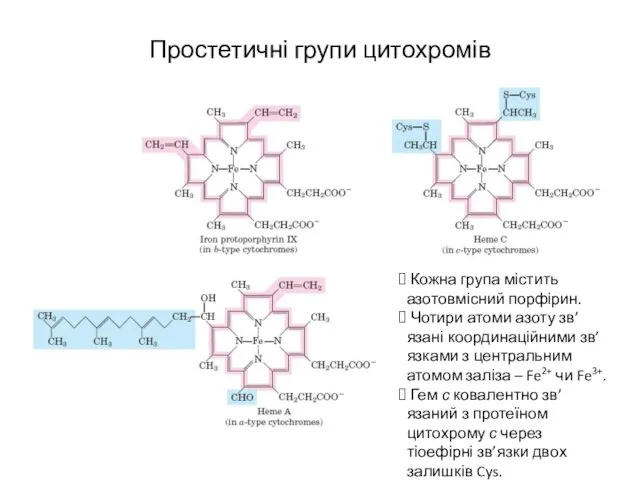
- 15. Простетичні групи цитохромів Кожна група містить азотовмісний порфірин. Чотири атоми азоту зв’язані координаційними зв’язками з центральним
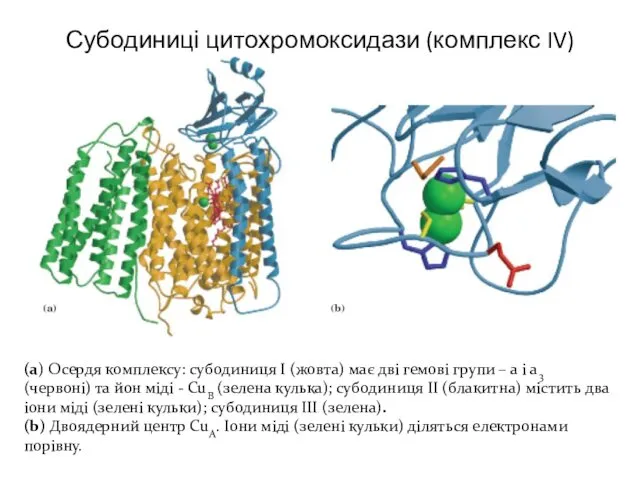
- 16. Субодиниці цитохромоксидази (комплекс IV) (а) Осердя комплексу: субодиниця І (жовта) має дві гемові групи – а
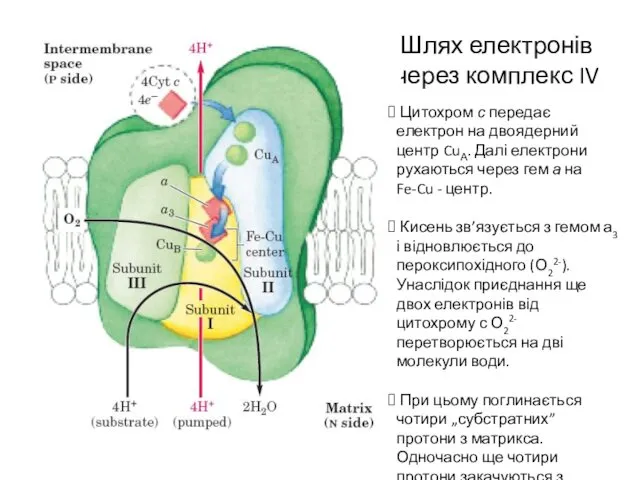
- 17. Шлях електронів через комплекс IV Цитохром с передає електрон на двоядерний центр CuА. Далі електрони рухаються
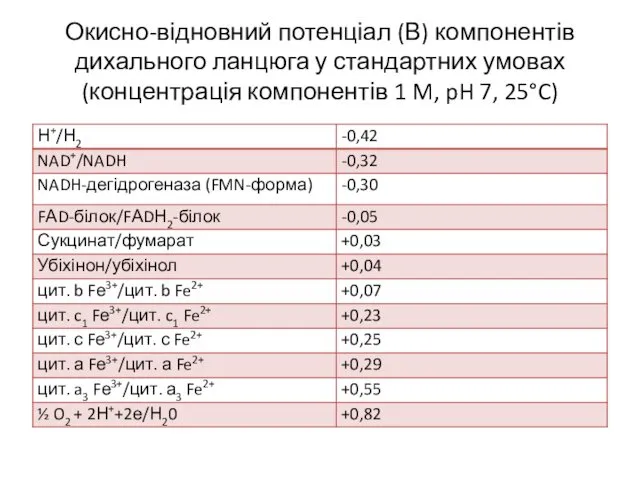
- 18. Окисно-відновний потенціал (В) компонентів дихального ланцюга у стандартних умовах (концентрація компонентів 1 M, pH 7, 25°C)
- 19. Схема електрон-транспортного ланцюга
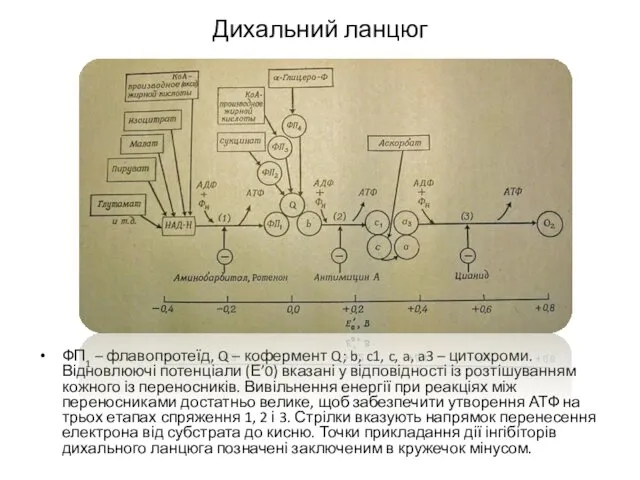
- 20. Дихальний ланцюг ФП1 – флавопротеїд, Q – кофермент Q; b, c1, c, a, a3 – цитохроми.
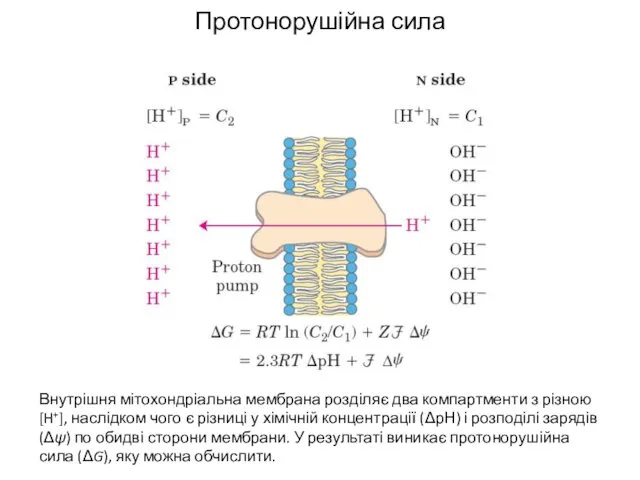
- 21. Протонорушійна сила Внутрішня мітохондріальна мембрана розділяє два компартменти з різною [H+], наслідком чого є різниці у
- 22. Sir Peter D. Mitchell (1920 – 1992) Nobel prize in chemistry (1978) "for his contribution to
- 24. Скачать презентацию



 Природа и люди Древней Индии
Природа и люди Древней Индии Коррекция нарушений осанки у детей с помощью физических упражнений
Коррекция нарушений осанки у детей с помощью физических упражнений Инструкция создания глоссария в дистанционном курсе ИКТ-поддержки
Инструкция создания глоссария в дистанционном курсе ИКТ-поддержки ВКР: Строительство участка городской улицы в Благовещенском районе
ВКР: Строительство участка городской улицы в Благовещенском районе Ладожские богини- труд регулировщиц на Ладожском озере в годы ВОВ, для старшей и подготовительной групп.
Ладожские богини- труд регулировщиц на Ладожском озере в годы ВОВ, для старшей и подготовительной групп. Прикладное творчество - вышивка. 2 класс
Прикладное творчество - вышивка. 2 класс Международные валютные отношения
Международные валютные отношения Имена собственные
Имена собственные Стихи на уроках (часть I)
Стихи на уроках (часть I) Охрана окружающей среды
Охрана окружающей среды Презентация С Днем Знаний
Презентация С Днем Знаний Санкт-Петербургский государственный экономический университет. Сервис транспорта и транспортных систем. Профиль
Санкт-Петербургский государственный экономический университет. Сервис транспорта и транспортных систем. Профиль Викторина Старину мы помним. Старину мы чтим
Викторина Старину мы помним. Старину мы чтим Конструирование швейных изделий
Конструирование швейных изделий Презентация Правильные и полуправильные многогранники к внеклассному занятию по геометрии в старших классах
Презентация Правильные и полуправильные многогранники к внеклассному занятию по геометрии в старших классах Бизнес план. Интернет магазин стикеров
Бизнес план. Интернет магазин стикеров Гомеровская поэтика
Гомеровская поэтика Себестоимость энергетической продукции
Себестоимость энергетической продукции Осенние звуки
Осенние звуки Собака святого Бернара
Собака святого Бернара Презентация Готов ли ваш ребенок к школе
Презентация Готов ли ваш ребенок к школе классный час Я и моя семья
классный час Я и моя семья Инструкция по регистрации на участие в ГИА на официальном портале мэра и правительства Москвы
Инструкция по регистрации на участие в ГИА на официальном портале мэра и правительства Москвы Крупнейшие энергетические компании России
Крупнейшие энергетические компании России Проект модернизации поста текущего ремонта, агрегатов для СТО
Проект модернизации поста текущего ремонта, агрегатов для СТО Потребности в перемещении людей и товаров,
Потребности в перемещении людей и товаров, Создание электронного ассистента, как части прототипа Умного дома
Создание электронного ассистента, как части прототипа Умного дома ВКР: Разработка технологического процесса сборки-сварки конического бункера
ВКР: Разработка технологического процесса сборки-сварки конического бункера