Содержание
- 2. Дисперсные системы – однородные (гомогенные) смеси молекул двух и более веществ; Дисперсные системы могут быть газообразными,
- 3. Дисперсионная среда – компонент раствора, имеющий агрегатное состояние такое же как у всей дисперсной системы; У
- 4. Классификация дисперсных систем Если размер диспергированных частиц меньше 1нм, раствор называют истинным; Если размер диспергированных частиц
- 5. Растворимость Растворимость – предельное количество вещества, которое может раствориться в определенном количестве растворителя (или раствора) в
- 6. Концентрация растворов Весовая процентная концентрация показывает сколько г растворенного вещества содержится в 100 г раствора; Если
- 7. В биологических жидкостях (цитоплазма клеток, плазма крови и пр.) растворено очень много разнообразных соединений, и поэтому
- 8. В химии чаще всего используется молярная концентрация, которая характеризует содержание растворенного вещества в молях в 1
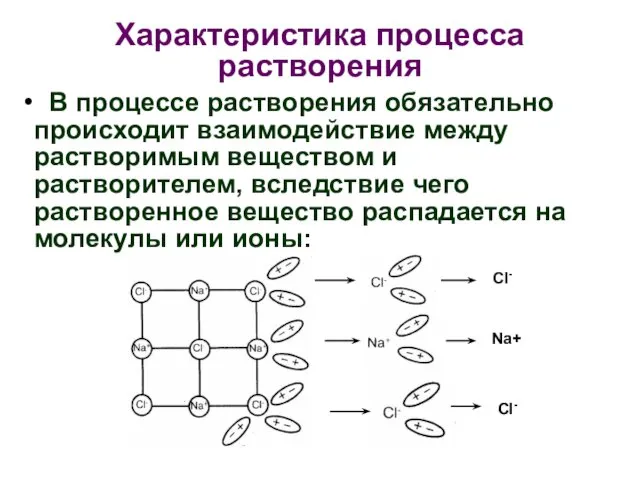
- 9. Характеристика процесса растворения В процессе растворения обязательно происходит взаимодействие между растворимым веществом и растворителем, вследствие чего
- 10. В процессе растворения происходит диффузия: все молекулы растворителя и растворенного вещества вследствие хаотичного движения равномерно распределяются
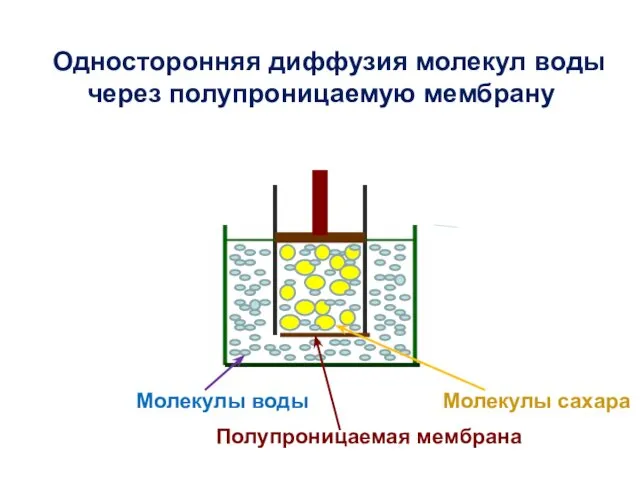
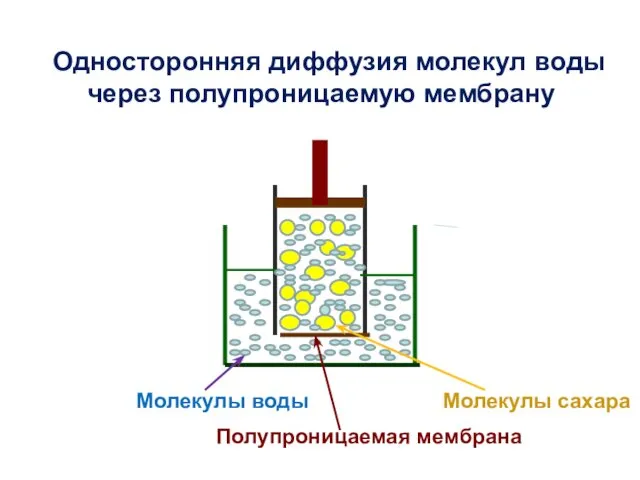
- 11. Молекулы сахара Молекулы воды Полупроницаемая мембрана Односторонняя диффузия молекул воды через полупроницаемую мембрану
- 12. Молекулы сахара Молекулы воды Полупроницаемая мембрана Односторонняя диффузия молекул воды через полупроницаемую мембрану
- 13. Осмотическое давление – гидростатическое давление, вызванное разностью концентрацией: Причиной возникновения осмотического давления является осмос – односторонняя
- 14. Растворы, обладающие одинаковым осмотическим давлением, называются изотоническими или изоосмотическими; Раствор, имеющий более высокое осмотическое давление по
- 15. Внутриклеточное осмотическое давление обычно незначительно превышает внеклеточное; Вследствие этого клетки находятся в напряженном, упругом состоянии и
- 16. Электролитическая диссоциация В процессе растворения некоторые растворяемые вещества могут под действием воды расщепляться на ионы: HNO3
- 17. Количественной характеристикой электролитической диссоциации является степень диссоциации; Степень диссоциации (α) - это отношение числа молекул, распавшихся
- 18. У слабых электролитов степень диссоциации меньше 0,03 или 3 %; Сильные электролиты диссоциируют более чем на
- 19. Тест 1 Процентная концентрация указывает на содержание растворенного вещества в граммах в: а) в 10 г
- 20. Тест 2 Молярная концентрация имеет размерность: а) г/л б) моль/100 мл в) г/100 мл г) моль/л
- 21. Тест 3 Коллоидные растворы содержат частицы размером: а) меньше 1 нм б) от 1 до 100
- 22. Тест 4 Моль любого вещества содержит: а) 3,14 · 106 молекул б) 22,4 · 103 молекул
- 23. Тест 5 Раствор, содержащий в 750 г 15 г растворенного вещества, имеет концентрацию : а) 2
- 24. Тест 6 Истинные растворы отличаются от коллоидных: а) массой б) объемом в) размером растворенных частиц г)
- 25. Тест 7 400 г раствора с концентрацией 5 % содержат: а) 4 г растворенного вещества б)
- 26. Тест 8 Частицы истинных растворов имеют частицы размером: а) меньше 1 нм б) от 1 до
- 27. Тест 9 Растворы с одинаковым осмотическим давлением называются: а) гипотонические б) гипергликемические в) гипертонические г) изотонические
- 29. Скачать презентацию























 Презентация Воздушный транспорт
Презентация Воздушный транспорт Инновационные подходы в преподавании физики и при подготовке к государственной итоговой аттестации в форме ЕГЭ и ОГЭ
Инновационные подходы в преподавании физики и при подготовке к государственной итоговой аттестации в форме ЕГЭ и ОГЭ Информация по сессии в Международном юридическом институте
Информация по сессии в Международном юридическом институте Презентация Информационно-коммуникационные технологии в процессе развития и обучения дошкольников
Презентация Информационно-коммуникационные технологии в процессе развития и обучения дошкольников Друзья-лицеисты Пушкина
Друзья-лицеисты Пушкина презентация Готовимся к школе
презентация Готовимся к школе Игровые технологии в ДОУ
Игровые технологии в ДОУ Великий канон cвятого Андрея Критского, читаемый в четверг пятой седмицы Великого поста
Великий канон cвятого Андрея Критского, читаемый в четверг пятой седмицы Великого поста Классный час Моя малая Родина.
Классный час Моя малая Родина. United Kingdom
United Kingdom Интегрированный урок (математика-география) Применение теоремы Пифагора в сельском хозяйстве
Интегрированный урок (математика-география) Применение теоремы Пифагора в сельском хозяйстве Анализ эмитента на примере ПАО ЛУКОЙЛ
Анализ эмитента на примере ПАО ЛУКОЙЛ Математика, как наука
Математика, как наука Технология сборки двутавровой балки
Технология сборки двутавровой балки ЛЕКЦИЯ 8. Электрические машины постоянного тока. Устройство электрической машины постоянного тока
ЛЕКЦИЯ 8. Электрические машины постоянного тока. Устройство электрической машины постоянного тока Информационная культура. Этические и правовые нормы информационной деятельности челове
Информационная культура. Этические и правовые нормы информационной деятельности челове Формирование и развитие философии науки
Формирование и развитие философии науки БЕЗОПАСНОСТЬ НА ДОРОГАХ
БЕЗОПАСНОСТЬ НА ДОРОГАХ 20 способов провалить интервью в Google
20 способов провалить интервью в Google Музеи мира. Лувр
Музеи мира. Лувр История основания города Петрозаводска
История основания города Петрозаводска Соуси
Соуси Типы и конструкции микроэлектромеханических систем. Сенсоры. Классификация сенсоров
Типы и конструкции микроэлектромеханических систем. Сенсоры. Классификация сенсоров ПЕДАГОГИЧЕСКИЙ СОВЕТ НА ТЕМУ: Формирование правовой компетентности учащихся – предупреждение подростковой преступности и правонарушений.
ПЕДАГОГИЧЕСКИЙ СОВЕТ НА ТЕМУ: Формирование правовой компетентности учащихся – предупреждение подростковой преступности и правонарушений. Учитель года-2012
Учитель года-2012 Преступления против собственности
Преступления против собственности Учимся рисовать вместе. Советы для родителей
Учимся рисовать вместе. Советы для родителей Сообщающиеся сосуды
Сообщающиеся сосуды