Содержание
- 2. Эпиграф урока Три пути ведут к знанию: путь размышления – самый благородный, путь подражания – самый
- 3. «Химический деликатес» Катион Анион Ион Электролиты Неэлектролиты Электропроводность Слабый электролит Сильный электролит Катод Анод Электролитическая диссоциация
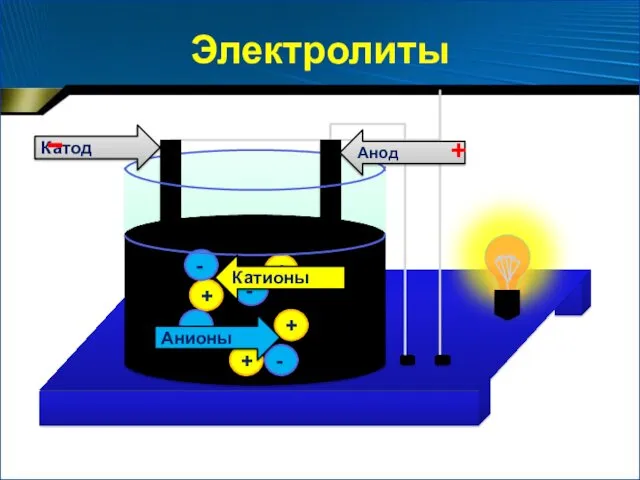
- 4. + + + + - - - - Анионы Катионы Анод Катод - + Электролиты
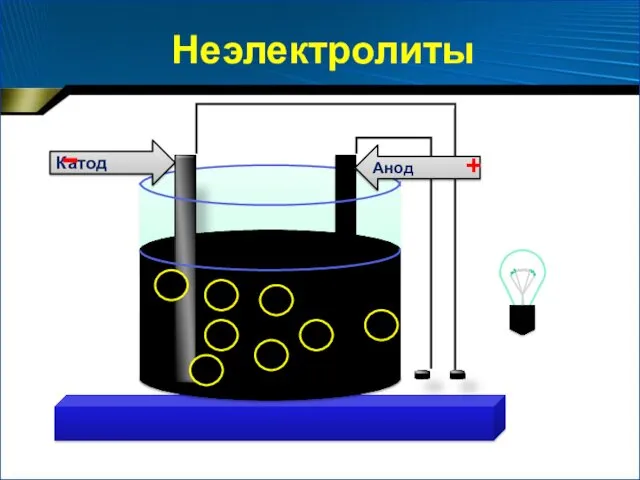
- 5. Анод Катод - + Неэлектролиты
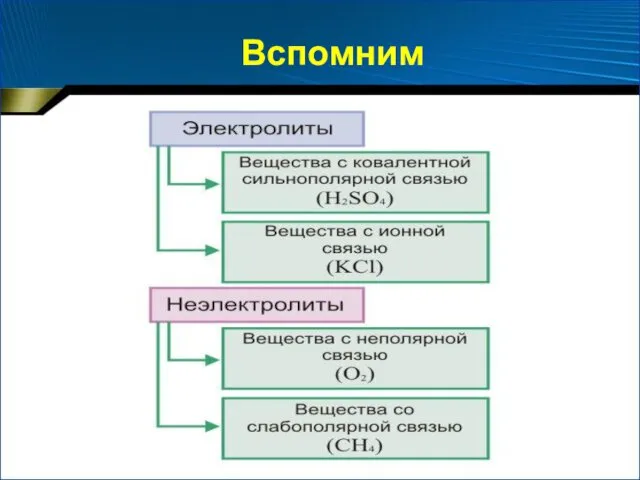
- 6. Вспомним
- 7. Процесс распада электролитов на заряженные частицы ─ ионы называют электролитической диссоциацией («dissociation» ─ разобщение). Основные положения
- 8. Поиграем? 1. Анионы 2. Электролитическая диссоциация 3. Катионы 4. Углекислый газ 5. Электролиты 6. Щелочь 7.
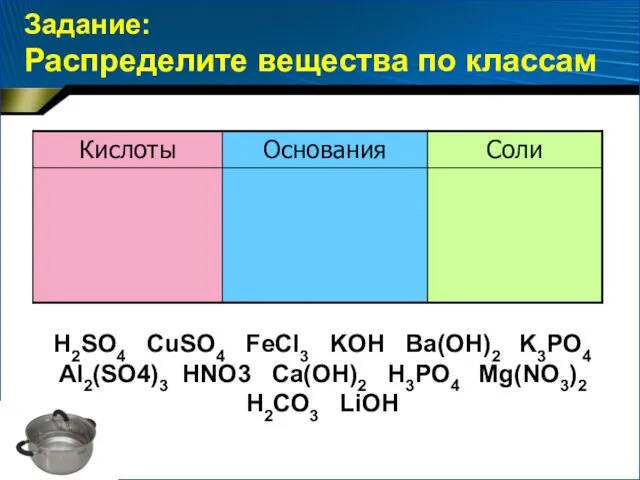
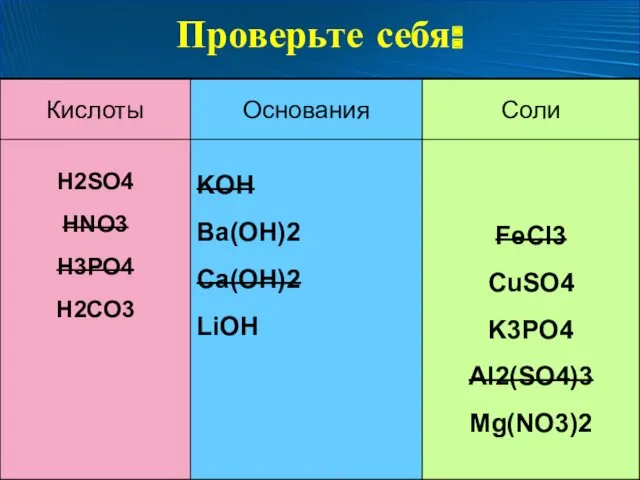
- 9. Задание: Распределите вещества по классам H2SО4 CuSO4 FeCl3 KOH Ba(OH)2 K3PO4 Al2(SO4)3 HNO3 Ca(OH)2 H3PO4 Mg(NO3)2
- 10. Проверьте себя:
- 11. Тема урока «Диссоциация кислот, щелочей и солей»
- 12. - это электролиты, при диссоциации которых в водных растворах в качестве катионов образуются только ионы водорода
- 13. Кислый вкус Изменение окраски индикатора Взаимодействие с некоторыми металлами с выделением водорода обусловлены наличием Общие свойства
- 14. Основания - это электролиты, при диссоциации которых водных растворах в качестве анионов образуются только гидроксид-ионы KOH
- 15. Мыльность на ощупь Едкое действие Изменение окраски индикатора обусловлены наличием Общие свойства щелочей
- 16. Соли - это электролиты, которые диссоциируют на катион металла и анион кислотного остатка NaCl → +
- 17. Обусловлены свойствами всех ионов, которые образуются в процессе диссоциации. Na+ Сl- K+ SO4 2- Al3+ Свойства
- 18. «Третий лишний» Ацетон, хлорид кальция, вода Углекислый газ, водород, соляная кислота Сахар, сульфат натрия, хлорид калия
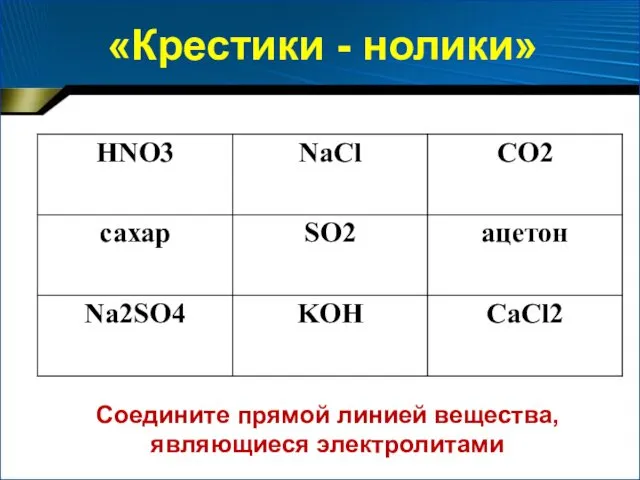
- 19. «Крестики - нолики» Соедините прямой линией вещества, являющиеся электролитами
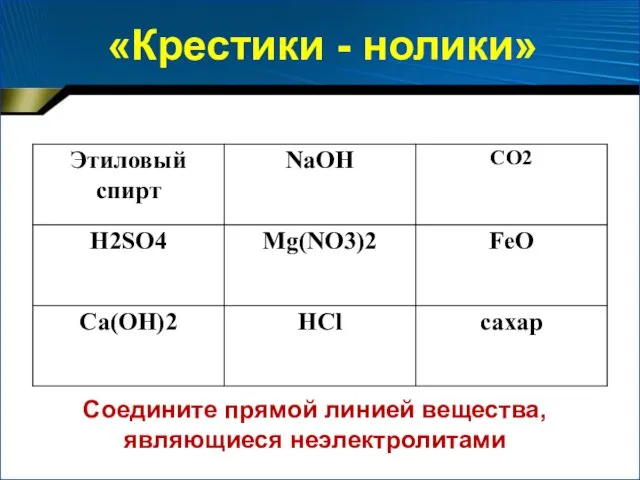
- 20. «Крестики - нолики» Соедините прямой линией вещества, являющиеся неэлектролитами
- 21. Закрепление Составьте уравнения диссоциации кислот, оснований и солей из таблицы, которые мы не рассматривали.
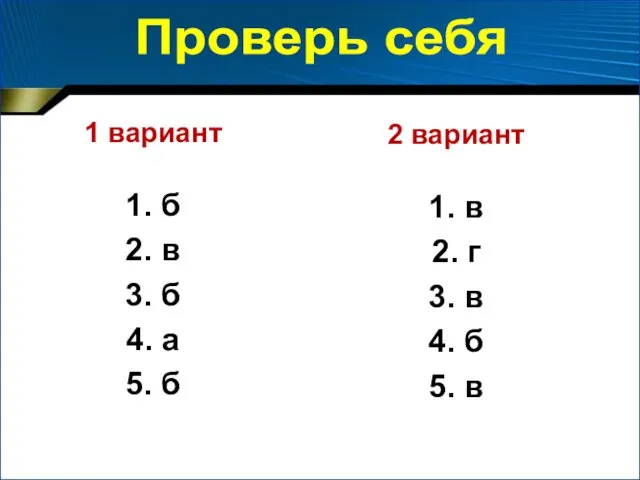
- 22. Тестирование
- 23. 1 вариант 1. б 2. в 3. б 4. а 5. б 2 вариант 1. в
- 24. Химический деликатес Специи?
- 25. Подведем итоги С какими новыми понятиями вы познакомились? Какие трудности вы испытали? Какие понятия вы усвоили
- 26. Подведем итоги Оцените свою работу на уроке по 25-тибалльной шкале: Если сумма баллов, набранных за урок:
- 27. Определите теперь свое место на «скале» знаний В конце урока СКАЛА
- 28. Спасибо за Вашу поддержку и понимание! Удачи при восхождении к новым вершинам знаний!
- 29. В составе воды из минерального источника были обнаружены следующие ионы: а) катионы кальция, натрия, калия, б)
- 31. Скачать презентацию




















 Физиологические механизмы развития тренированности
Физиологические механизмы развития тренированности Реформация – новое отношение к миру, обновление христианства
Реформация – новое отношение к миру, обновление христианства Phonetic drill remember!
Phonetic drill remember! Использование невербальных средств в речевом общении
Использование невербальных средств в речевом общении Методические рекомендации деятельности педагога дополнительного образования в межаттестационный период
Методические рекомендации деятельности педагога дополнительного образования в межаттестационный период Урок по ПДД. 4класс
Урок по ПДД. 4класс Сколько звуков в слове
Сколько звуков в слове Компьютерная графика
Компьютерная графика Compare photos
Compare photos Занятие учебной практики. Дверные петли Врезка дверных петель
Занятие учебной практики. Дверные петли Врезка дверных петель Проценты в виде десятичной дроби
Проценты в виде десятичной дроби Weather - two word adjectives, collocations; causative verbs
Weather - two word adjectives, collocations; causative verbs Биохимия крови
Биохимия крови Строение и функции головного мозга
Строение и функции головного мозга Презентация (1)
Презентация (1) Упрощение выражений
Упрощение выражений О Fit service 2021. Федереальная международная сеть автосервисов
О Fit service 2021. Федереальная международная сеть автосервисов Газетница для хранения газет и журналов
Газетница для хранения газет и журналов Презентация Новогоднее оформление группы в детском саду
Презентация Новогоднее оформление группы в детском саду Проект прогулочный площадки
Проект прогулочный площадки Биография М.Е. Салтыкова-Щедрина
Биография М.Е. Салтыкова-Щедрина Влияние скорости охлаждения при затвердевании на структуру сплавов
Влияние скорости охлаждения при затвердевании на структуру сплавов История создания романа Война и мир. Особенности жанра
История создания романа Война и мир. Особенности жанра Наша Галактика
Наша Галактика день семьи
день семьи История искусств в системе современного гуманитарного знания
История искусств в системе современного гуманитарного знания Планирование и организация рекламной компании ООО ТК-ПРОФИ
Планирование и организация рекламной компании ООО ТК-ПРОФИ Участие медицинской сестры в организации ухода за больными с пневмонией
Участие медицинской сестры в организации ухода за больными с пневмонией