Содержание
- 2. Цель: дать представление о причинах единства всех типов химической связи Задачи. Образовательная: углубить и расширить знания
- 3. Что такое химическая связь? Какова природа химической связи? Войнова Т.А. МБОУ КСОШ №2 г.Рубцовск Алтайский край
- 4. Любая химическая связь образуется только тогда, когда сближение частиц приводит к понижению полной энергии системы. Определяющим
- 5. Причина образования химической связи – стремление системы к минимизации энергии. Энергия образующейся системы – химическое связи
- 6. Войнова Т.А. МОУ "Лицей "Эрудит" г.Рубцовск Алтайский край
- 7. Войнова Т.А. МБОУ КСОШ №2 г.Рубцовск Алтайский край
- 8. Важнейшим фактором характеристики атома является его электроотрицательность Войнова Т.А. МБОУ КСОШ №2 г.Рубцовск Алтайский край
- 9. Определение типа связи(по ЭО): Равная ЭО – ковалентная неполярная; Разность ЭО Разность ЭО > 1,7 –
- 10. Кристаллические решётки веществ – это упорядоченное расположение частиц(атомов, молекул, ионов) в строго определённых точках пространства. Точки
- 11. Ионные Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью.
- 12. Атомные Атомными называют кристаллические решётки, в узлах которых находятся отдельные атомы, которые соединены очень прочными ковалентными
- 13. Молекулярные Молекулярными называют кристаллические решётки, в узлах которых располагаются молекулы. Химические связи в них ковалентные, как
- 14. Металлические Металлическими называют решётки, в узлах которых находятся атомы и ионы металла. Для металлов характерны физические
- 15. Войнова Т.А. МБОУ КСОШ №2 г.Рубцовск Алтайский край
- 16. Войнова Т.А. МБОУ КСОШ №2 г.Рубцовск Алтайский край
- 17. Войнова Т.А. МБОУ КСОШ №2 г.Рубцовск Алтайский край
- 18. Войнова Т.А. МБОУ КСОШ №2 г.Рубцовск Алтайский край
- 19. Какова природа возникновения химической связи? Электронно-ядерное взаимодействие атомов, сопровождающееся выделением энергии Часто встречаются соединения в которых
- 20. N H H H Cl - [ [ * * * * * . . .
- 21. В зависимости от условий,возможен переход от одного вида связи в другой: При электролитической диссоциации, соединения с
- 22. Тест Войнова Т.А. МБОУ КСОШ №2 г.Рубцовск Алтайский край
- 23. Тест Войнова Т.А. МБОУ КСОШ №2 г.Рубцовск Алтайский край
- 24. Самопроверка в б б б в б а а б Войнова Т.А. МБОУ КСОШ №2 г.Рубцовск
- 25. Рефлексия: что? какой? зачем? Домашнее задание: - повторить § 6; - выполнить упр. 3,4,6 гл.3 Кузьменко.
- 27. Скачать презентацию
 Исполнительная власть в Российской Федерации
Исполнительная власть в Российской Федерации СРС: Хирургиядағы Заманауи синтетикалық материалдар
СРС: Хирургиядағы Заманауи синтетикалық материалдар Документирование программного обеспечения. Типы документации
Документирование программного обеспечения. Типы документации Учет возрастных особенностей детей в процессе организации здоровьесберегающей деятельности педагога
Учет возрастных особенностей детей в процессе организации здоровьесберегающей деятельности педагога Обоснование энергосберегающих технологий погружения винтовых свай и якорей
Обоснование энергосберегающих технологий погружения винтовых свай и якорей Презентации моих учеников
Презентации моих учеников Презентация Артикуляционная гимнастика
Презентация Артикуляционная гимнастика Маленькие герои большой войны
Маленькие герои большой войны Путешествие по Кругобайкалке
Путешествие по Кругобайкалке Английские надписи на одежде и их влияние на культуру современных подростков
Английские надписи на одежде и их влияние на культуру современных подростков Радиоавтоматика. Частотные критерии устойчивости линейных систем
Радиоавтоматика. Частотные критерии устойчивости линейных систем Анализ вакансий, заявленных работодателями в органы службы занятости населения Ханты-Мансийского автономного округа – Югры
Анализ вакансий, заявленных работодателями в органы службы занятости населения Ханты-Мансийского автономного округа – Югры Цветок
Цветок Системный инжиниринг (продолжение)
Системный инжиниринг (продолжение) Загальна характеристика і особливості систем мобільного зв'язку
Загальна характеристика і особливості систем мобільного зв'язку Арифметико-логическое устройство
Арифметико-логическое устройство Внеклассное мероприятие по здоровьесбережению: Путешествие в здоровляндию.
Внеклассное мероприятие по здоровьесбережению: Путешествие в здоровляндию. Excursion. Aivazovsky in the Tretyakov gallery
Excursion. Aivazovsky in the Tretyakov gallery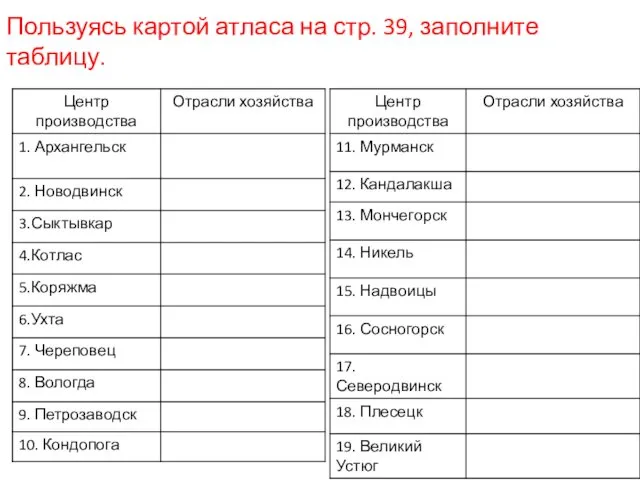 Северный экономический район
Северный экономический район Система образования в Японии
Система образования в Японии Расчет технико-экономических показателей работы малярного отделения
Расчет технико-экономических показателей работы малярного отделения 567523a3562239fa4042597efb6ceaea
567523a3562239fa4042597efb6ceaea Признаки делимости на 2, 5, 10
Признаки делимости на 2, 5, 10 Интерактивная игра Ямал-край Земли
Интерактивная игра Ямал-край Земли Rolul diferitor culturi în restabilirea fertilității solului
Rolul diferitor culturi în restabilirea fertilității solului Урок кубановедения в 7 классе по тем Основание Екатеринодара
Урок кубановедения в 7 классе по тем Основание Екатеринодара ПрезентацияФормирование сенсорных эталонов у детей младшего дошкольного возраста и их значение для дальнейшего успешного развития ребёнка
ПрезентацияФормирование сенсорных эталонов у детей младшего дошкольного возраста и их значение для дальнейшего успешного развития ребёнка Современные методы лечения кариеса
Современные методы лечения кариеса