Слайд 2

Ранние модели строения атома
«Пудинг с изюмом»
(1902-1904 г. Дж. Томсон)
«Планетарная» (1907 г.
Э. Резерфорд)
«Модель Бора» (1913 г.)
Слайд 3

Современная модель атома
Атом – электронейтральная частица
Ядро атома – положительно заряженное
Электроны –
отрицательно заряженные
Электроны вращаются вокруг ядра с определённой скоростью
Электроны имеют
двойственную природу
Слайд 4

Состав ядра атома
Протоны.
Масса = 1, заряд = +1
Нейтроны.
Масса = 1,
заряд = 0
Заряд ядра определяется количеством протонов
Количество протонов соответствует порядковому номеру элемента в ПСХЭ
Слайд 5

Изотопы
Изотопы – совокупность атомов, имеющих одинаковое число протонов, но различающихся количеством
нейтронов в ядре атома.
Изотопы различны атомной массой (А)
Число нейтронов определяется по формуле: N = A – Z, где Z – порядковый номер элемента
Слайд 6

Частицы микромира
Корпускулярно-волновой дуализм
Электрон – частица с массой
m1= 9*10-28, скорость 108
см/сек,
заряд -1
Эксперименты в 1927 г. подтвердили явления дифракции и интерференции.
Слайд 7

Важные понятия
Электронное облако – пространство около ядра атома, где сосредоточены вся
масса электрона и электронная плотность
Атомная орбиталь – часть э.о., где сосредоточено >90% электронной плотности
Радиус АО – расстояние от ядра атома до максимальной электронной плотности
Слайд 8

Квантовые числа
Квантовые числа описывают состояние электрона в атоме
n – главное квантовое
число, хар-т общую энергию электрона данного уровня, номер периода в ПСХЭ соотв-т к-ву энергетических уровней в атоме, n принимает целые значения
Слайд 9

Квантовые числа
l – побочное квантовое число; уточняет запас энергии электрона на
энергетическом уровне, хар-т связь e с ядром, а так же форму АО. Значения от 0 до n-1
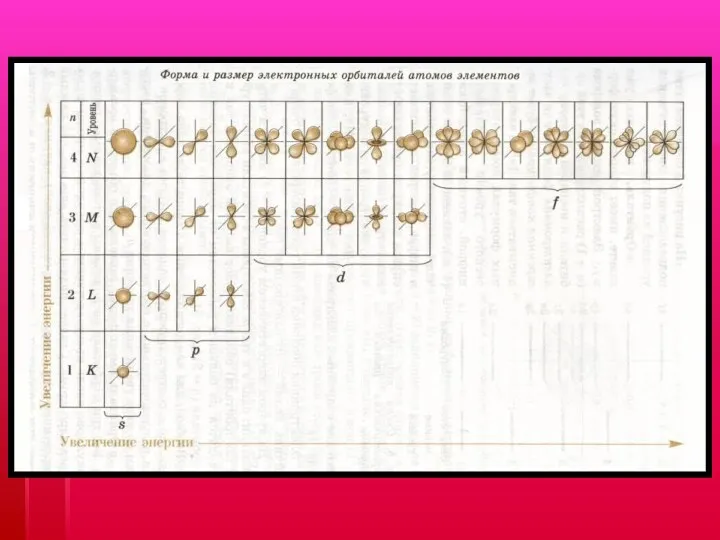
l=0 – подуровень s, форма орбитали сферическая
l=1 – подуровень p, объёмная форма орбитали
l=2 – подуровень d, более сложная форма орбитали
l=3 – подуровень f, более сложная форма орбитали
Номер э.у. соответствует к-ву подуровней на данном энергетическом уровне
Слайд 10
Слайд 11

Квантовые числа
m1 – магнитное орбитальное квантовое число
соответствует распределению АО в пространстве
около ядра
Определяет количество АО
Принимает значения -1, 0, +1
Слайд 12

Квантовые числа
ms – магнитное спиновое квантовое число характеризует чисто квантовое свойство
электрона
Это собственный момент импульса электрона
Абсолютное значение спина = ½
Проекция спина на ось может иметь лишь два значения: ms=+1/2; ms=-1/2
Слайд 13

Принципы заполнения электронных оболочек
Принцип минимальной энергии:
принцип Паули
правило Хунда
правило Клечковского
Слайд 14

Несоблюдение принципа Паули
При несоблюдении принципа Паули на АО в атоме были
бы электроны с одинаковыми значениями всех квантовых чисел, т.е. в ячейки могут попасть электроны с параллельными спинами
Слайд 15

Несоблюдение правила Хунда
При несоблюдении правила Хунда суммарный спин не будет максимальным,
а это соответствует большему значению энергии атома. Такое состояние считается неустойчивым, что соответствует возбуждённому состоянию атома
Слайд 16

Правило Клечковского
Заполнение электронами орбиталей в атоме происходит в порядке возрастания суммы
главного и орбитального квантовых чисел n + l. При одинаковой сумме раньше заполняется орбиталь с меньшим значением n.
Слайд 17

Электронные семейства
s-элементы, если заполняется s-подуровень
p-элементы, если заполняется p-подуровень
d-элементы, если заполняется d-подуровень
f-элементы,
если заполняется f-подуровень
Слайд 18

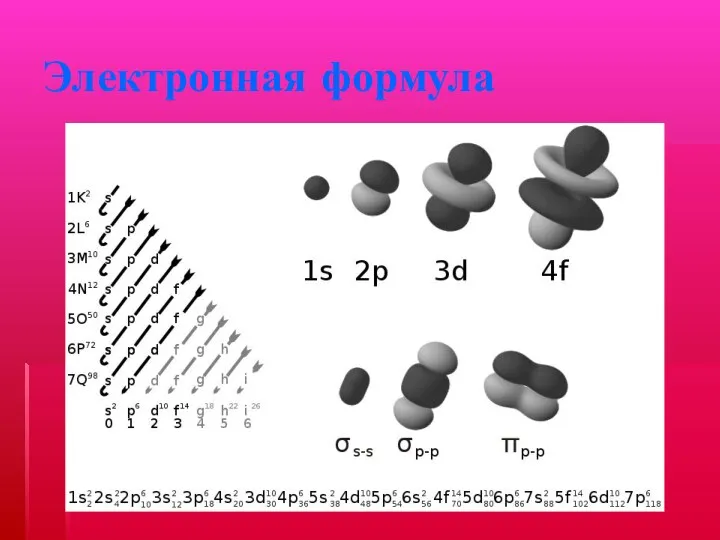
Электронная формула
Электронная формула атома химического элемента показывает как распределяются электроны в
атоме, учитывая их характеистику квантовыми числами
109 Mt мейтнерий
1s22s22p63s23p64s23d104p65s24d105p66s2
4f145d106p67s25f146d7
Слайд 19
Слайд 20

«Провал» электрона
В атомах некоторых элементов электрон с s-подуровня внешнео энергетического уровня
переходит на d-подуровень предвнешнего энергетического уровня. Идёт выигрыш в энергии. Атом считается симметричным, т.е. либо большинство электронов становятся неспаренными либо спаренными
Слайд 21
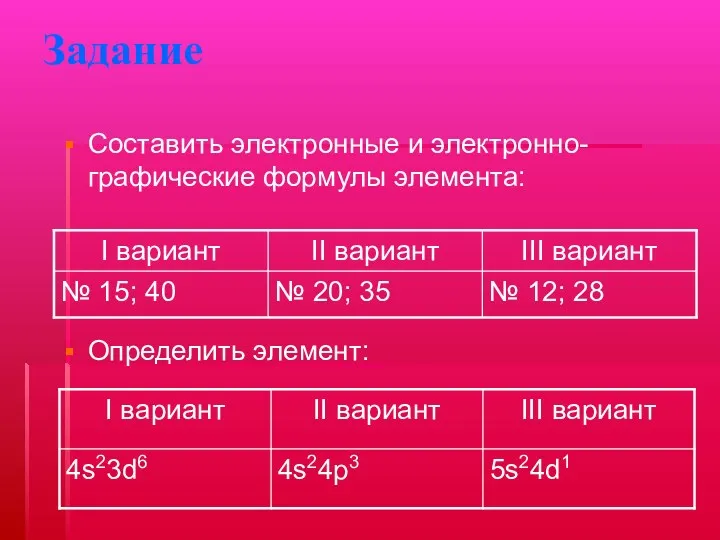
Задание
Определить элемент:
Составить электронные и электронно-графические формулы элемента:
Слайд 22
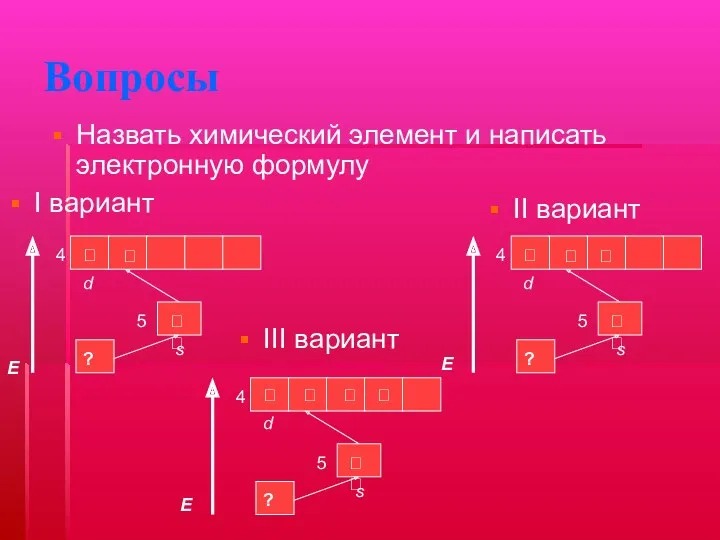
Вопросы
I вариант
Назвать химический элемент и написать электронную формулу
III вариант





















 Конкурс Фото-сказка Курочка Ряба
Конкурс Фото-сказка Курочка Ряба Презентация Дагестанская культура
Презентация Дагестанская культура Влияние сотовых телефонов на здоровье человека
Влияние сотовых телефонов на здоровье человека Цифровые терминалы защиты SRPAM
Цифровые терминалы защиты SRPAM Представление учителя истории и обществознания первой квалификационной категории ГБОУ сош школы-интерната №2 Адмиралтейского района Санкт-Петербурга Полонской Галины Викторовны
Представление учителя истории и обществознания первой квалификационной категории ГБОУ сош школы-интерната №2 Адмиралтейского района Санкт-Петербурга Полонской Галины Викторовны Лексикалық қосымшалар тәсілі. Екінші тілдің тепе-тең бірліктерін іріктеп алу дағдысы
Лексикалық қосымшалар тәсілі. Екінші тілдің тепе-тең бірліктерін іріктеп алу дағдысы Сущность и основные характеристики вокзальных комплексов (вокзалов)
Сущность и основные характеристики вокзальных комплексов (вокзалов) Презентация1
Презентация1 Конспект открытого интегрированного урока (биология, география , история) в 7-9 классах по теме: Северный Ледовитый океан: экология, история, современность
Конспект открытого интегрированного урока (биология, география , история) в 7-9 классах по теме: Северный Ледовитый океан: экология, история, современность Дети герои Великой Отечественной войны
Дети герои Великой Отечественной войны Аутсорсинг. Аутсорсинговая компания
Аутсорсинг. Аутсорсинговая компания Средства поддержки принятия решений. Лекция 3. Тема 5
Средства поддержки принятия решений. Лекция 3. Тема 5 Кабинет географии
Кабинет географии Что такое зоопарк
Что такое зоопарк Разновидности текстильной куклы
Разновидности текстильной куклы Адаптация ребенка к детскому саду
Адаптация ребенка к детскому саду Имя прилагательное
Имя прилагательное Биотические связи в природе
Биотические связи в природе Измерение крупногабаритных деталей с высокой точностью с использованием мостовых КИМ Coord3 и специализированной оснастки Alufix
Измерение крупногабаритных деталей с высокой точностью с использованием мостовых КИМ Coord3 и специализированной оснастки Alufix Портфолио учителя-логопеда
Портфолио учителя-логопеда Гигиена воды и водоснабжения. (Лекция 7-8)
Гигиена воды и водоснабжения. (Лекция 7-8) Латеральное мышление (35)
Латеральное мышление (35) Поездка в Крым
Поездка в Крым E-training Domination Production Seminar
E-training Domination Production Seminar Монастырь. Монашеские обеты. Святость
Монастырь. Монашеские обеты. Святость Альбом квазиомонимов часть 1
Альбом квазиомонимов часть 1 Я и мое здоровье. Презентация для классных часов
Я и мое здоровье. Презентация для классных часов Россия памятью жива!
Россия памятью жива!