Содержание
- 2. Элементы термодинамики Задача термодинамики – изучение свойств тел (систем), характеризуемых набором макроскопических парамет-ров, на основе так
- 3. Место термодинамики в естествознании Введено понятие температуры (нулевой закон термодинамики). Дана формулировка закона сохранения энергии в
- 4. Внутренняя энергия. Работа Работа по расширению газа равна: (13.1) для идеального газа Кинетическую энергию Ек –
- 5. Теплота Совокупность микроскопических процессов (т.е. захватывающих не все тело сразу, а только отдельные группы молекул), приводящих
- 6. Теплоемкость (13.3) – молярная; – молярная Теплоемкость тела (вещества) – величина, равная количеству тепла, которое необходимого
- 7. Теплоемкость По определению (13.5) Здесь – величина, определяемая экспериментально из изобарического теплового расширения газа
- 8. Теплоемкость Для идеального газа: – уравнение Майера (13.6) (13.7) Здесь i – число степеней свободы молекул
- 9. Работа, совершаемая в изо-процессах Изо - процессы: Изо-V: Изо-Т: (13.9) Процесс: Рассматриваем только равновесные: т.к. Изо-р:
- 10. Адиабатический процесс (13.12) (13.13) (13.14) (13.13 а) Адиабатические процессы – это процессы, происходящие без теплообмена с
- 11. Политропные (политропические) процессы (13.15) Политропные (политропические) процессы – процессы, протекающие при постоянной теплоемкости С: т.е. Изо-Т
- 12. Адиабатические и политропные процессы для изотермы для адиабаты
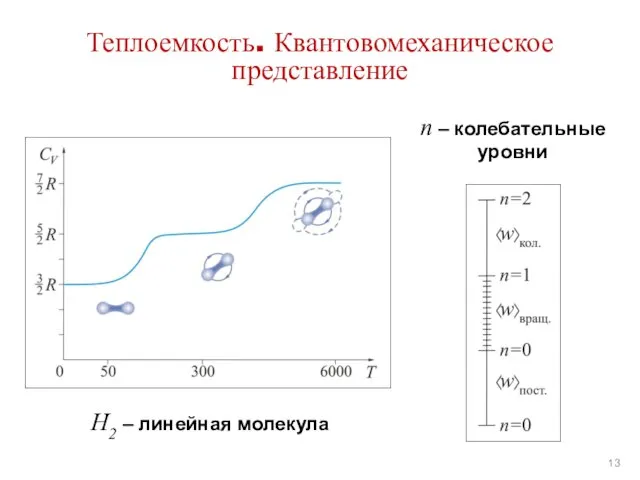
- 13. Теплоемкость. Квантовомеханическое представление n – колебательные уровни H2 – линейная молекула
- 14. Термодинамика. Предыстория Эволюция основного закона природы – Закона сохранения вещества и энергии: 1686 – Г. Лейбниц
- 15. Термодинамика. Предыстория Формулировка Р. Майера: «Движение, теплота, и, как мы намерены показать в дальнейшем, электричество представляют
- 17. Скачать презентацию













 Презентация к конспекту Прекрасные бабочки - Цикламены
Презентация к конспекту Прекрасные бабочки - Цикламены Учет и аудит наличия, движения и использования материально-производственных запасов в СПК (колхоз) имени Куйбышева Кинельского района
Учет и аудит наличия, движения и использования материально-производственных запасов в СПК (колхоз) имени Куйбышева Кинельского района White and red? if you mix blue and red …
White and red? if you mix blue and red … Отопление зданий
Отопление зданий Презентация Сколько весит здоровье ученика
Презентация Сколько весит здоровье ученика История Древнего Египта
История Древнего Египта Объём прямоугольного параллелепипеда
Объём прямоугольного параллелепипеда Презентация программы дополнительного образования детей 1 класса
Презентация программы дополнительного образования детей 1 класса Цирроз печени
Цирроз печени Физминутка Герои диснея
Физминутка Герои диснея Классификация строительных машин
Классификация строительных машин Клинические синдромы в пульмонологии
Клинические синдромы в пульмонологии Влияние различных фракций гумуса на рост и развитие Avena Sativa L
Влияние различных фракций гумуса на рост и развитие Avena Sativa L Размеры Окон Сергиев Посад финал
Размеры Окон Сергиев Посад финал Однофазные АД. Синхронные машины. Машины постоянного тока
Однофазные АД. Синхронные машины. Машины постоянного тока Презентация к занятию по риторике № 2. Чему учит наука риторика
Презентация к занятию по риторике № 2. Чему учит наука риторика Покров Пресвятой Богородицы. Народные приметы
Покров Пресвятой Богородицы. Народные приметы Школьный этап Я - лидер
Школьный этап Я - лидер Этикет в Древней Руси
Этикет в Древней Руси Определение областей разрушения горной породы и осевых нагрузок на долота
Определение областей разрушения горной породы и осевых нагрузок на долота Портфолио классного руководителя.
Портфолио классного руководителя. History of the Koenigsegg company
History of the Koenigsegg company Формы и их элементы управления в редакторе Visual Basic
Формы и их элементы управления в редакторе Visual Basic Война за независимость. Образование США
Война за независимость. Образование США СРЕДА
СРЕДА Особенности строительства и преимущества деревянных домов
Особенности строительства и преимущества деревянных домов Звонкие парные согласные на конце и в середине слова
Звонкие парные согласные на конце и в середине слова Понятийный аппарат научного исследования, его содержание и характеристика
Понятийный аппарат научного исследования, его содержание и характеристика