Содержание
- 2. Дисциплина «Химия» 1. Цели и задачи дисциплины Целью изучения дисциплины «Химия» является фундаментальная подготовка студентов по
- 3. Дисциплина «Химия» 2. Требования к результатам освоения дисциплины В результате освоения дисциплины студент должен демонстрировать освоение
- 4. Дисциплина «Химия» Дисциплина рассчитана на 1 семестр. В соответствии с учебным планом дисциплины в течение 1
- 5. Дисциплина «Химия» Методические материалы, для подготовки к занятиям Рабочая тетрадь по дисциплине "Химия" Методические указания к
- 6. Омский государственный технический университет Дисциплина «Химия» Лектор – к.х.н., доцент Букашкина Татьяна Леонидовна Строение атома и
- 7. АТОМ Атом (от греческого atomos - неделимый) — одноядерная, неделимая химическим путем частица химического элемента, носитель
- 8. Состав атома Ядро (состоит из положительно заряженных протонов и нейтронов) электроны, которые формируют электронное облако.
- 9. Характеристики элементарных частиц Масса атома в основном определяется массой его ядра, поскольку масса электрона примерно в
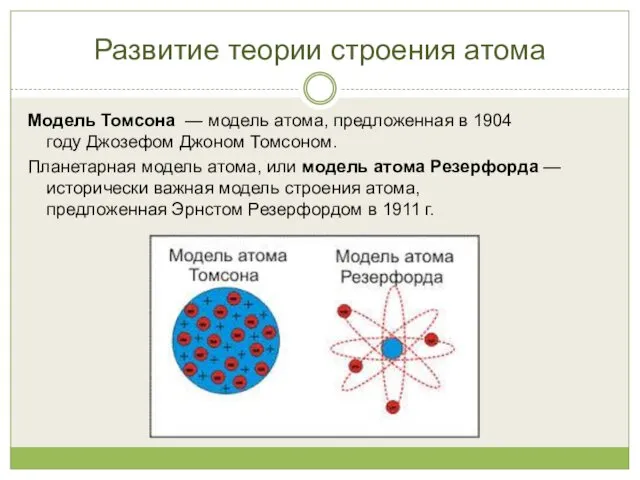
- 10. Развитие теории строения атома Модель Томсона — модель атома, предложенная в 1904 году Джозефом Джоном Томсоном.
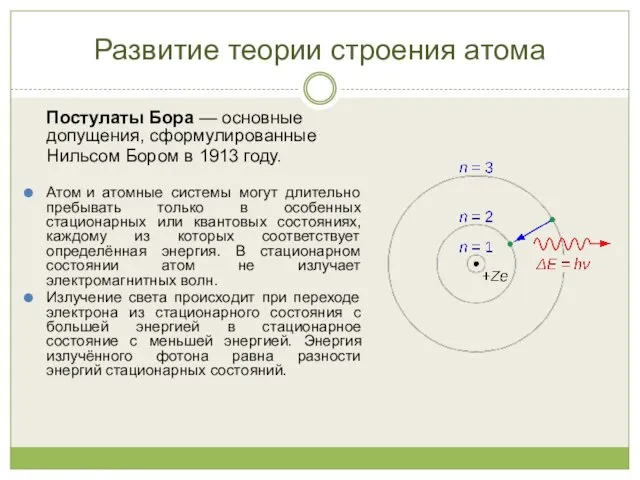
- 11. Развитие теории строения атома Постулаты Бора — основные допущения, сформулированные Нильсом Бором в 1913 году. Атом
- 12. Развитие теории строения атома КВАНТОВО-МЕХАНИЧЕСКАЯ МОДЕЛЬ АТОМА
- 13. Главное квантовое число Главное квантовое число n - характеризует энергию электронов, которые занимают конкретный энергетический уровень
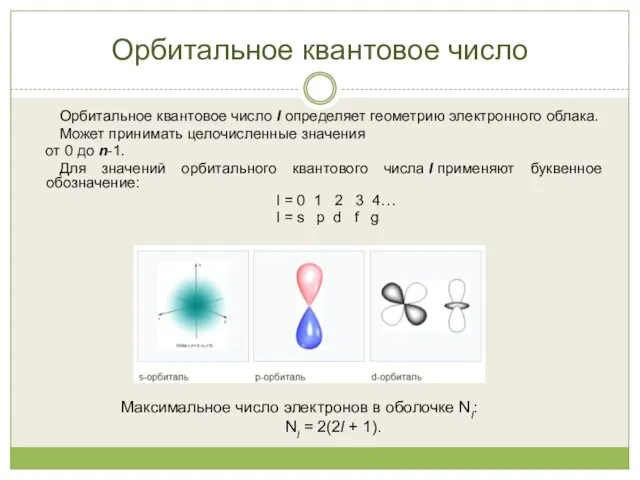
- 14. Орбитальное квантовое число Орбитальное квантовое число l определяет геометрию электронного облака. Может принимать целочисленные значения от
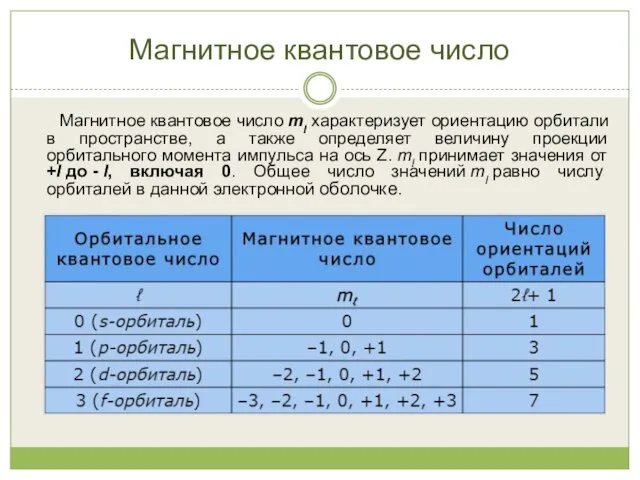
- 15. Магнитное квантовое число Магнитное квантовое число ml характеризует ориентацию орбитали в пространстве, а также определяет величину
- 16. Спиновое квантовое число Электрон обладает собственным моментом импульса - спином, обозначающимся квантовым числом ms. Спин электрона
- 17. Квантовые числа Четыре квантовых числа описывают состояние электрона в атоме и характеризуют энергию электрона, его спин,
- 18. Правила и порядок заполнения атомных орбиталей Принцип Паули В атоме не может быть двух электронов со
- 19. Правила и порядок заполнения атомных орбиталей Принцип наименьшей энергии В атоме каждый электрон стремится занять положение,
- 20. Правила и порядок заполнения атомных орбиталей Последовательность заполнения орбиталей электронами определяется правилами Клечковского: орбитали заполняются электронами
- 21. Правила и порядок заполнения атомных орбиталей Эмпирическое правило Клечковского и вытекающее из него схема очерёдностей несколько
- 22. Правила и порядок заполнения атомных орбиталей Исключения
- 23. Правила и порядок заполнения атомных орбиталей Правило Гунда (Хунда) Заполнение энергетических уровней происходит таким образом, чтобы
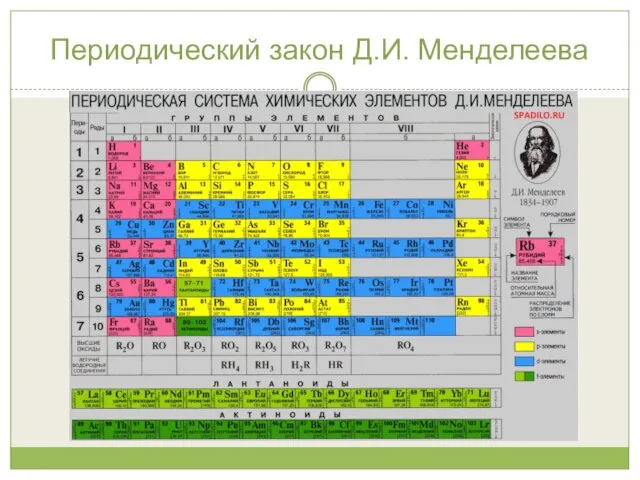
- 24. Периодический закон Д.И. Менделеева Периодическая система химических элементов (таблица Менделеева) —классификация химических элементов, устанавливающая зависимость различных
- 25. Периодический закон Д.И. Менделеева
- 26. Периодический закон Д.И. Менделеева Периодическая таблица систематизирует не только элементы, но и самые разнообразные их свойства.
- 27. Периодический закон Д.И. Менделеева б) Закономерности, связанные с окислительно-восстановительными свойствами. Изменения электроотрицательности элементов. Перечисленные выше причины
- 28. Периодический закон Д.И. Менделеева в) Закономерности, связанные с размерами атомов. Размеры атомов (АТОМНЫЕ РАДИУСЫ) при перемещении
- 29. Периодический закон Д.И. Менделеева г) Закономерности, связанные с валентностью элементов. Элементы одной и той же подгруппы
- 31. Скачать презентацию























 НовоеП
НовоеП Площадь Академгородка. Реконструкция
Площадь Академгородка. Реконструкция Prezentatsia
Prezentatsia Роль капитала в развитии инновационного потенциала Нижегородской области
Роль капитала в развитии инновационного потенциала Нижегородской области Гломерулонефриты у детей
Гломерулонефриты у детей Знатоки безопасности(задания для старших дошкольников)
Знатоки безопасности(задания для старших дошкольников) Семинар формир. и оценка РУУД
Семинар формир. и оценка РУУД Средства выразительности
Средства выразительности Родительское собрание по теме: Не хочу делать уроки
Родительское собрание по теме: Не хочу делать уроки Опистрохоз. Причины описторхоза
Опистрохоз. Причины описторхоза Системы счисления перевод чисел
Системы счисления перевод чисел Прадедушка участник Великой Отечественной войны - Попов Иван Николаевич
Прадедушка участник Великой Отечественной войны - Попов Иван Николаевич Школьная студия Кадр 39
Школьная студия Кадр 39 История развития компьютерной техники (первое поколение ЭВМ)
История развития компьютерной техники (первое поколение ЭВМ) Нарушение полового развития у девочек
Нарушение полового развития у девочек Жаңадан шыққан техникалар
Жаңадан шыққан техникалар Перелетные птицы
Перелетные птицы Этикет
Этикет Газовые законы
Газовые законы Сложение и вычитание дробей с одинаковыми знаменателями. 5 класс
Сложение и вычитание дробей с одинаковыми знаменателями. 5 класс Общая характеристика Азиатско-Тихоокеанского региона
Общая характеристика Азиатско-Тихоокеанского региона Месторождения хрома
Месторождения хрома презентацияfnjkadfjkbgk
презентацияfnjkadfjkbgk Замысел, история создания, жанр и композиция романа История одного города, М.Е. Салтыков-Щедрин
Замысел, история создания, жанр и композиция романа История одного города, М.Е. Салтыков-Щедрин Возникновение ислама
Возникновение ислама Война за независимость. Образование США
Война за независимость. Образование США Музейный урок В гостях у самовара
Музейный урок В гостях у самовара Имя существительное. Проверка знаний (2 класс)
Имя существительное. Проверка знаний (2 класс)