Содержание
- 2. Д.И.Менделеев «Наука начинается с тех пор, как начинают измерять» Портрет, написанный в 1886 г. художником Ярошенко
- 3. Масса вещества. Абсолютная масса атома. Относительная атомная масса. Относительная молекулярная масса. Количество вещества. Число Авогадро. Молярная
- 4. Масса вещества Обозначение m Единицы измерения килограммам (кг) грамм (г) миллиграмм (мг) Форма записи m (Cu)
- 5. Абсолютная масса атома Обозначение mа Единицы измерения килограмм (кг) атомная единица массы (а.е.м.) Форма записи mа
- 6. Относительная атомная масса Обозначение Аr Единицы измерения безмерная Форма записи Аr(О) = 16 Относительная атомная масса
- 7. Относительная молекулярная масса Обозначение Мr Единицы измерения безмерная Форма записи Мr(О2) = 16 ∙ 2 =
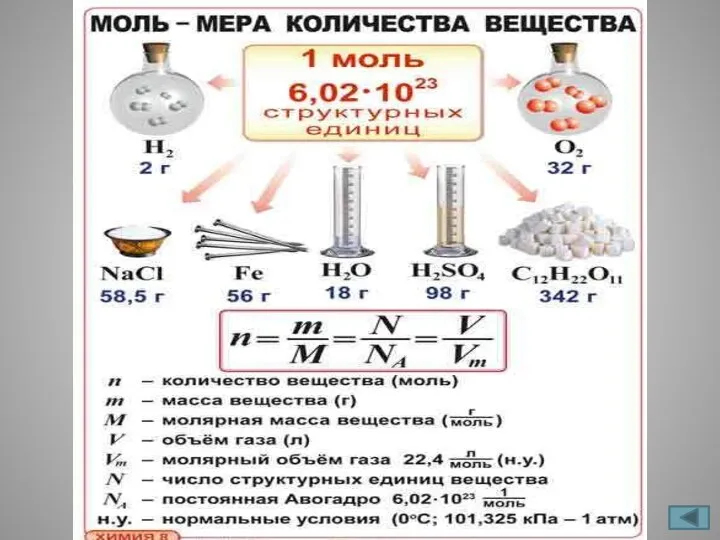
- 8. Количество вещества Обозначение n(эн), ν (ню) Единицы измерения моль Форма записи n(СО2) =1,2 моль Количество вещества
- 9. Число Авогадро(постоянная Авогадро) Обозначение NА Единицы измерения моль в минус первой степени моль-1(1/моль) Форма записи моль-1
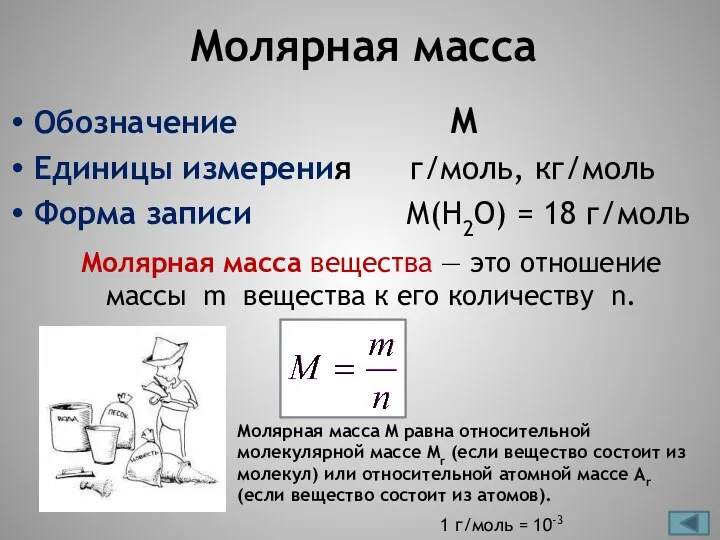
- 10. Молярная масса Обозначение М Единицы измерения г/моль, кг/моль Форма записи М(Н2О) = 18 г/моль Молярная масса
- 11. Значение молярной массы вещества определяется его качественным и количественным составом, т.е. зависит от Mr и Ar.
- 12. Объём Обозначение V Единицы измерения кубический метр(м3) литр (л) Форма записи V(О2) = 0,1 м3 V(О2)
- 13. Молярный объём Обозначение Vm Единицы измерения кубический метр на моль(м3/моль) литр на моль (л/моль) Форма записи
- 14. А. Авогадро 1811 Итальянский ученый Амадео Авогадро сформулировал закон (для газов) 1811г.: в равных объемах различных
- 16. Плотность вещества Обозначение ρ (ро) Единицы измерения килограмм на кубический метр (кг/м3) грамм на кубический сантиметр
- 17. Относительная плотность газов Обозначение D Единицы измерения безмерная величина Форма записи DH2(О2)= Mr(О2)/Mr(H2) = =32/2=16 Относительная
- 18. Массовая доля элемента в веществе Обозначение ω (омега) Единицы измерения проценты(%) или доли Форма записи ω
- 19. Массовая доля вещества в растворе или в смеси Обозначение ω (омега) Единицы измерения проценты(%) или доли
- 20. Объёмная доля газа в смеси Обозначение φ(фи) Единицы измерения проценты(%) или доли Форма записи φ(О2)= 20%
- 21. Молярная концентрация Обозначение С (це) Единицы измерения моль/м3 моль/л Форма записи С(НCl)=2 моль/м3 С(НCl)=2∙10-3 моль/л Молярная
- 22. Температура Форма записи T = 273,16 K t0 = 200C t0F = 1000F Формулы перевода шкал
- 23. Тепловой эффект химической реакции Обозначение Q (ку) Единицы измерения Джоуль (Дж) Форма записи Q = 315
- 24. Литература, интернет-ресурсы. http://ukrainemade.com/ru/category/measurement_and_analysis_instruments/5590/ http://realityzone.ru/gipotezy/595-voda-samyj-bolshoj-nakopitel.html http://www.gidrologia.ru/tags/kislorod-v-vode http://www.alhimik.ru/teleclass/konspect/konsp3-14.shtml http://estnauki.ru/himiya/4-himiya/628-kolichestvo-veshestva-mol.html http://school.xvatit.com/index.php?title https://bb31e6b6-a-62cb3a1a-s-sites.googlegroups.com/site/himulacom/zvonok-na-urok/8-klass/urok-no16-mol-edinica-kolicestva-vesestva-molarnaa-massa/Vjkm3.jpg?attachauth=ANoY7co1hqbkLitCHtM_y0iIwVChJu_hrSNGo1o2tyaxQXR4 http://kurs.ido.tpu.ru/courses/chemistry/mod_2.html http://www.habit.ru/35/184.html http://festival.1september.ru/articles/622383/ http://learning.9151394.ru/course/view.php?id=12939 http://oadk.at.ua/load/khimija/lekcii_po_khimii/55 http://lib2.znate.ru/docs/index-317005.htm http://himik.pro/smesi-i-splavyi/massovaya-dolya-veshhestva-oksida-kaltsiya-gidroksida-kaltsiya-v-smesi
- 26. Скачать презентацию




















 20230419_predmet_himii
20230419_predmet_himii Выполнение работ по одной или нескольким профессиям рабочих, должностям служащих
Выполнение работ по одной или нескольким профессиям рабочих, должностям служащих Использование Су-Джок терапии - при коррекции речевых нарушений
Использование Су-Джок терапии - при коррекции речевых нарушений Просечной металл. Приемы изготовления просечного металла
Просечной металл. Приемы изготовления просечного металла Как проектировать парк. 7 шагов к созданию хорошей зеленой территории
Как проектировать парк. 7 шагов к созданию хорошей зеленой территории Валя Котик
Валя Котик Презентация по теме США 11 класс
Презентация по теме США 11 класс Волго-Вятский район
Волго-Вятский район Развитие выносливости у подростков 13-14 лет в школьной секции общей физической подготовки
Развитие выносливости у подростков 13-14 лет в школьной секции общей физической подготовки урок по ППД
урок по ППД электронное портфолио
электронное портфолио Система NTSC
Система NTSC Школьные правила в стихах.
Школьные правила в стихах. Презентация Развитие российско-китайских отношений в 17-сер. 19 вв.
Презентация Развитие российско-китайских отношений в 17-сер. 19 вв. Социальные взаимодействия
Социальные взаимодействия Что такое информация
Что такое информация Клиникалық жағдай. Anamnesis morbi
Клиникалық жағдай. Anamnesis morbi Шаблоны презентаций Художники
Шаблоны презентаций Художники Облицовка вертикальной поверхности и короба керамической плиткой способом шов в шов
Облицовка вертикальной поверхности и короба керамической плиткой способом шов в шов Лимфогранулематоз кишечника
Лимфогранулематоз кишечника Советская автопромышленность
Советская автопромышленность Перемещение товаров и транспортных средств через таможенную границу
Перемещение товаров и транспортных средств через таможенную границу Догмат о Церкви Христова (часть 2)
Догмат о Церкви Христова (часть 2) Возможности использования дидактических игр для реализации регионального компонента
Возможности использования дидактических игр для реализации регионального компонента Электролиз
Электролиз Космоквантум. Родительское собрание
Космоквантум. Родительское собрание The Present Simple Tense
The Present Simple Tense Успешные продажи: главное — понять потребности покупателя
Успешные продажи: главное — понять потребности покупателя