Содержание
- 2. Содержание: 1. Примеры к семинару 1 по молекулярным массам. 1.1. Поликонденсация. 1.2. Реакция присоединения. 2. Методы
- 3. 3 Физико-химия полимеров и их растворов. Семинар 2 Поликонденсация Пусть в мономере АВ с молярной массой
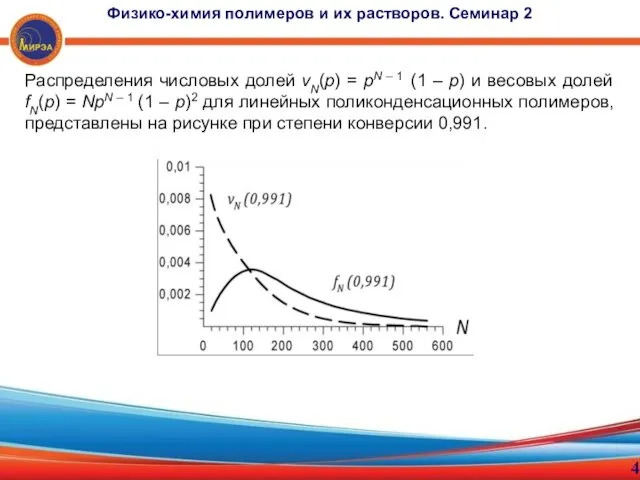
- 4. 4 Физико-химия полимеров и их растворов. Семинар 2 Распределения числовых долей νN(p) = pN – 1
- 5. 5 Физико-химия полимеров и их растворов. Семинар 2 Среднечисленную и среднемассовую молекулярные массы можно выразить через
- 6. Реакция присоединения Мономер присоединяется к растущему радикалу. Если скорость деполимеризации мала, а обрыв цепи не учитывается,
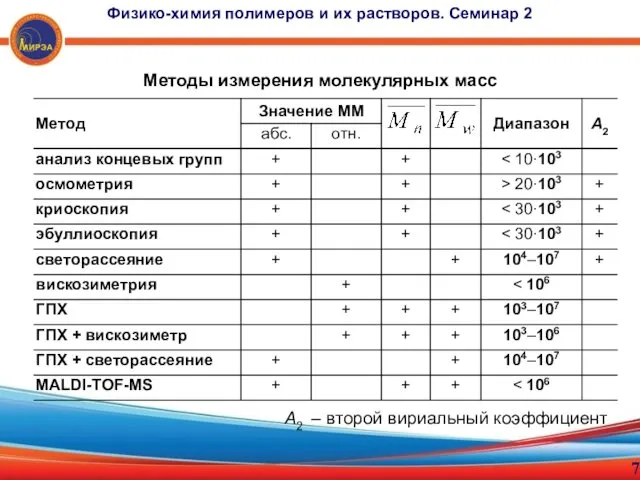
- 7. Методы измерения молекулярных масс 7 Физико-химия полимеров и их растворов. Семинар 2 A2 – второй вириальный
- 8. Существует много методов определения средних молекулярных масс и ММР. Среднечисленную ММ часто определяют при помощи анализа
- 9. Полное ММР, включающее молекулярные массы высоких степеней усреднения, измеряется гель-проникающей хроматографией (ГПХ). Полимерный раствор продавливается через
- 10. Осмометрия Осмотическое давление – термодинамическое коллигативное свойство, измеряемое по разнице свободных энергий полимерного раствора и чистого
- 11. Поскольку молекулы полимера в разбавленных растворах не взаимодействуют между собой и не проникают через мембрану, можно
- 12. Для полидисперсного полимера следует учесть вклад в осмотическое давление макромолекул различных молекулярных масс Mi и концентраций
- 13. Измерение осмотического давления разбавленных растворов полимеров позволяет определить среднечисленную молекулярную массу полидисперсного образца. Для этого необходимо
- 15. Скачать презентацию










 Я должен первым быть на горизонте…. Презентация книг к 80-летию со дня рождения Владимира Высоцкого
Я должен первым быть на горизонте…. Презентация книг к 80-летию со дня рождения Владимира Высоцкого Взаимодействие радиоактивных излучений с веществом. Прохождение излучений через материальную среду
Взаимодействие радиоактивных излучений с веществом. Прохождение излучений через материальную среду Умножение одночлена на многочлен
Умножение одночлена на многочлен Master your image
Master your image Биография и фотоматериалы о Юрии Гагарине
Биография и фотоматериалы о Юрии Гагарине Столение начала Первой мировой войны
Столение начала Первой мировой войны Материаловедение. Обработка металлов давлением. (Тема 9)
Материаловедение. Обработка металлов давлением. (Тема 9) Диплом презентация (NXPowerLite Copy)
Диплом презентация (NXPowerLite Copy) Навука
Навука Italy is one of the most beautiful countries in Europe
Italy is one of the most beautiful countries in Europe Сказка- ложь, да в ней намёк...!
Сказка- ложь, да в ней намёк...! Общение и источники преодоления обид (для детей)
Общение и источники преодоления обид (для детей) Методика полевого опыта. Агроэкологическое объединение Колос Надежды
Методика полевого опыта. Агроэкологическое объединение Колос Надежды Пропорциональность отрезков хорд, касательных и секущих
Пропорциональность отрезков хорд, касательных и секущих Разработка, производство и внедрение систем компенсации реактивной мощности
Разработка, производство и внедрение систем компенсации реактивной мощности Адаптация первоклассников. Пути преодоления дезадаптации
Адаптация первоклассников. Пути преодоления дезадаптации Гидроакустические преобразователи
Гидроакустические преобразователи Жизнь организмов в морях и океанах
Жизнь организмов в морях и океанах Николай Носов Федина задача
Николай Носов Федина задача Из опыта работы
Из опыта работы Делимость произведения
Делимость произведения Оборудование для упаковки мяса и мясных продуктов
Оборудование для упаковки мяса и мясных продуктов Обеспечение боевых действий авиационной части
Обеспечение боевых действий авиационной части Презентация по истории Княгиня Ольга
Презентация по истории Княгиня Ольга Живопис і графіка
Живопис і графіка живые клетки. методы их изучения
живые клетки. методы их изучения Топиарии - декоративные фигурно подстриженные деревья и кустарники
Топиарии - декоративные фигурно подстриженные деревья и кустарники Интеграция СДЭК
Интеграция СДЭК