Содержание
- 2. Фосфордың ашылуы Гамбург алхимигі Хеннинг Бранд 1669 жыл
- 3. Тарихы Фосфорды алғаш ашқан – Гамбургтік алхимик Геннинг Бранд(1669 ж). Басқа да алхимиктер тәрізді Бранд қарттарды
- 4. Мен жарық беруші элемент Сірінкені жағамын мен оп-оңай Астында судың мені жақса егер, Қышқылға айналады оксидім
- 5. Табиғатта кездесуі Табиғатта фосфор тау жыныстары мен минералдарда қосылыс түрінде кездеседі. Мысалы, фосфорит және апатитте кальций
- 6. Фосфор туралы Фосфор (лат. Phosphorus), P – элементтердің периодтық жүйесінің V тобындағы химиялық элемент, реттік нөмірі
- 7. Атом құрылысы Фосфордың соңғы энергетикалық қабатында бес электрон бар, оның үшеуі жұптаспаған. Фосфор атомындағы электрондардың орналасуы:
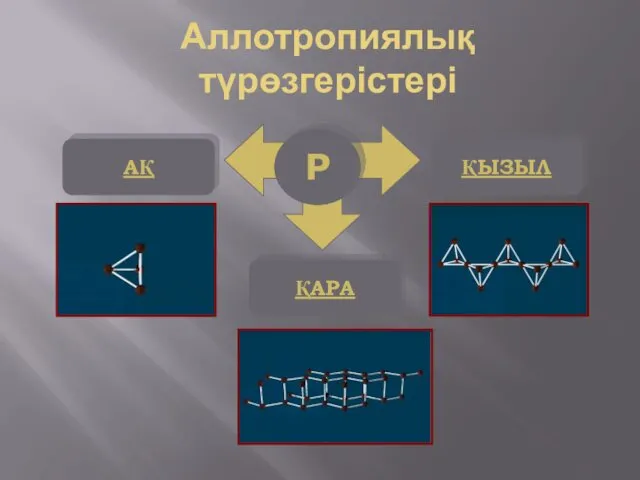
- 8. Р АҚ ҚЫЗЫЛ ҚАРА Аллотропиялық түрөзгерістері
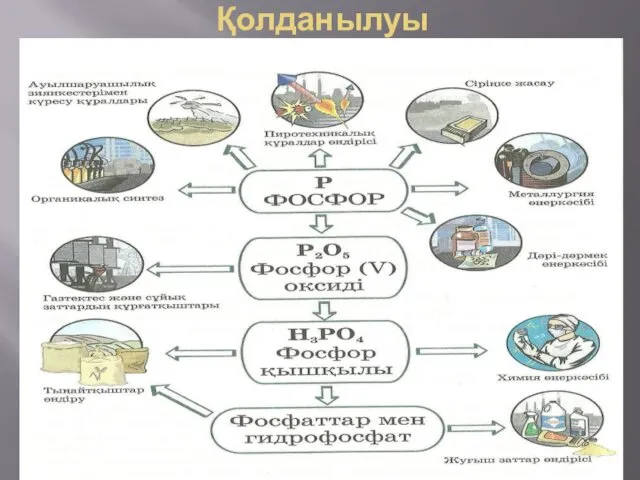
- 9. Қолданылуы Фосфордың ақ және қызыл түрөзгерісі бар. Ақ фосфор химиялық белсенді болып келеді. Сондықтан ақ фосфорды
- 10. Қолданылуы
- 12. Скачать презентацию







 Актуальность государственного регулирования процессов повышения конкурентоспособности экономики
Актуальность государственного регулирования процессов повышения конкурентоспособности экономики День Соборності України
День Соборності України Сенсорика и элементы робототехники
Сенсорика и элементы робототехники Основы моделирования
Основы моделирования Новогодняя игрушка из ваты Объяснительная записка Материально-техническое обеспечение План занятия Содержание учебного занятия Список литературы
Новогодняя игрушка из ваты Объяснительная записка Материально-техническое обеспечение План занятия Содержание учебного занятия Список литературы A tentative model of technology improvement in ferro- alloys manufacturing process & the business way forward
A tentative model of technology improvement in ferro- alloys manufacturing process & the business way forward Родной Пермский край – часть большой страны. 4 класс
Родной Пермский край – часть большой страны. 4 класс Основы языка ассемблер. Использование массивов
Основы языка ассемблер. Использование массивов Linear Momentum and Collisions Elastic Properties of Solids. Lecture 5
Linear Momentum and Collisions Elastic Properties of Solids. Lecture 5 Отвод поверхностных вод. Водосборно-водоотводные сооружения (водоотводы)
Отвод поверхностных вод. Водосборно-водоотводные сооружения (водоотводы) Организация радиационной, химической и медико-биологической защиты населения
Организация радиационной, химической и медико-биологической защиты населения презентация Учим татарский подготовительная группа воспитатели Копосова Е.В. Геккер Е.В. Диск
презентация Учим татарский подготовительная группа воспитатели Копосова Е.В. Геккер Е.В. Диск Какие качества нам нужны для изучения математики
Какие качества нам нужны для изучения математики Introduction about “Hallo Chinese” Program
Introduction about “Hallo Chinese” Program How to make a career in engineering
How to make a career in engineering Правила поведения на природе. Исследовательская работа учащихся
Правила поведения на природе. Исследовательская работа учащихся Организаторы военной экономики
Организаторы военной экономики Строительная компания ООО СК Форсаж
Строительная компания ООО СК Форсаж Липиды (5 B)
Липиды (5 B) Виды общения – вербальное и невербальное
Виды общения – вербальное и невербальное Поделка из пластилина Подснежники
Поделка из пластилина Подснежники Особенности формирования социально- коммуникативных компетенций у детей с нарушениями речи в игре.
Особенности формирования социально- коммуникативных компетенций у детей с нарушениями речи в игре. Какие вклады являются застрахованными
Какие вклады являются застрахованными Презентация Использование технических средств обучение в работе воспитателя
Презентация Использование технических средств обучение в работе воспитателя Робот-помощник по профессиям (официант)
Робот-помощник по профессиям (официант) Блокада Ленинграда: малые памятники.
Блокада Ленинграда: малые памятники. Молодежные субкультуры.
Молодежные субкультуры. Энергосистема Кыргызстана
Энергосистема Кыргызстана