Содержание
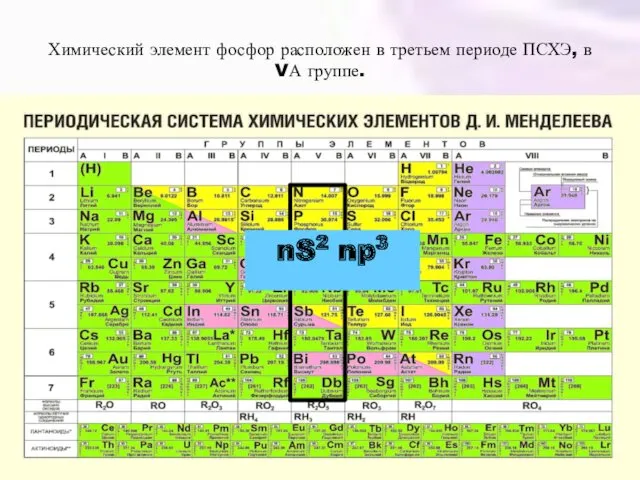
- 2. Химический элемент фосфор расположен в третьем периоде ПСХЭ, в VА группе. nS2 np3
- 3. Степени окисления фосфора -3 0 +3 +5 РН3, Р4, Р2О3, Н3РО4
- 4. Нахождение в природе Фосфор в природе в свободном виде не встречается. Массовая доля фосфора в земной
- 5. Важнейшие минералы фосфора – апатит и фосфорит, основу которых составляет фосфат кальция. Апатит Фосфорит
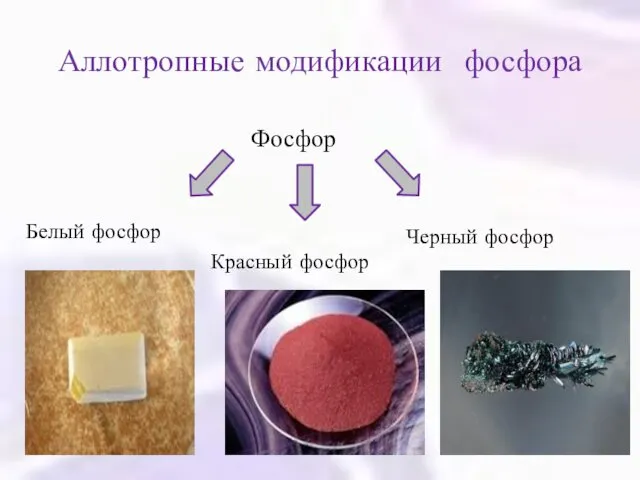
- 6. Аллотропные модификации фосфора Фосфор Белый фосфор Красный фосфор Черный фосфор
- 7. Белый фосфор Белый фосфор – мягкое воскоподобное вещество белого или светло-желтого цвета. Строение - молекулярное. В
- 8. Красный фосфор Строение – атомное. В узлах кристаллической решетки – атомы. Химически менее активен, чем белый
- 9. Черный фосфор Строение – атомное. В узлах кристаллической решетки – атомы. Химически менее активен, чем белый
- 10. Химические свойства. Горение 4Р + 5О2 = 2Р2О5 2. При недостатке кислорода: 4Р + 3О2 =
- 11. Соединения фосфора P2O5 - белый порошок, расплывающийся на воздухе вследствие поглощения паров воды. P2O5 + H2O
- 12. Ортофосфорная кислота может образовать три вида солей: 1. Дигидрофосфаты (например, NaH2PO4 – дигидрофосфат натрия) 2. Гидрофосфаты
- 14. Скачать презентацию









 Презентация Лаборатория здорового питания
Презентация Лаборатория здорового питания Натюрморт
Натюрморт Операції над об’єктами файлової системи (урок 10, 6 клас)
Операції над об’єктами файлової системи (урок 10, 6 клас) Сказки Степана Писахова. Викторина. Презентация.
Сказки Степана Писахова. Викторина. Презентация. Інструкція з сигналізації на залізницях України
Інструкція з сигналізації на залізницях України Василий Иванович Трофимов
Василий Иванович Трофимов Структура населения мира. Религии
Структура населения мира. Религии Организационные, правовые и педагогические основы обучения населения в области гражданской обороны и защиты от ЧС
Организационные, правовые и педагогические основы обучения населения в области гражданской обороны и защиты от ЧС Формы и методы розничной продажи товаров, их технологии и эффективность
Формы и методы розничной продажи товаров, их технологии и эффективность Прохідницький комбайн
Прохідницький комбайн Лекция_2_Теплопроводность
Лекция_2_Теплопроводность Константин Дмитриевич Ушинский
Константин Дмитриевич Ушинский Принципы и особенности социокультурной реабилитации лиц с ОВЗ в учреждениях культуры для КПК (1)
Принципы и особенности социокультурной реабилитации лиц с ОВЗ в учреждениях культуры для КПК (1) Организация профориентированной деятельности обучающихся начальных классов во внеурочное время
Организация профориентированной деятельности обучающихся начальных классов во внеурочное время Семинарское занятие на тему Какую воду мы пьём?
Семинарское занятие на тему Какую воду мы пьём? Сервисный аудит. Курс Сервисное управление
Сервисный аудит. Курс Сервисное управление Современная инфографика
Современная инфографика Animals
Animals Виды конструктора
Виды конструктора Automate programabile
Automate programabile Задачи на построение
Задачи на построение Развитие внимания у младших школьников
Развитие внимания у младших школьников Презентация из опыта работы Развитие мелкой моторики у детей младшего дошкольного возраста
Презентация из опыта работы Развитие мелкой моторики у детей младшего дошкольного возраста Память о сыночке
Память о сыночке Гравитационное взаимодействие. Закон всемирного тяготения. Сила тяжести
Гравитационное взаимодействие. Закон всемирного тяготения. Сила тяжести Парогазовые установки на твердом топливе (ПГУ-Т). Лекция 15
Парогазовые установки на твердом топливе (ПГУ-Т). Лекция 15 Последовательное соединение проводников
Последовательное соединение проводников Выборочное наблюдение
Выборочное наблюдение