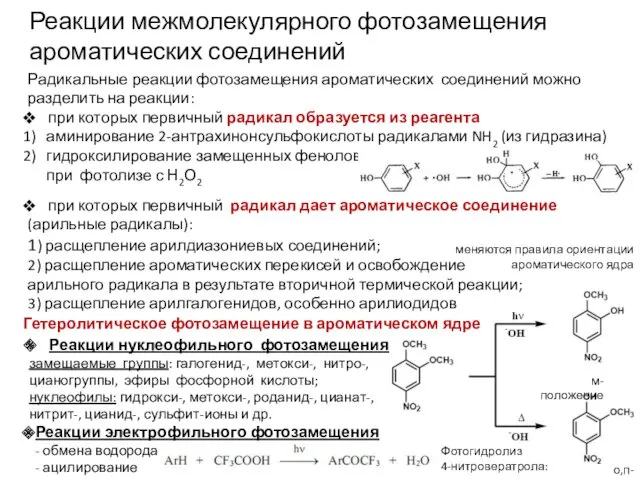
Радикальные реакции фотозамещения ароматических соединений можно разделить на реакции:
при которых первичный
радикал образуется из реагента
аминирование 2-антрахинонсульфокислоты радикалами NH2 (из гидразина)
гидроксилирование замещенных фенолов
при фотолизе с Н2О2
при которых первичный радикал дает ароматическое соединение
(арильные радикалы):
1) расщепление арилдиазониевых соединений;
2) расщепление ароматических перекисей и освобождение
арильного радикала в результате вторичной термической реакции;
3) расщепление арилгалогенидов, особенно арилиодидов
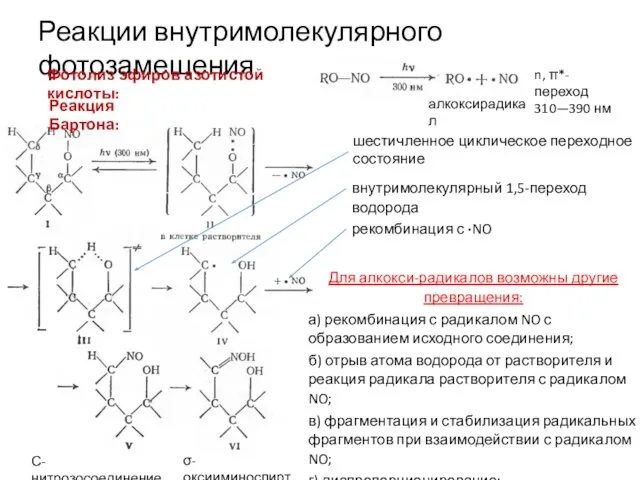
Фотогидролиз
4-нитровератрола:
Реакции межмолекулярного фотозамещения ароматических соединений
Гетеролитическое фотозамещение в ароматическом ядре
Реакции нуклеофильного фотозамещения
замещаемые группы: галогенид-, метокси-, нитро-,
цианогруппы, эфиры фосфорной кислоты;
нуклеофилы: гидрокси-, метокси-, роданид-, цианат-, нитрит-, цианид-, сульфит-ионы и др.
Реакции электрофильного фотозамещения
- обмена водорода
- ацилирование
меняются правила ориентации ароматического ядра
м-положение
о,п-положение
![Br + Cl Br + Cl* ΔE Фотохимическая диссоциация галогенов и галогенпроизводных [(n,σ*)-возбужденных состояний]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/82002/slide-4.jpg)



![[2+2]-Автоприсоединение моноолефинов экзо, экзо-димер (I) экзо, эндо-димер (II) без сенсибилизаторов](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/82002/slide-13.jpg)
 Презентация белка в лесу
Презентация белка в лесу Фото отчет торгового зала. Шаблон
Фото отчет торгового зала. Шаблон Семья как персональная микросреда развития, её воспитательные возможности и условия их реализации.
Семья как персональная микросреда развития, её воспитательные возможности и условия их реализации. Разработка технологии термохимического упрочнения изделий из технического титана
Разработка технологии термохимического упрочнения изделий из технического титана Автоматизированная система для подключения устройств ввода-вывода
Автоматизированная система для подключения устройств ввода-вывода Петр I. Внешняя политика
Петр I. Внешняя политика Картофелесажалка КСМ_4
Картофелесажалка КСМ_4 Первичная аккредитация специалистов. Федеральный закон об основах охраны здоровья граждан в Российской Федерации
Первичная аккредитация специалистов. Федеральный закон об основах охраны здоровья граждан в Российской Федерации Подготовка к ГИА. Решение текстовых задач
Подготовка к ГИА. Решение текстовых задач Техники, связанные с использованием бумаги и текстиля
Техники, связанные с использованием бумаги и текстиля Мастер –класс Игрушки из коробочек. Коробочный лягушонок
Мастер –класс Игрушки из коробочек. Коробочный лягушонок Анализ книжных иллюстраций
Анализ книжных иллюстраций Педагогический проект Развитие творческой активности личности в хореографическом коллективе
Педагогический проект Развитие творческой активности личности в хореографическом коллективе Рембрандт ван Рейн Возвращение блудного сына
Рембрандт ван Рейн Возвращение блудного сына Презентация диплом НАК лемачко версия2
Презентация диплом НАК лемачко версия2 Основы построения ЭВМ
Основы построения ЭВМ Протестантизм. История протестантизма
Протестантизм. История протестантизма Тарковский
Тарковский Презентация День победы
Презентация День победы Схеми. Терміни, визначення, поняття
Схеми. Терміни, визначення, поняття Пасха - Светлое Воскресенье Господне
Пасха - Светлое Воскресенье Господне проект Павел Трофимович Морозов
проект Павел Трофимович Морозов Будущая профессия программист
Будущая профессия программист Средства, влияющие на сердечно-сосудистую систему
Средства, влияющие на сердечно-сосудистую систему Современные методы диагностики и лечения рака прямой кишки
Современные методы диагностики и лечения рака прямой кишки Классификация минералов. Лекция 2
Классификация минералов. Лекция 2 Речевые магнитофоны
Речевые магнитофоны Вводное занятие по программе Чудеса из ткани своими руками
Вводное занятие по программе Чудеса из ткани своими руками