Содержание
- 2. 16.04.2013
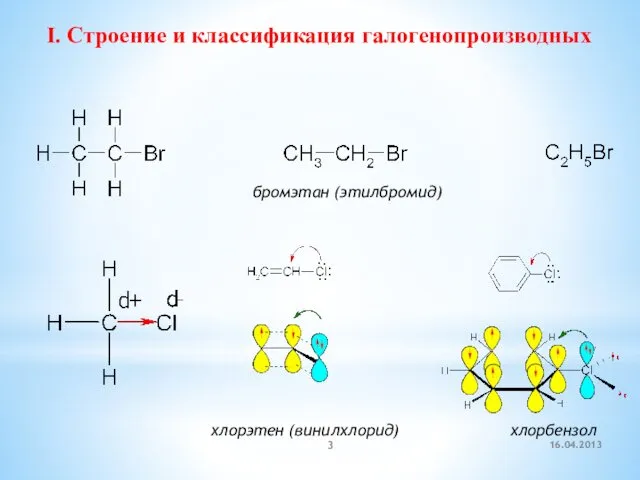
- 3. I. Строение и классификация галогенопроизводных бромэтан (этилбромид) хлорэтен (винилхлорид) хлорбензол 16.04.2013
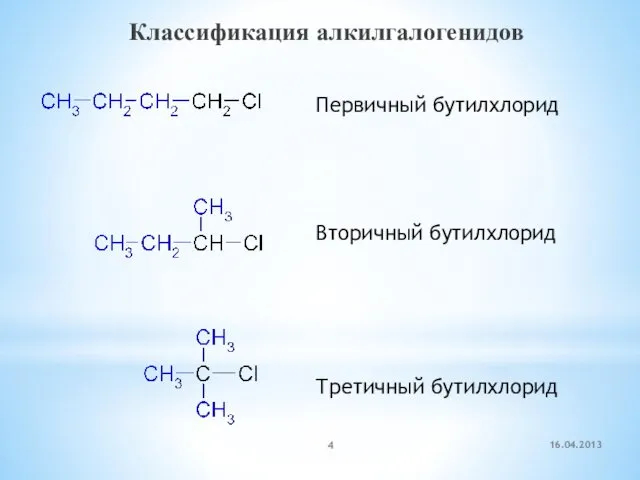
- 4. Классификация алкилгалогенидов Первичный бутилхлорид Вторичный бутилхлорид Третичный бутилхлорид 16.04.2013
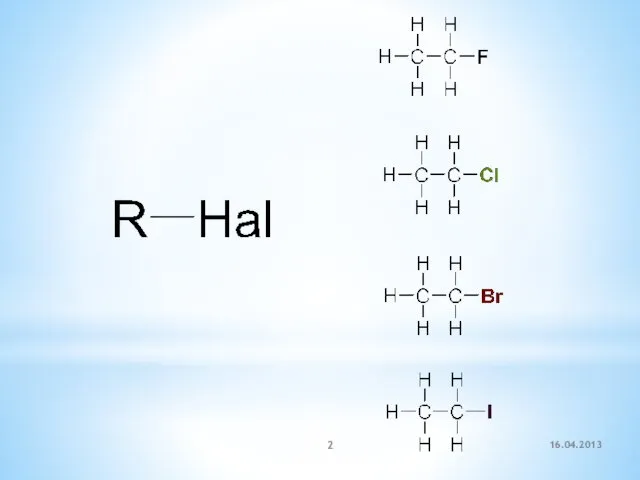
- 5. II. Номенклатура 3-метил-1-хлоробутан 3-бромопропен этилхлорид бутилбромид винилхлорид (ИЮПАК: хлороэтан 1-бромобутан хлороэтен) 16.04.2013
- 6. хлороформ бромоформ йодоформ хлороформ бромоформ йодоформ Эмпирическая номенклатура 16.04.2013
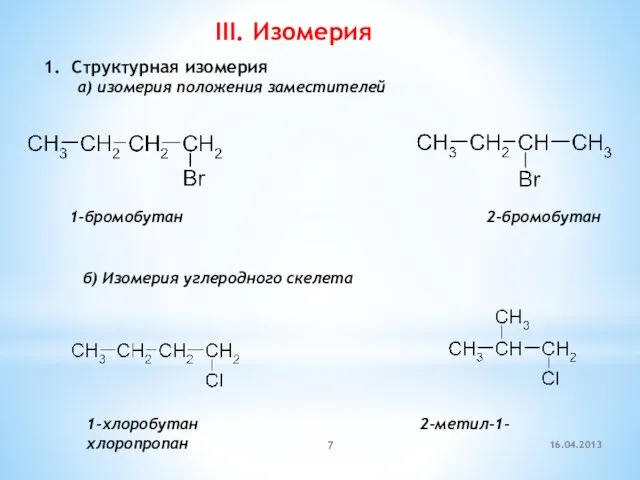
- 7. III. Изомерия 1. Cтруктурная изомерия а) изомерия положения заместителей 1-бромобутан 2-бромобутан б) Изомерия углеродного скелета 1-хлоробутан
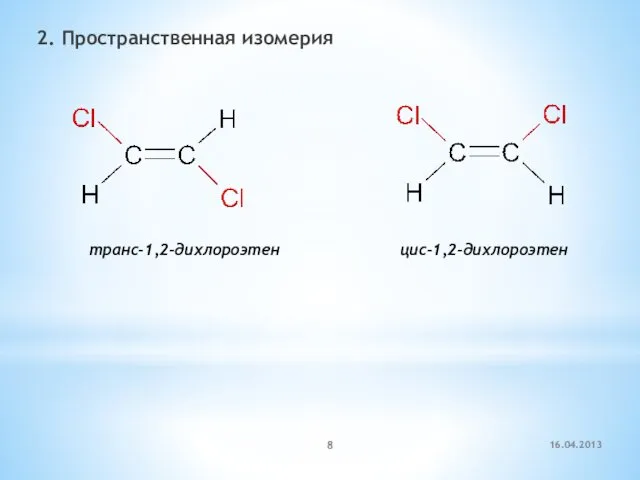
- 8. 2. Пространственная изомерия транс-1,2-дихлороэтен цис-1,2-дихлороэтен 16.04.2013
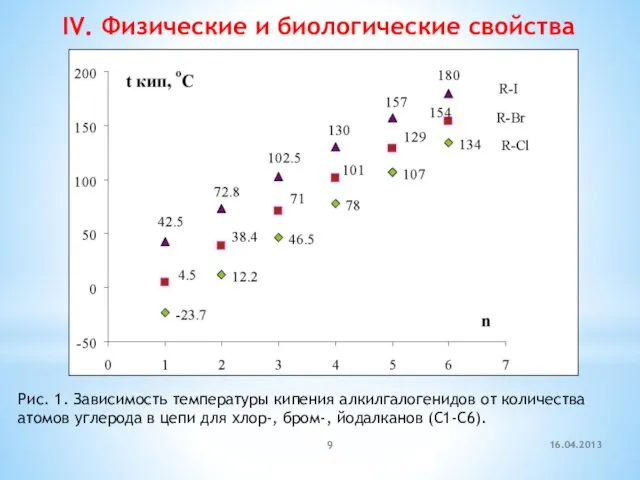
- 9. IV. Физические и биологические свойства Рис. 1. Зависимость температуры кипения алкилгалогенидов от количества атомов углерода в
- 10. t кип. oC -23,7 40 61,2 76,8 Галогенопроизводные являются гидрофобными веществами: они плохо растворяются в воде
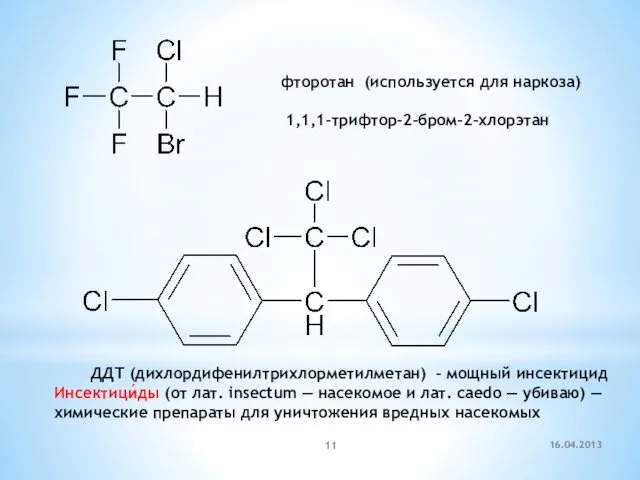
- 11. фторотан (используется для наркоза) 1,1,1-трифтор-2-бром-2-хлорэтан ДДТ (дихлордифенилтрихлорметилметан) – мощный инсектицид Инсектици́ды (от лат. insectum — насекомое
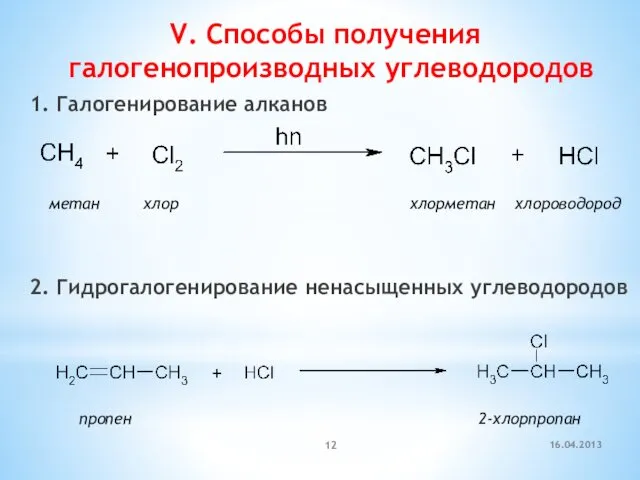
- 12. V. Способы получения галогенопроизводных углеводородов 1. Галогенирование алканов 2. Гидрогалогенирование ненасыщенных углеводородов метан хлор хлорметан хлороводород
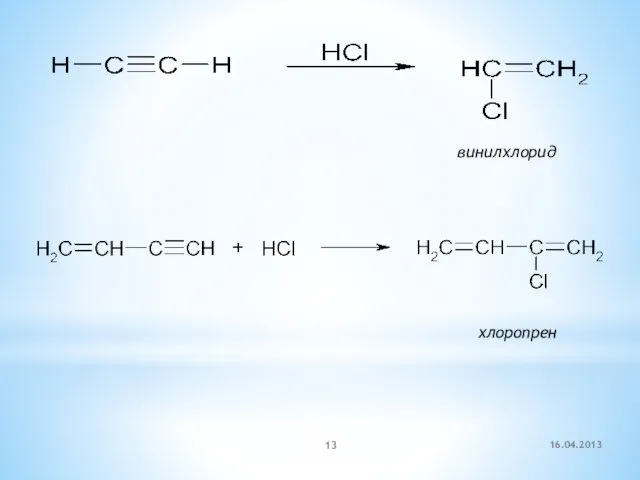
- 13. винилхлорид хлоропрен 16.04.2013
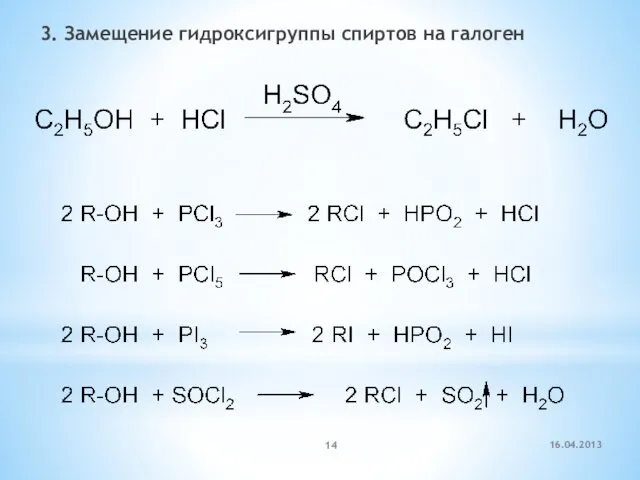
- 14. 3. Замещение гидроксигруппы спиртов на галоген 16.04.2013
- 15. 4. Реакция Бородина-Хунсдиккера 16.04.2013 Александр Бородин (31.10.1833 – 15.02.1887) русский учёный-химик (химик-органик) и композитор
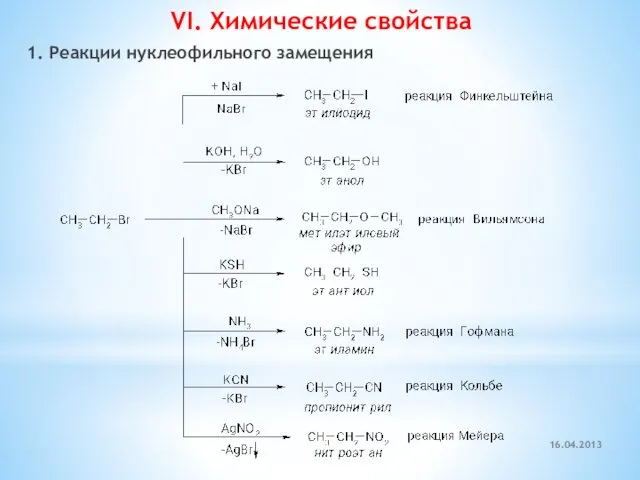
- 16. VI. Химические свойства 1. Реакции нуклеофильного замещения 16.04.2013
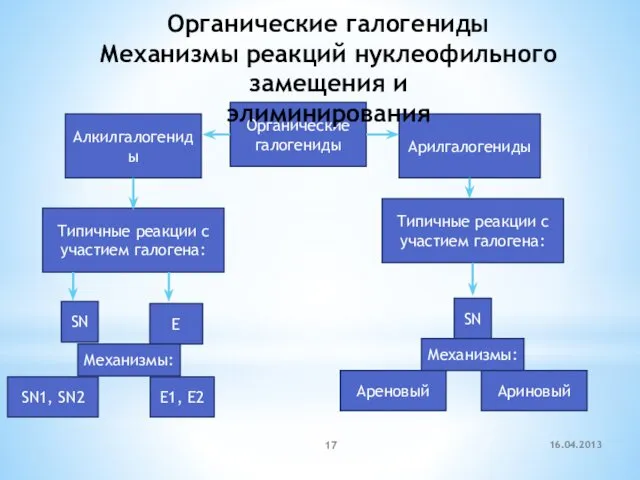
- 17. Органические галогениды Алкилгалогениды Арилгалогениды Типичные реакции c участием галогена: SN E Механизмы: SN1, SN2 E1, E2
- 18. Типовые реакции алифатического нуклеофильного замещения с участием алкилгалогенидов
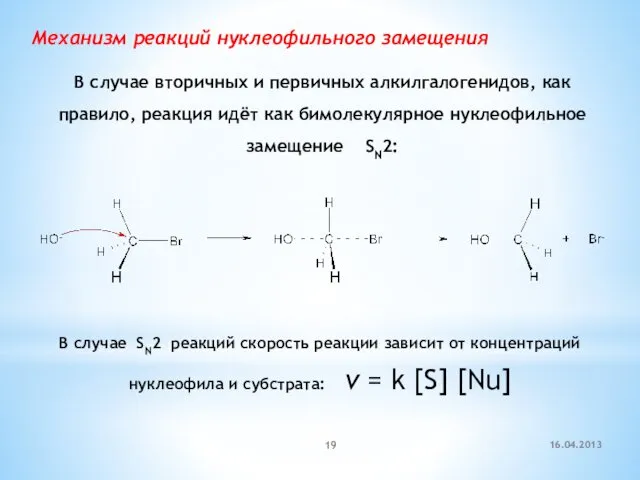
- 19. Механизм реакций нуклеофильного замещения В случае вторичных и первичных алкилгалогенидов, как правило, реакция идёт как бимолекулярное
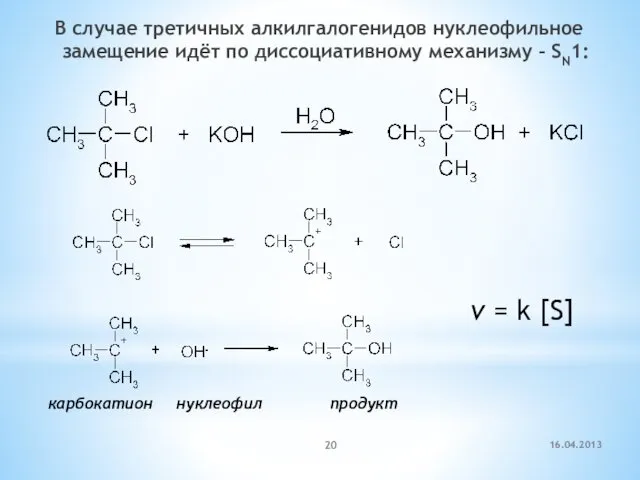
- 20. В случае третичных алкилгалогенидов нуклеофильное замещение идёт по диссоциативному механизму – SN1: карбокатион нуклеофил продукт v
- 21. 16.04.2013
- 22. 2. Реакции элиминирования (отщепления) 1) дегидрогалогенирования Если проводить эту реакцию в воде, а не в спирте,
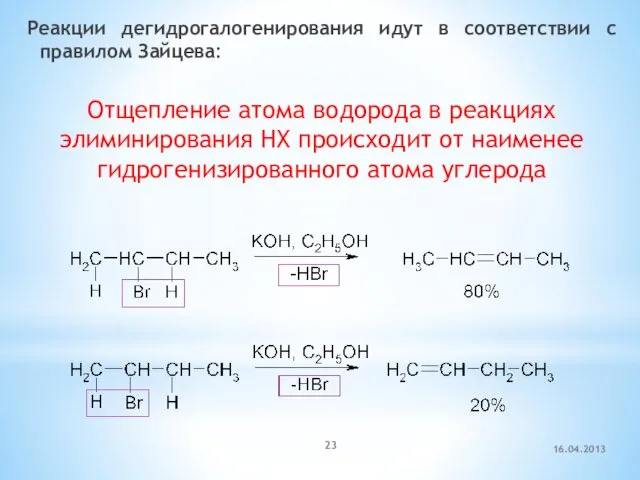
- 23. Реакции дегидрогалогенирования идут в соответствии с правилом Зайцева: Отщепление атома водорода в реакциях элиминирования HX происходит
- 24. 16.04.2013 Дата рождения: 2 июля 1841 Место рождения: г. Казань Дата смерти: 1 сентября 1910 (69
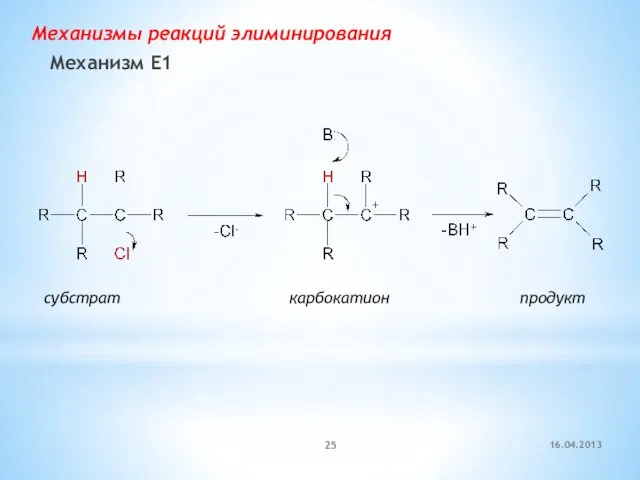
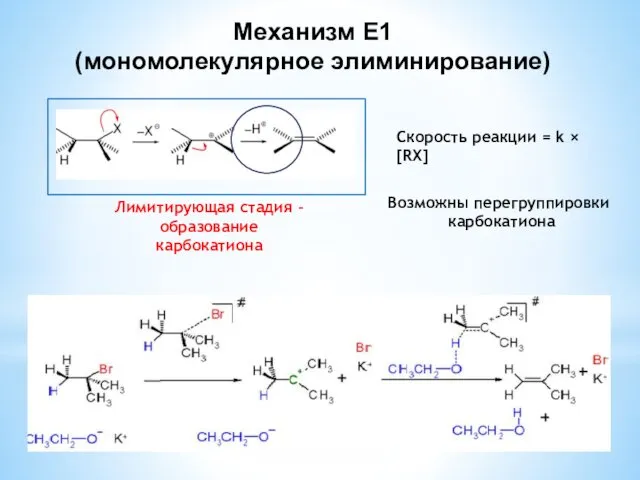
- 25. Механизмы реакций элиминирования Механизм E1 субстрат карбокатион продукт 16.04.2013
- 26. Механизм Е1 (мономолекулярное элиминирование) Лимитирующая стадия – образование карбокатиона Возможны перегруппировки карбокатиона Скорость реакции = k
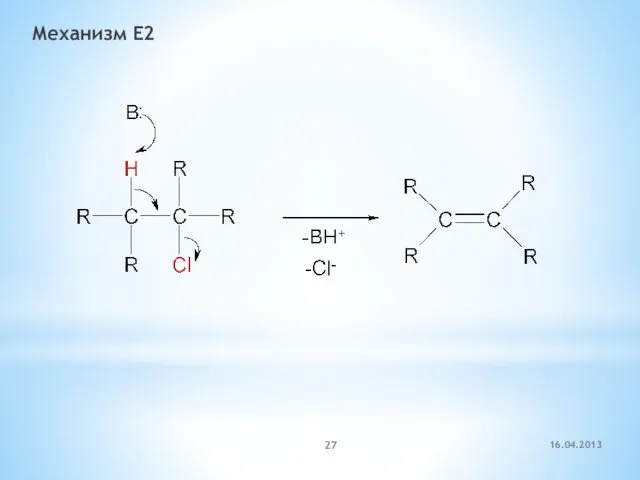
- 27. Механизм E2 16.04.2013
- 28. Механизм Е2 (бимолекулярное элиминирование) Скорость реакции = k × [RX] × [В]
- 29. 16.04.2013
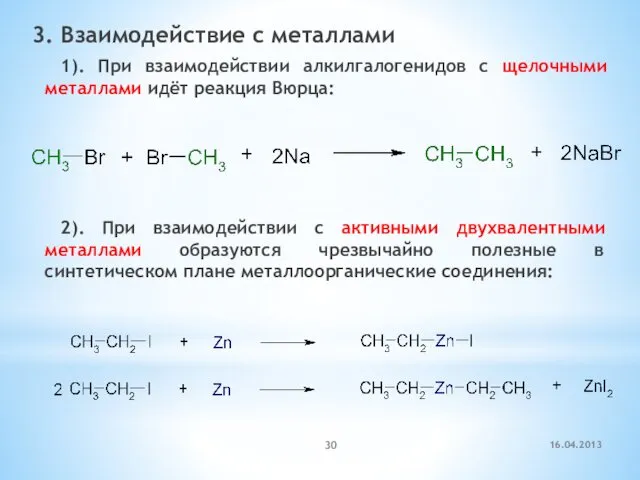
- 30. 3. Взаимодействие с металлами 1). При взаимодействии алкилгалогенидов с щелочными металлами идёт реакция Вюрца: 2). При
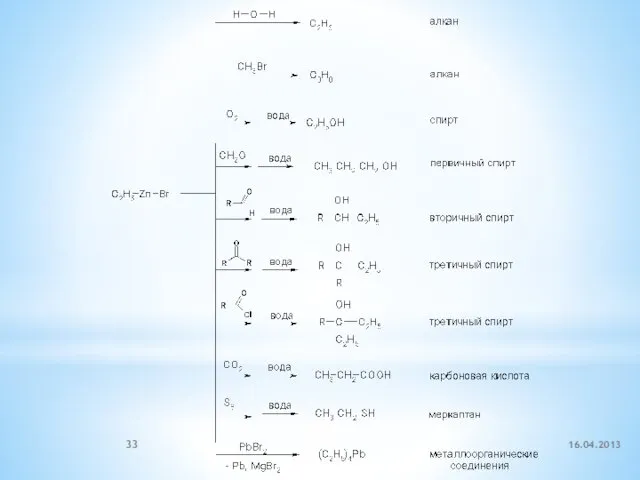
- 31. этилбромид этилмагнийбромид Mg-органические соединения – реактивы Гриньяра (Гриньяр, Нобелевская премия, 1912) 16.04.2013
- 32. 16.04.2013 Гриньяр (Grignard) Франсуа Огюст Виктор (06.05.1871, Шербур, — 13.12.1935, Лион), французский химик-органик, член Парижской АН
- 33. 16.04.2013
- 34. Метод предложен русским учёным-химиком Фёдором Фёдоровичем Бейльштейном в 1872 г 16.04.2013 Качественная реакция на галогенопроизводные называется
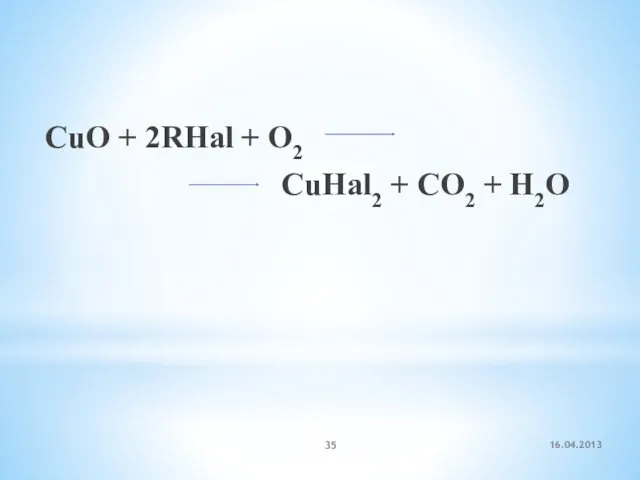
- 35. 16.04.2013 CuO + 2RHal + O2 CuHal2 + CO2 + H2O
- 38. Скачать презентацию








![Механизм Е2 (бимолекулярное элиминирование) Скорость реакции = k × [RX] × [В]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/52246/slide-27.jpg)





 Становление исторического жанра в русской живописи 18 века. 1 часть
Становление исторического жанра в русской живописи 18 века. 1 часть Виды и способы отделки изделий из древесины. 5 класс
Виды и способы отделки изделий из древесины. 5 класс Рисуем белочку
Рисуем белочку Машины постоянного тока
Машины постоянного тока ФГОС дошкольного образования.
ФГОС дошкольного образования. Конструктивные особенности изгибаемых железобетонных элементов
Конструктивные особенности изгибаемых железобетонных элементов Развитие высокоскоростных магистралей (ВСМ) в Китае
Развитие высокоскоростных магистралей (ВСМ) в Китае Роль философии в обосновании системы ценностей современного российского общества
Роль философии в обосновании системы ценностей современного российского общества ПОДГОТОВКА ДЕТЕЙ К ШКОЛЕ
ПОДГОТОВКА ДЕТЕЙ К ШКОЛЕ Красота природы родного края. Роль колорита в пейзаже
Красота природы родного края. Роль колорита в пейзаже Ребусы Диск
Ребусы Диск Творчість трубадурів
Творчість трубадурів Италиялық ғажап“(1950 – 1960 ж.)
Италиялық ғажап“(1950 – 1960 ж.) Кибернетическая модель управления: управление, обратная связь
Кибернетическая модель управления: управление, обратная связь Взаимоувязанная сеть связи РФ
Взаимоувязанная сеть связи РФ Правопонимание и право
Правопонимание и право Творческий проект Декоративное изделие в технике вязание крючком. Модная сумка
Творческий проект Декоративное изделие в технике вязание крючком. Модная сумка Поделка к 8 марта!
Поделка к 8 марта! Конкурсная работа Первый раз в первый класс!
Конкурсная работа Первый раз в первый класс! презентация педопыт
презентация педопыт Основные структурные варианты построения кэш-памяти. Лекция 10
Основные структурные варианты построения кэш-памяти. Лекция 10 Портфолио педагога.Структура портфолио.
Портфолио педагога.Структура портфолио. Ісаак Ньютон
Ісаак Ньютон Четность и нечетность тригонометрических функций. 10 класс
Четность и нечетность тригонометрических функций. 10 класс Нормы и режим питания. Нарушение обмена веществ
Нормы и режим питания. Нарушение обмена веществ Конструирование – разновидность моделирования
Конструирование – разновидность моделирования Памяти юных героев войны посвящается...
Памяти юных героев войны посвящается... Физиология органов дыхания
Физиология органов дыхания