Содержание
- 2. ПЛАН ЛЕКЦИИ 1 Теоретические сведения 2 Классификация 3 Химизм 4 Газогенераторы
- 3. ТЕОРЕТИЧЕСКИЕ СВЕДЕНИЯ При углубленной переработке нефти образуются в больших количествах (около 15-20 % от нефти) твердые
- 4. ТЕОРЕТИЧЕСКИЕ СВЕДЕНИЯ Применение: - битумы; - пеки; - другие углеродистые материалы. ТНО образуется гораздо больше, чем
- 5. ТЕОРЕТИЧЕСКИЕ СВЕДЕНИЯ Проблема: Квалифицированная переработка тяжелых нефтяных остатков
- 6. ТЕОРЕТИЧЕСКИЕ СВЕДЕНИЯ Газификацией называют высокотемпературный некаталитический процесс взаимодействия органической массы твердых или жидких горючих ископаемых с
- 7. ТЕОРЕТИЧЕСКИЕ СВЕДЕНИЯ Окислители: - кислород; - водяной пар; - диоксид углерода; - воздух; - смеси этих
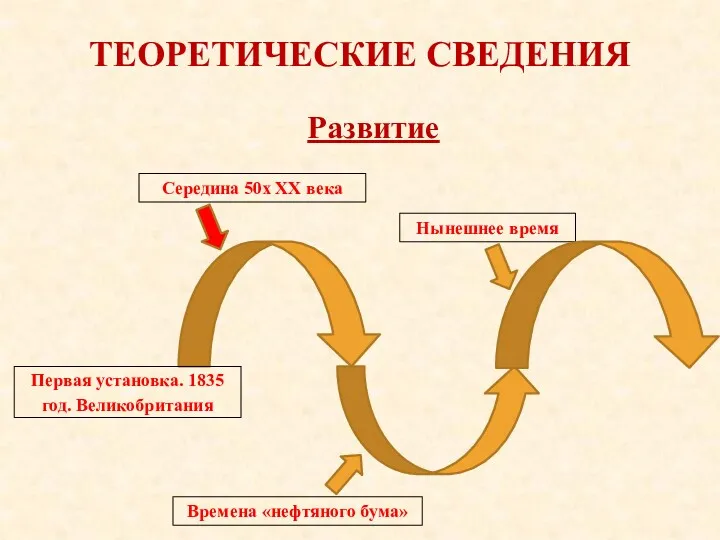
- 8. ТЕОРЕТИЧЕСКИЕ СВЕДЕНИЯ Развитие Середина 50х XX века Времена «нефтяного бума» Нынешнее время Первая установка. 1835 год.
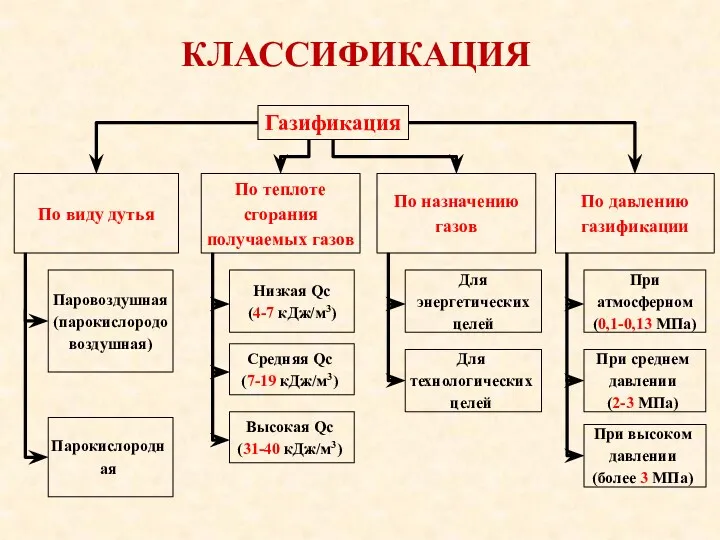
- 9. КЛАССИФИКАЦИЯ Газификация По виду дутья Паровоздушная (парокислородовоздушная) Парокислородная По теплоте сгорания получаемых газов Низкая Qс (4-7
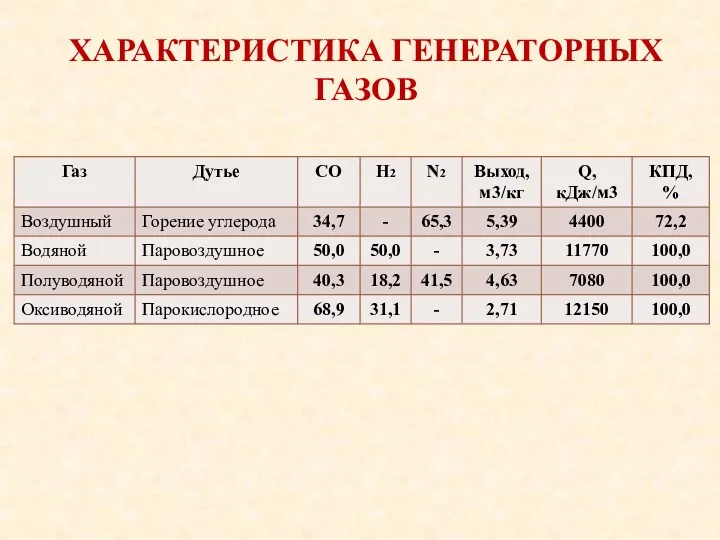
- 10. ХАРАКТЕРИСТИКА ГЕНЕРАТОРНЫХ ГАЗОВ
- 11. ХИМИЗМ При взаимодействии углерода топлива (твердого нефтяного остатка) с газифицирующими агентами (О2, Н2О, СО2) при высокой
- 12. ХИМИЗМ При взаимодействии метана с водяным паром (каталитическая конверсия) протекают следующие реакции: СН4 + Н2О =
- 13. ХИМИЗМ При термической газификации ТНО Газифицирующий агент - кислород - подается в процессе в количестве, достаточном
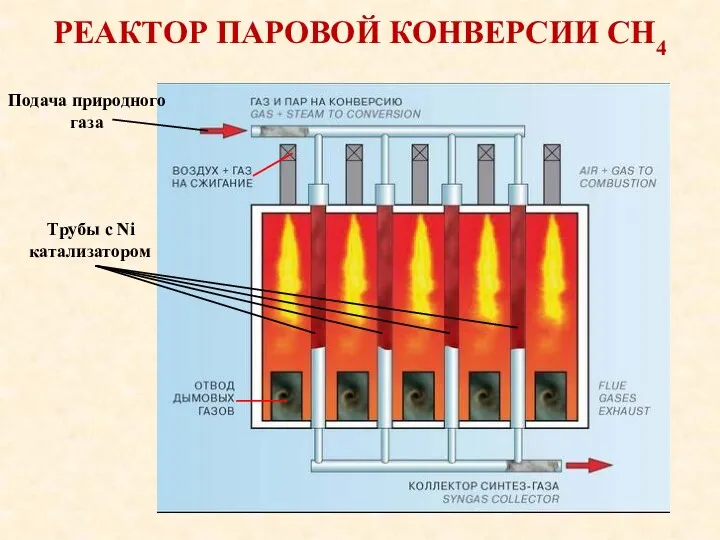
- 14. ХИМИЗМ При каталитической паровой конверсии метана Катализатор (никелевый) находится внутри трубок печи. Туда же подаётся смесь
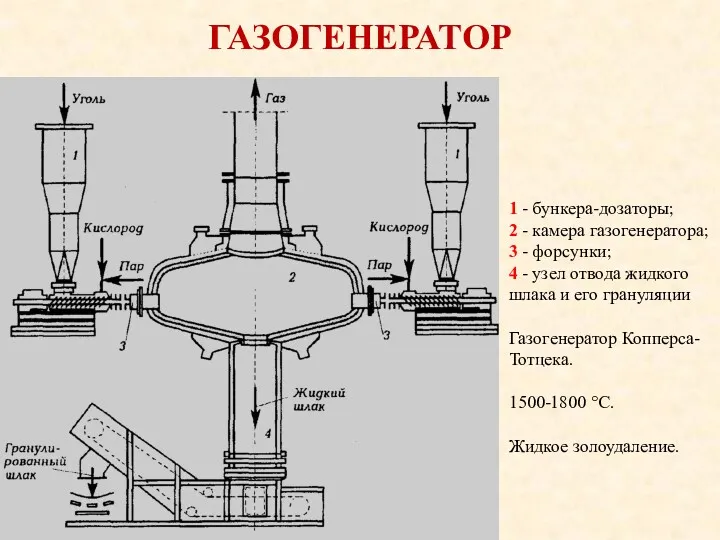
- 15. ГАЗОГЕНЕРАТОР 1 - бункера-дозаторы; 2 - камера газогенератора; 3 - форсунки; 4 - узел отвода жидкого
- 16. РЕАКТОР ПАРОВОЙ КОНВЕРСИИ СН4 Трубы с Ni катализатором Подача природного газа
- 17. - высококалорийное топливо; - производство метанола (СО и водород); - производство синтетического жидкого топлива (СО и
- 19. Скачать презентацию











 Мой родной поселок Мари-Турек.
Мой родной поселок Мари-Турек. Взаимное расположение сферы и плоскости
Взаимное расположение сферы и плоскости Опрелости нарушение целостности кожных покровов вследствие нарушения ухода за новорожденным
Опрелости нарушение целостности кожных покровов вследствие нарушения ухода за новорожденным Организационная структура управления предприятием
Организационная структура управления предприятием История в произведениях русских художников
История в произведениях русских художников Действия с обыкновенными дробями
Действия с обыкновенными дробями Микропроцессорные системы
Микропроцессорные системы Презентация Такие разные деды Морозы
Презентация Такие разные деды Морозы Презентации для уроков Истории и культуры Санкт-Петербурга
Презентации для уроков Истории и культуры Санкт-Петербурга Мотивация успеха и боязнь неудачи (опросник А.А.Реана)
Мотивация успеха и боязнь неудачи (опросник А.А.Реана) Александр Яковлевич Головин (1863 – 1930). Автопортрет с полосатой тканью
Александр Яковлевич Головин (1863 – 1930). Автопортрет с полосатой тканью Arduino
Arduino Robert Burns (1759–1796)
Robert Burns (1759–1796) Бизнес-план выхода на рынок нового продукта
Бизнес-план выхода на рынок нового продукта Техническое обслуживание ВВТ. Занятие №3
Техническое обслуживание ВВТ. Занятие №3 Маркировка электрических кабелей связи
Маркировка электрических кабелей связи Мастер-класс Фонетическая и сопряжённо-контактная ритмика в работе логопеда
Мастер-класс Фонетическая и сопряжённо-контактная ритмика в работе логопеда Ассоциация молодых педагогов. Что значит для меня образование
Ассоциация молодых педагогов. Что значит для меня образование Личность. Развитие личности: самосознание, самооценка
Личность. Развитие личности: самосознание, самооценка Презентация к конспекту занятия. Тема Огород. Овощи
Презентация к конспекту занятия. Тема Огород. Овощи Презентация факутальтива Эрудит 2
Презентация факутальтива Эрудит 2 Летняя гуманитарно-математическая школа. Семейный научно-познавательный лагерь Остров героев – 2020
Летняя гуманитарно-математическая школа. Семейный научно-познавательный лагерь Остров героев – 2020 Клиенты из соцсетей
Клиенты из соцсетей Цвет в компьютерной графике
Цвет в компьютерной графике Судебно-психологическая экспертиза. Цели и задачи
Судебно-психологическая экспертиза. Цели и задачи Миграция населения
Миграция населения Чипсы - это вкусно!
Чипсы - это вкусно! Кунгурская ледяная пещера
Кунгурская ледяная пещера