Содержание
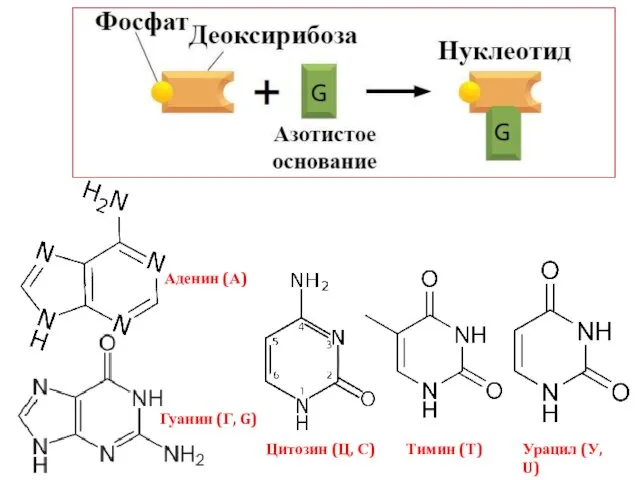
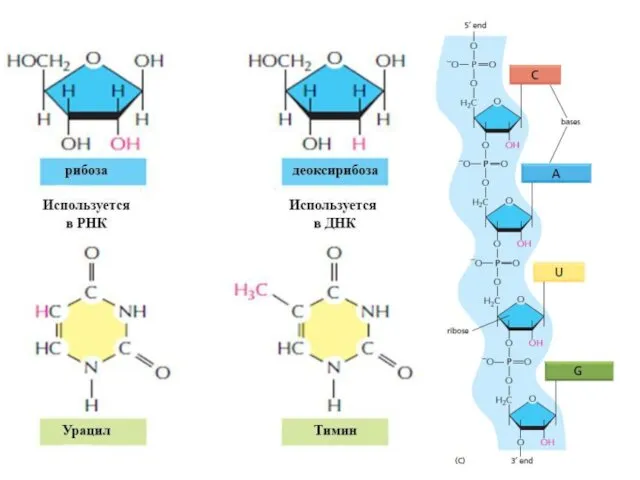
- 2. Аденин (А) Гуанин (Г, G) Тимин (Т) Урацил (У, U) Цитозин (Ц, С)
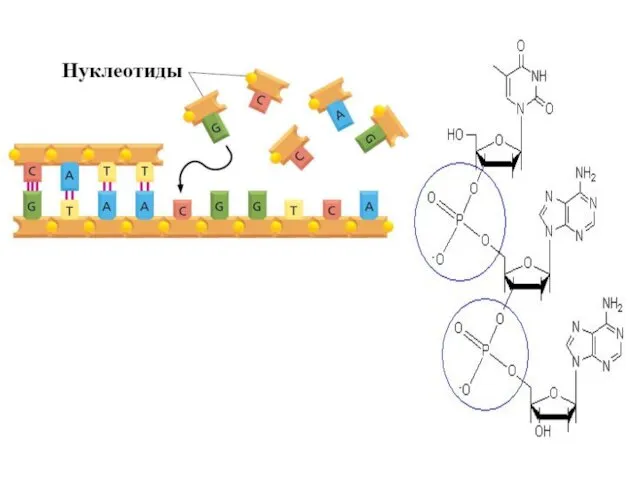
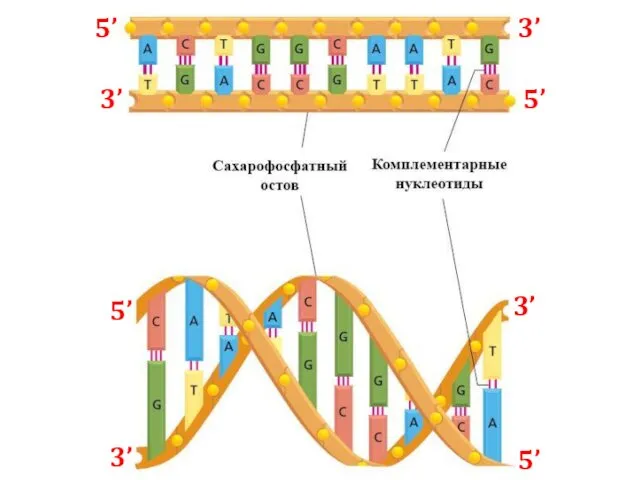
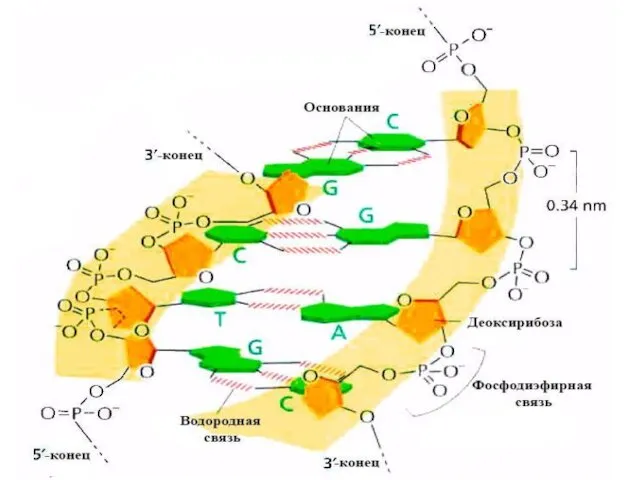
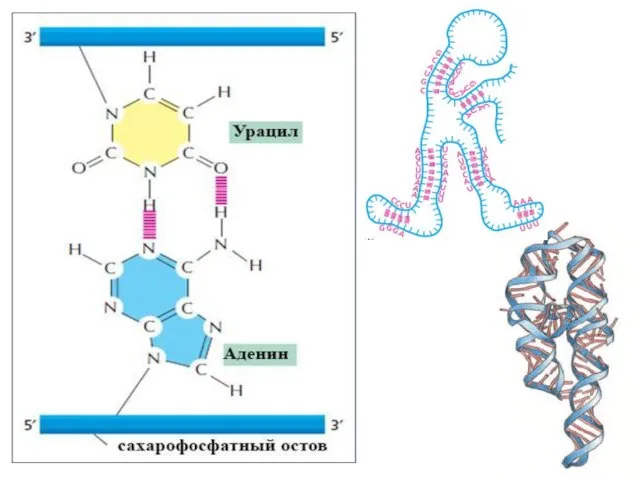
- 4. 5’ 3’ 5’ 3’ 5’ 5’ 3’ 3’
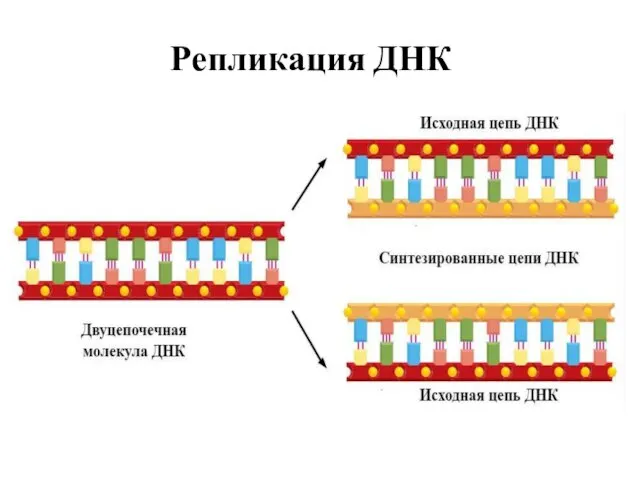
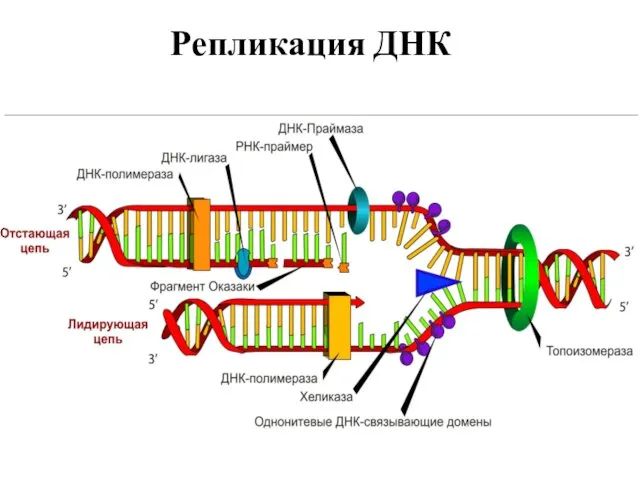
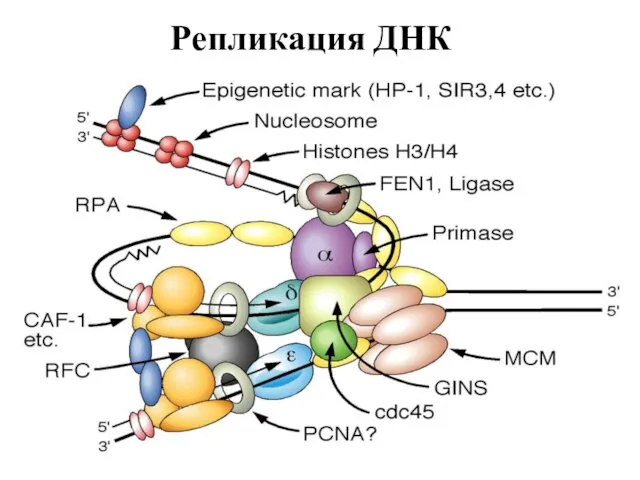
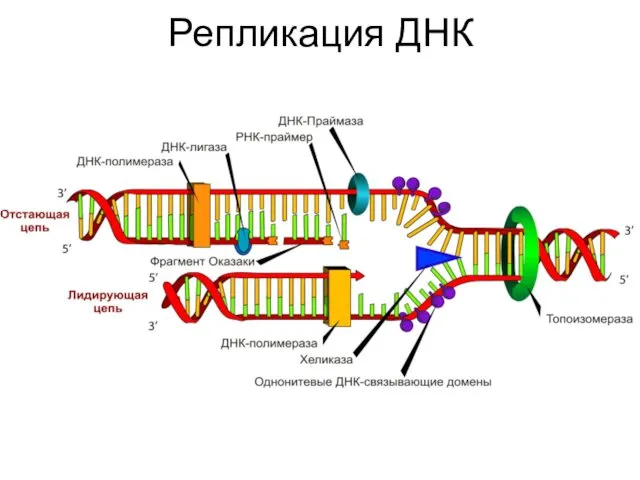
- 6. Репликация ДНК
- 7. Репликация ДНК
- 8. Репликация ДНК
- 10. ttctcatgtttgacagcttatcatcgataagctttaatgcggtagtttatcacagttaaattgctaacgcagtcaggcaccgtgtatgaaatctaacaatgcgctcatcgtcatcctcggcaccgtcaccctggatgctgtaggcataggcttggttatgccggtactgccgggcctcttgcgggatatcgtccattccgacagcatcgccagtcactatggcgtgctgctagcgctatatgcgttgatgcaatttctatgcgcacccgttctcggagcactgtccgaccgctttggccgccgcccagtcctgctcgcttcgctacttggagccactatcgactacgcgatcatggcgaccacacccgtcctgtggatcctctacgccggacgcatcgtggccggcatcaccggcgccacaggtgcggttgctggcgcctatatcgccgacatcaccgatggggaagatcgggctcgccacttcgggctcatgagcgcttgtttcggcgtgggtatggtggcaggccccgtggccgggggactgttgggcgccatctccttgcatgcaccattccttgcggcggcggtgctcaacggcctcaacctactactgggctgcttcctaatgcaggagtcgcataagggagagcgtcgaccgatgcccttgagagccttcaacccagtcagctccttccggtgggcgcggggcatgactatcgtcgccgcacttatgactgtcttctttatcatgcaactcgtaggacaggtgccggcagcgctctgggtcattttcggcgaggaccgctttcgctggagcgcgacgatgatcggcctgtcgcttgcggtattcggaatcttgcacgccctcgctcaagccttcgtcactggtcccgccaccaaacgtttcggcgagaagcaggccattatcgccggcatggcggccgacgcgctgggctacgtcttgctggcgttcgcgacgcgaggctggatggccttccccattatgattcttctcgcttccggcggcatcgggatgcccgcgttgcaggccatgctgtccaggcaggtagatgacgaccatcagggacagcttcaaggatcgctcgcggctcttaccagcctaacttcgatcactggaccgctgatcgtcacggcgatttatgccgcctcggcgagcacatggaacgggttggcatggattgtaggcgccgccctataccttgtctgcctccccgcgttgcgtcgcggtgcatggagccgggccacctcgacctgaatggaagccggcggcacctcgctaacggattcaccactccaagaattggagccaatcaattcttgcggagaactgtgaatgcgcaaaccaacccttggcagaacatatccatcgcgtccgccatctccagcagccgcacgcggcgcatctcgggcagcgttgggtcctggccacgggtgcgcatgatcgtgctcctgtcgttgaggacccggctaggctggcggggttgccttactggttagcagaatgaatcaccgatacgcgagcgaacgtgaagcgactgctgctgcaaaacgtctgcgacctgagcaacaacatgaatggtcttcggtttccgtgtttcgtaaagtctggaaacgcggaagtcagcgccctgcaccattatgttccggatctgcatcgcaggatgctgctggctaccctgtggaacacctacatctgtattaacgaagcgctggcattgaccctgagtgatttttctctggtcccgccgcatccataccgccagttgtttaccctcacaacgttccagtaaccgggcatgttcatcatcagtaacccgtatcgtgagcatcctctctcgtttcatcggtatcattacccccatgaacagaaatcccccttacacggaggcatcagtgaccaaacaggaaaaaaccgcccttaacatggcccgctttatcagaagccagacattaacgcttctggagaaactcaacgagctggacgcggatgaacaggcagacatctgtgaatcgcttcacgaccacgctgatgagctttaccgcagctgcctcgcgcgtttcggtgatgacggtgaaaacctctgacacatgcagctcccggagacggtcacagcttgtctgtaagcggatgccgggagcagacaagcccgtcagggcgcgtcagcgggtgttggcgggtgtcggggcgcagccatgacccagtcacgtagcgatagcggagtgtatactggcttaactatgcggcatcagagcagattgtactgagagtgcaccatatgcggtgtgaaataccgcacagatgcgtaaggagaaaataccgcatcaggcgctcttccgcttcctcgctcactgactcgctgcgctcggtcgttcggctgcggcgagcggtatcagctcactcaaaggcggtaatacggttatccacagaatcaggggataacgcaggaaagaacatgtgagcaaaaggccagcaaaaggccaggaaccgtaaaaaggccgcgttgctggcgtttttccataggctccgcccccctgacgagcatcacaaaaatcgacgctcaagtcagaggtggcgaaacccgacaggactataaagataccaggcgtttccccctggaagctccctcgtgcgctctcctgttccgaccctgccgcttaccggatacctgtccgcctttctcccttcgggaagcgtggcgctttctcatagctcacgctgtaggtatctcagttcggtgtaggtcgttcgctccaagctgggctgtgtgcacgaaccccccgttcagcccgaccgctgcgccttatccggtaactatcgtcttgagtccaacccggtaagacacgacttatcgccactggcagcagccactggtaacaggattagcagagcgaggtatgtaggcggtgctacagagttcttgaagtggtggcctaactacggctacactagaaggacagtatttggtatctgcgctctgctgaagccagttaccttcggaaaaagagttggtagctcttgatccggcaaacaaaccaccgctggtagcggtggtttttttgtttgcaagcagcagattacgcgcagaaaaaaaggatctcaagaagatcctttgatcttttctacggggtctgacgctcagtggaacgaaaactcacgttaagggattttggtcatgagattatcaaaaaggatcttcacctagatccttttaaattaaaaatgaagttttaaatcaatctaaagtatatatgagtaaacttggtctgacagttaccaatgcttaatcagtgaggcacctatctcagcgatctgtctatttcgttcatccatagttgcctgactccccgtcgtgtagataactacgatacgggagggcttaccatctggccccagtgctgcaatgataccgcgagacccacgctcaccggctccagatttatcagcaataaaccagccagccggaagggccgagcgcagaagtggtcctgcaactttatccgcctccatccagtctattaattgttgccgggaagctagagtaagtagttcgccagttaatagtttgcgcaacgttgttgccattgctgcaggcatcgtggtgtcacgctcgtcgtttggtatggcttcattcagctccggttcccaacgatcaaggcgagttacatgatcccccatgttgtgcaaaaaagcggttagctccttcggtcctccgatcgttgtcagaagtaagttggccgcagtgttatcactcatggttatggcagcactgcataattctcttactgtcatgccatccgtaagatgcttttctgtgactggtgagtactcaaccaagtcattctgagaatagtgtatgcggcgaccgagttgctcttgcccggcgtcaacacgggataataccgcgccacatagcagaactttaaaagtgctcatcattggaaaacgttcttcggggcgaaaactctcaaggatcttaccgctgttgagatccagttcgatgtaacccactcgtgcacccaactgatcttcagcatcttttactttcaccagcgtttctgggtgagcaaaaacaggaaggcaaaatgccgcaaaaaagggaataagggcgacacggaaatgttgaatactcatactcttcctttttcaatattattgaagcatttatcagggttattgtctcatgagcggatacatatttgaatgtatttagaaaaataaacaaataggggttccgcgcacatttccccgaaaagtgccacctgacgtctaagaaaccattattatcatgacattaacctataaaaataggcgtatcacgaggccctttcgtcttcaagaa
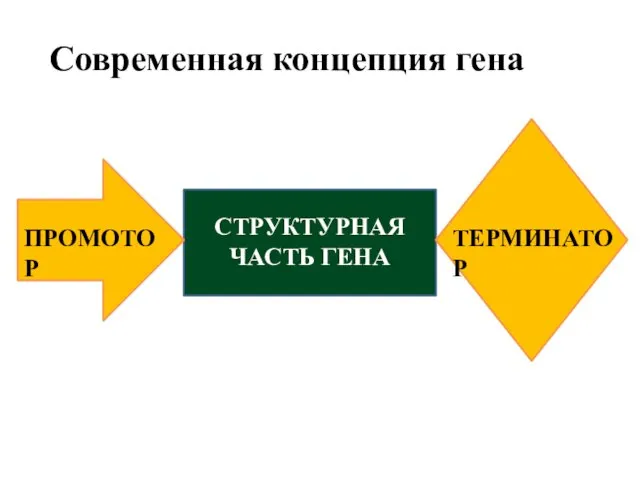
- 11. Современная концепция гена ПРОМОТОР СТРУКТУРНАЯ ЧАСТЬ ГЕНА ТЕРМИНАТОР
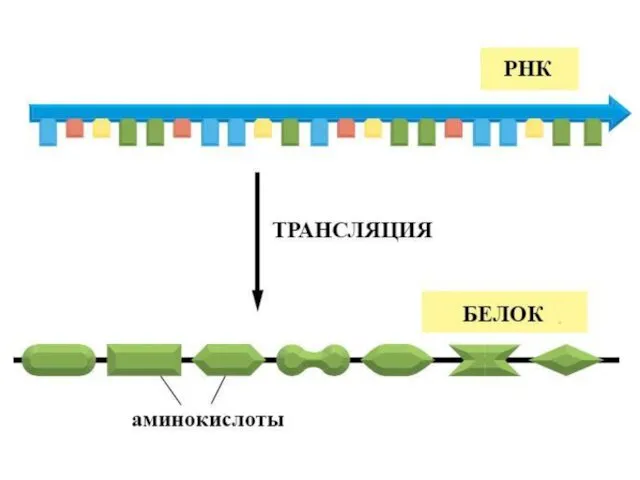
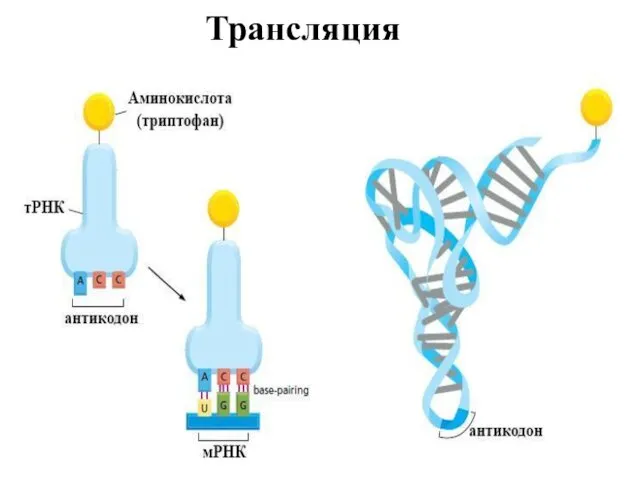
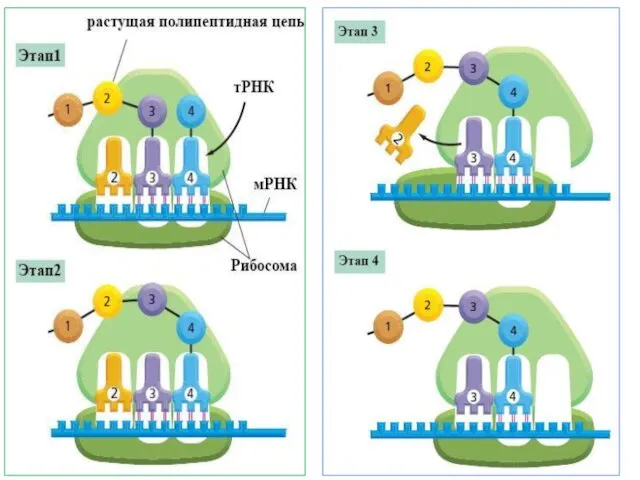
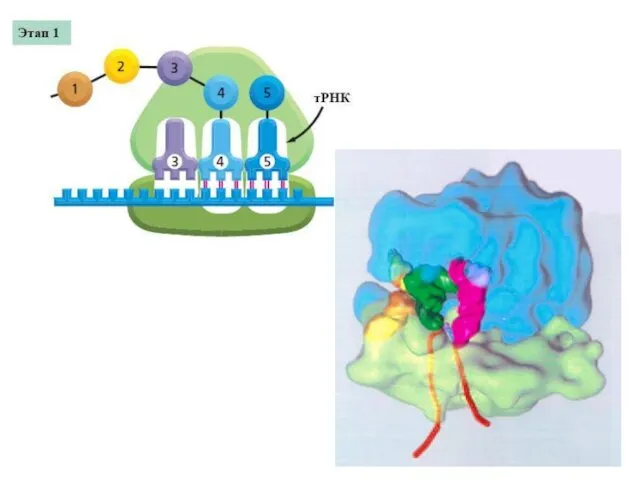
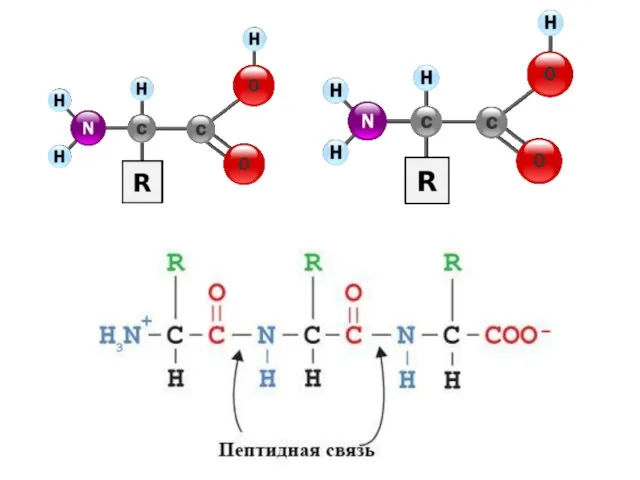
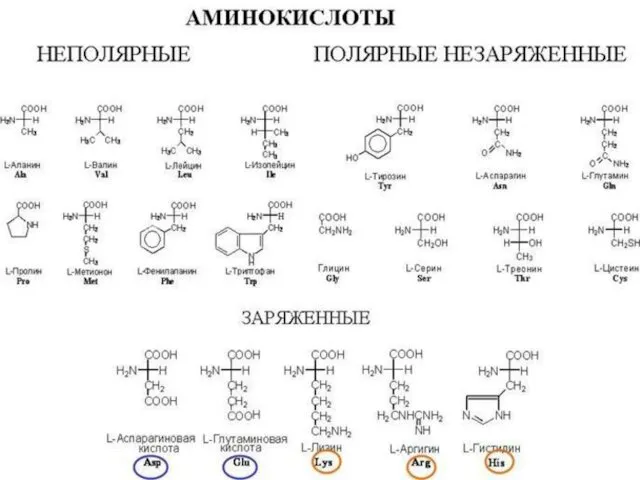
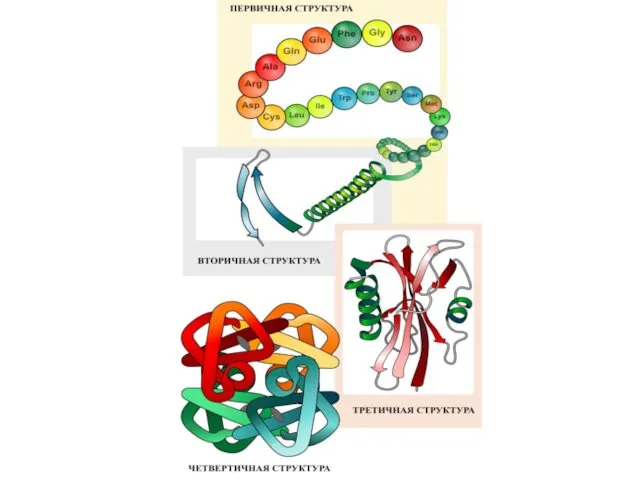
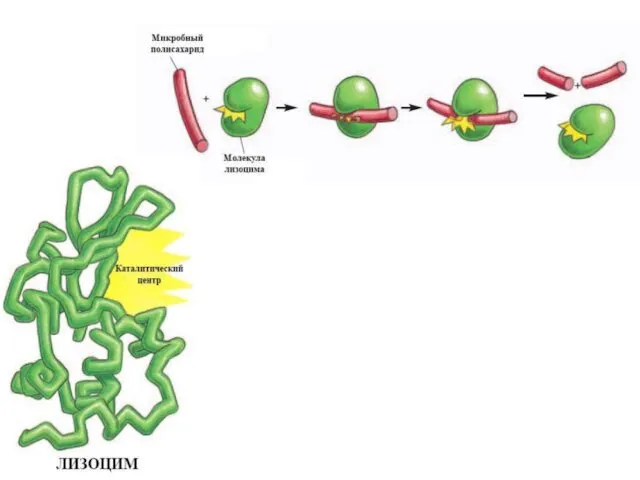
- 17. Трансляция
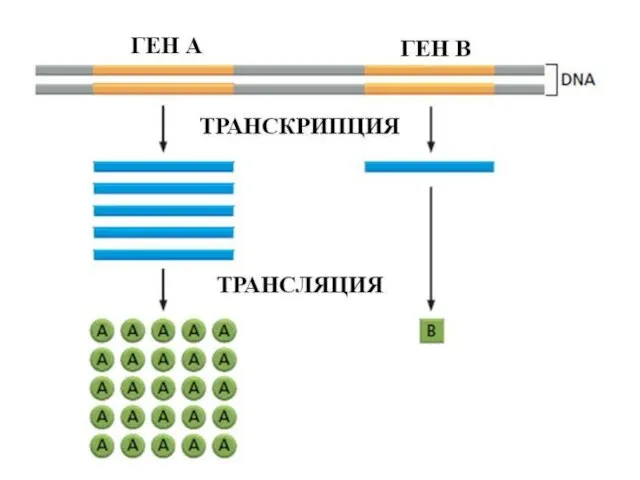
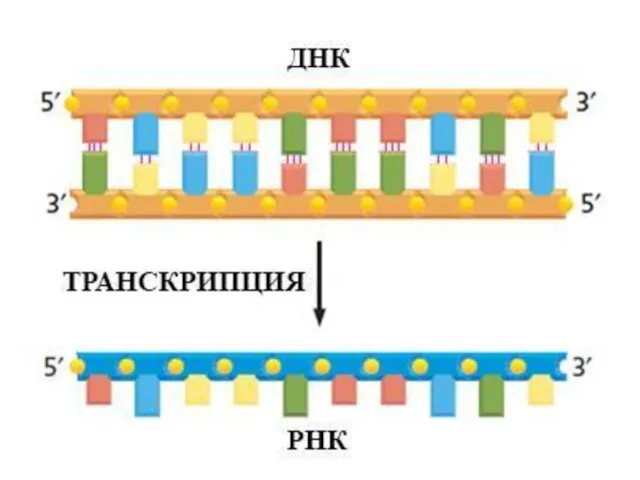
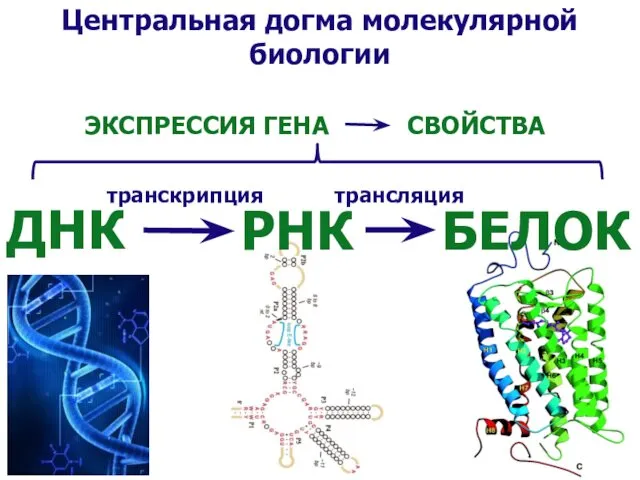
- 24. Центральная догма молекулярной биологии ДНК РНК БЕЛОК транскрипция трансляция ЭКСПРЕССИЯ ГЕНА СВОЙСТВА
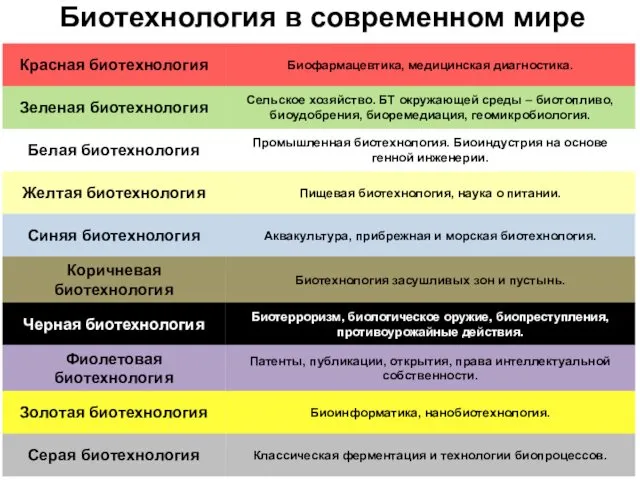
- 25. Биотехнология в современном мире
- 26. Предпосылки возникновения генной инженерии и история развития
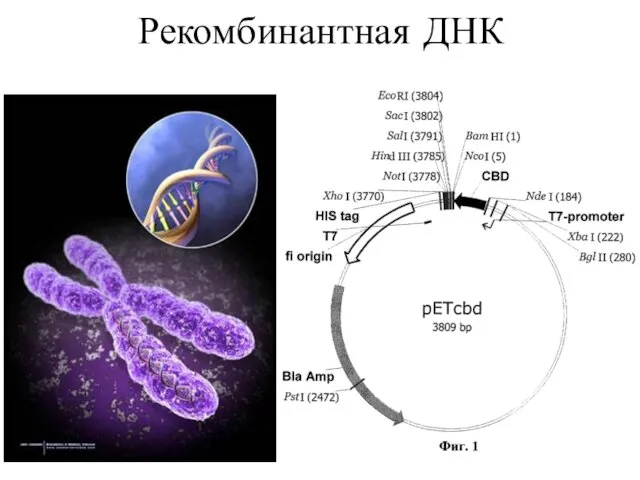
- 27. Рекомбинантная ДНК
- 28. Ферменты, применяемые в генетической инженерии
- 29. I. РЕСТРИКТАЗЫ (ЕС 3.1.21.) ЭНДОНУКЛЕАЗЫ РЕСТРИКЦИИ)
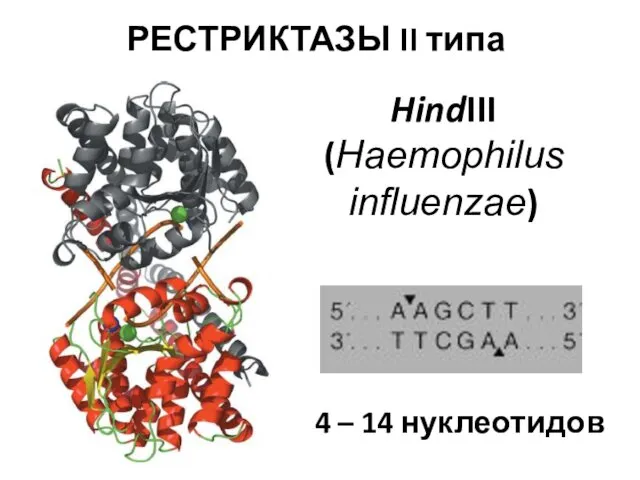
- 30. РЕСТРИКТАЗЫ II типа HindIII (Haemophilus influenzae) 4 – 14 нуклеотидов
- 31. ПАЛИНДРОМЫ А РОЗА УПАЛА НА ЛАПУ АЗОРА По обеим цепям ДНК в одном направлении читаются одинаково
- 32. Рестриктазы в генной инженерии EcoRI (E. coli RY13) NdeI (Neisseria denitrificans) BamHI (Bacillus amyloliquefaciens H) BglII
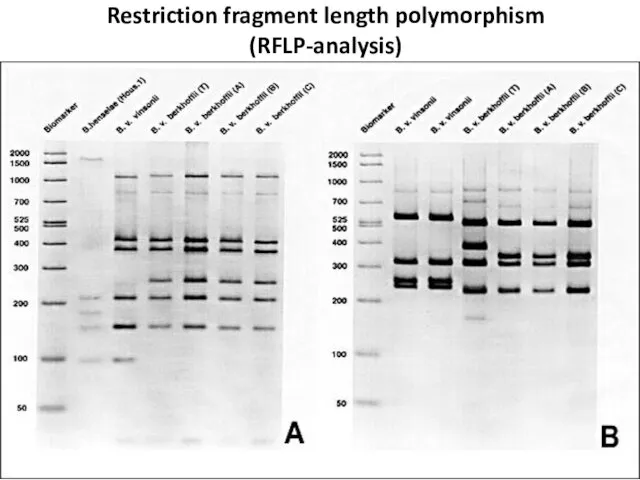
- 33. Restriction fragment length polymorphism (RFLP-analysis)
- 34. II. ЛИГАЗА (EC 6.5.1.1)
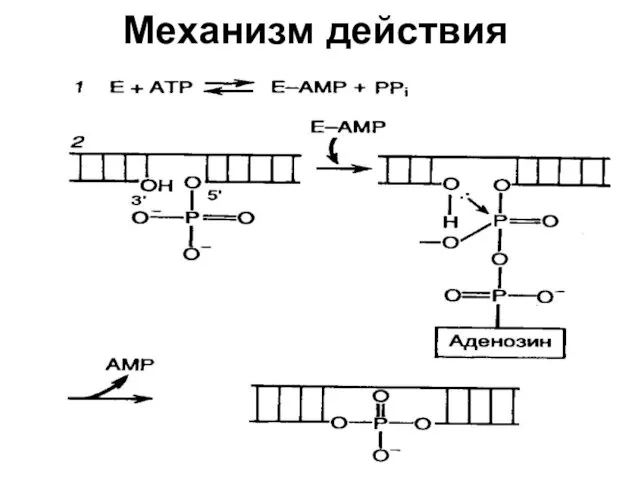
- 35. Механизм действия
- 36. ДНК-лигаза фага Т4 Единица активности лигазы соответствует количеству фермента, необходимого для лигирования фрагментов ДНК фага λ
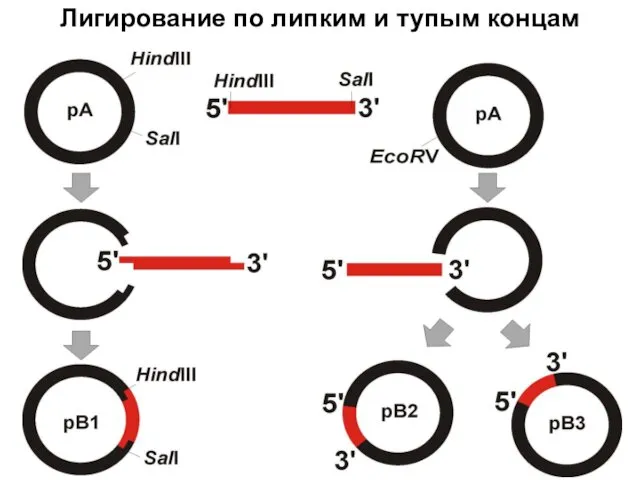
- 37. Лигирование по липким и тупым концам
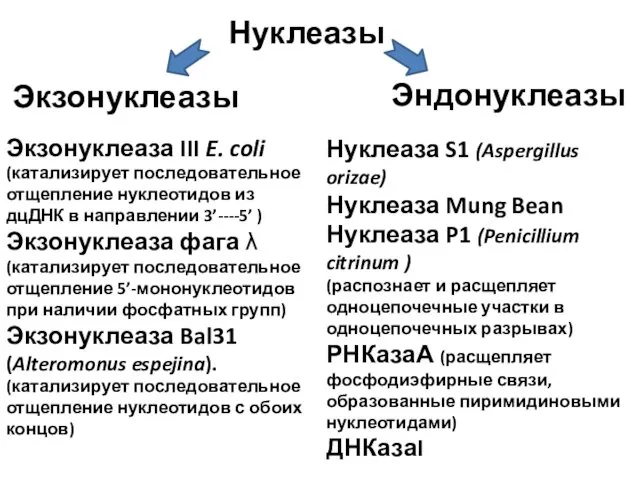
- 38. V. Нуклеазы – гидролитические ферменты, расщепляющие фосфодиэфирные связи в нуклеиновых кислотах
- 39. Нуклеазы Экзонуклеазы Эндонуклеазы Экзонуклеаза III E. coli (катализирует последовательное отщепление нуклеотидов из дцДНК в направлении 3’----5’
- 40. V. ДНК-полимеразы
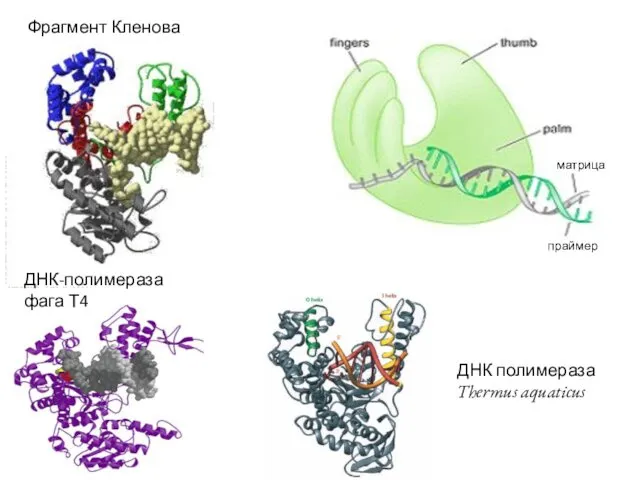
- 41. Репликация ДНК
- 42. матрица праймер Фрагмент Кленова ДНК-полимераза фага Т4 ДНК полимераза Thermus aquaticus
- 43. ДНК-полимеразы термофильных архебактерий
- 44. История открытия Апрель 1983 г – идея ПЦР Декабрь 1983 г – осуществление ПЦР 1993 г
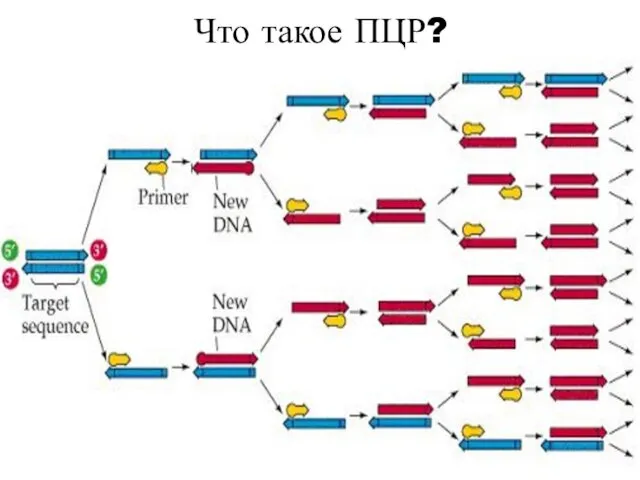
- 45. Что такое ПЦР? По сути, это упрощенная версия репликации бактерий, при которой возрастает количество копий специфической
- 46. Что такое ПЦР?
- 47. Сравнение ПЦР и репликации in vivo (1)
- 48. Сравнение ПЦР и репликации in vivo (2)
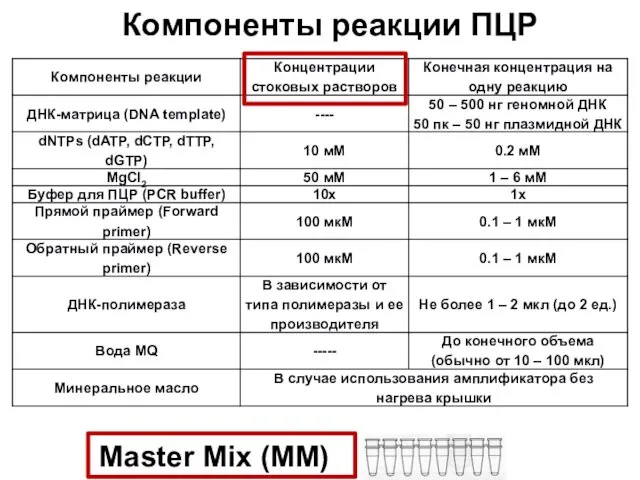
- 49. Компоненты реакции ПЦР Master Mix (MM)
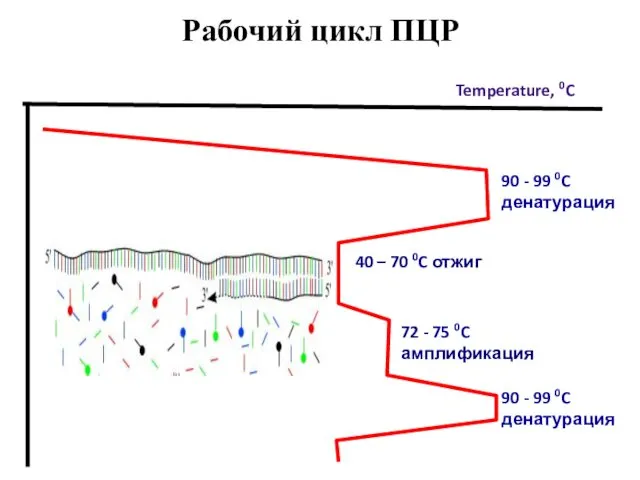
- 50. 72 - 75 0C амплификация 90 - 99 0C денатурация Temperature, 0C 40 – 70 0C
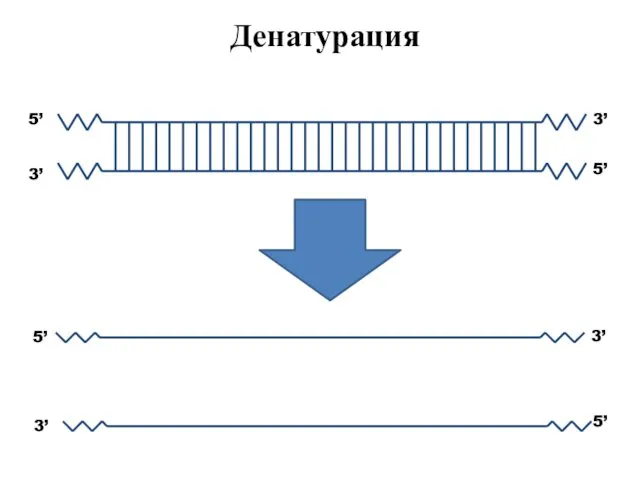
- 51. Денатурация 3’ 5’ 5’ 3’ 5’ 3’ 3’ 5’
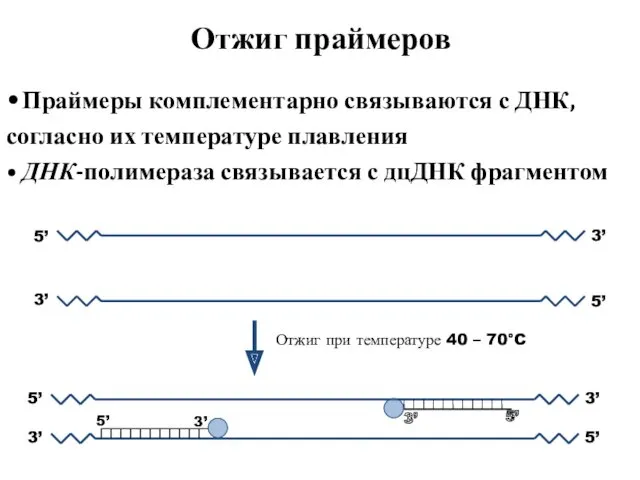
- 52. Отжиг праймеров 3’ 5’ 5’ 3’ • Праймеры комплементарно связываются с ДНК, согласно их температуре плавления
- 53. Температура плавления (T melting, Tm) Под температурой плавления понимают температуру, при которой половина молекул гибридизована (находится
- 54. Расчет оптимальной температуры денатурации ампликона Td=Tm+3-40С
- 55. Температура отжига (T annealing, Ta) Ta=Tm – 50С (по Ребрикову) Ta=Tm – 100С (по Патрушеву) Под
- 56. Задача №1 Определите температуры плавления и отжига следующего олигонуклеотида: 5’ GGCATTTAGCTTAGGC 3’ Решение: N=16: А=3, Т=5,
- 57. Задача №2 Определите температуры плавления и отжига следующего олигонуклеотида: 5’ GGCATTTAGCTTAGGCTTAAGGCGGGAG 3’ Решение: N=28: А=6, Т=7,
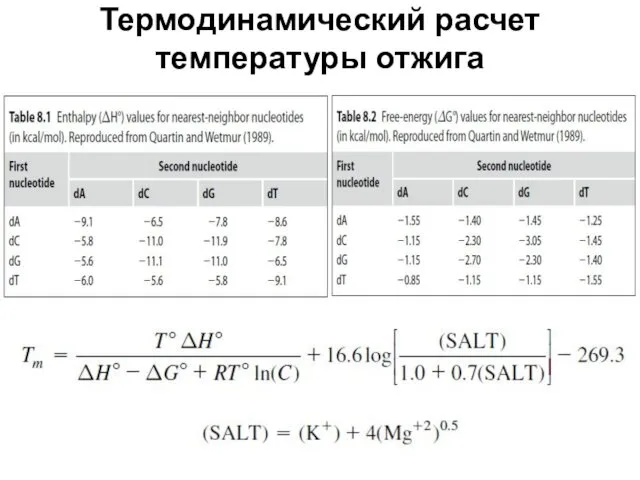
- 58. Термодинамический расчет температуры отжига
- 59. Конструирование (дизайн) праймеров: При подборе праймеров зачастую удобно использовать програмное обеспечение, упрощающее поиск подходящих регионов или
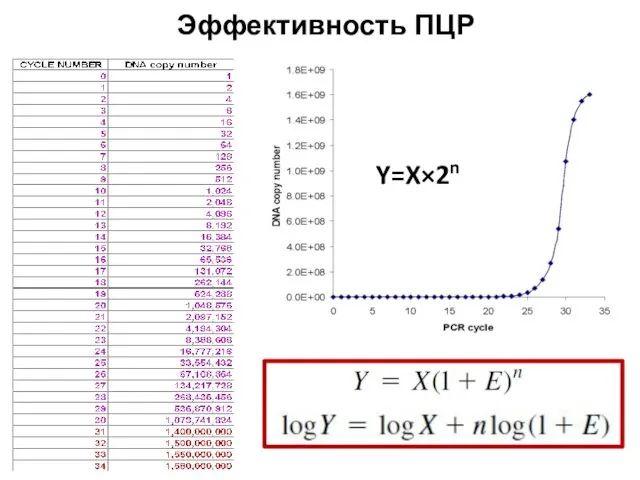
- 60. Эффективность ПЦР Y=X×2n
- 61. ПЦР в реальном времени
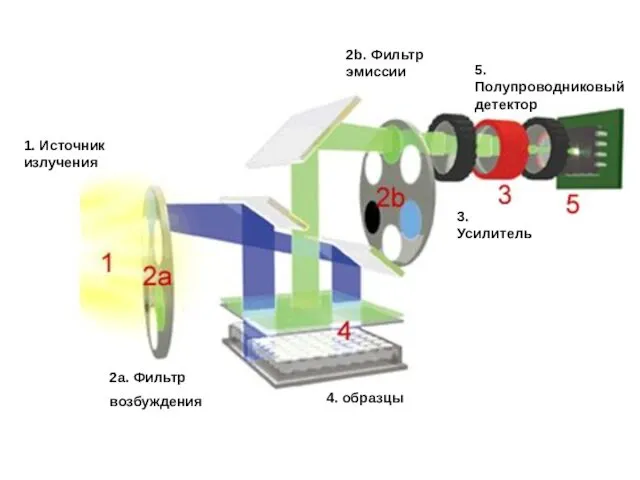
- 62. 2a. Фильтр возбуждения 2b. Фильтр эмиссии 1. Источник излучения 4. образцы 3. Усилитель 5. Полупроводниковый детектор
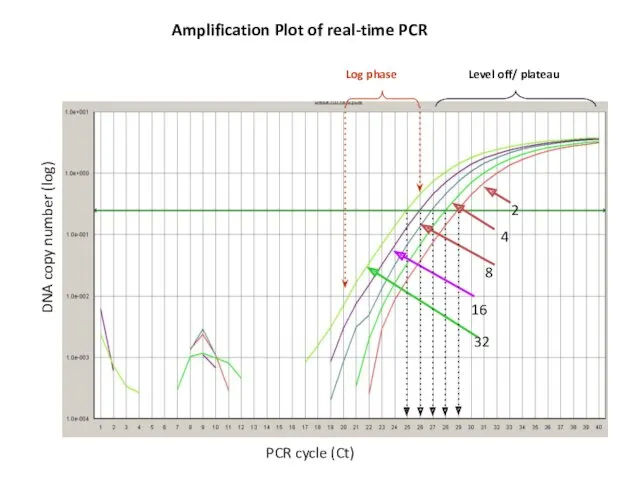
- 63. Amplification Plot of real-time PCR DNA copy number (log) PCR cycle (Ct)
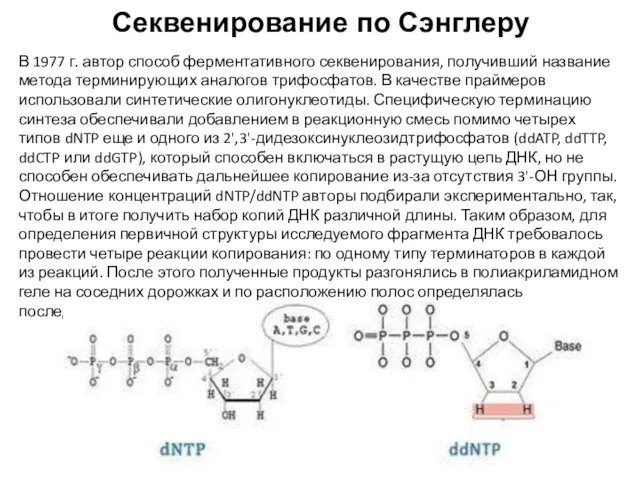
- 64. Секвенирование по Сэнглеру В 1977 г. автор способ ферментативного секвенирования, получивший название метода терминирующих аналогов трифосфатов.
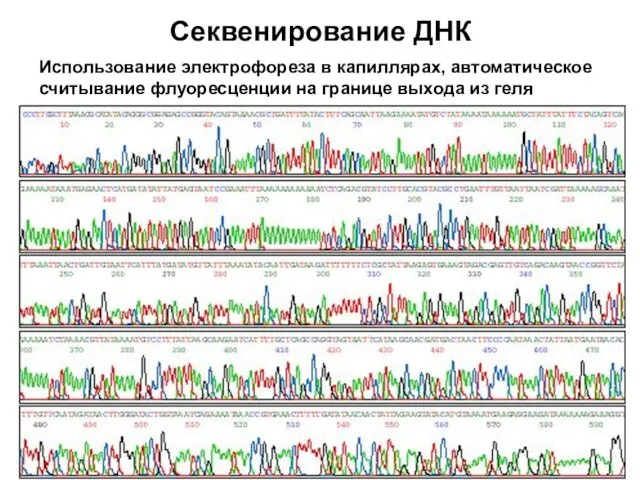
- 65. Секвенирование ДНК Использование электрофореза в капиллярах, автоматическое считывание флуоресценции на границе выхода из геля
- 66. Обратная транскриптаза (КФ 2.7.7.49) (ревертаза)
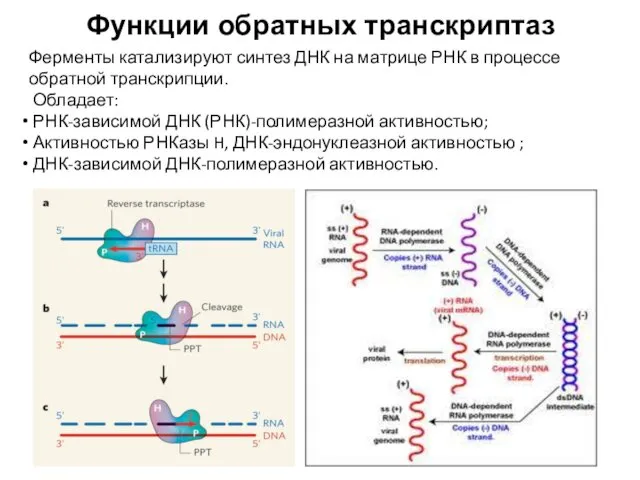
- 67. Функции обратных транскриптаз Ферменты катализируют синтез ДНК на матрице РНК в процессе обратной транскрипции. Обладает: РНК-зависимой
- 68. Обратные транскриптазы в генной инженерии Обратная транскриптаза вируса миелобластоза птиц (Avian Myeloblastosis Virus, AMV) Помимо 5’-
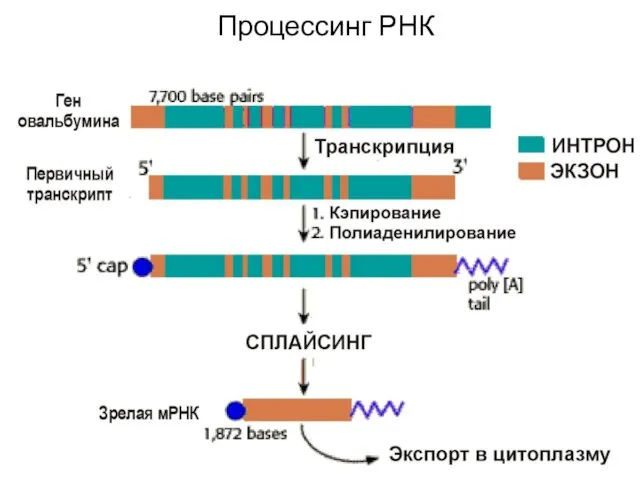
- 69. Процессинг РНК
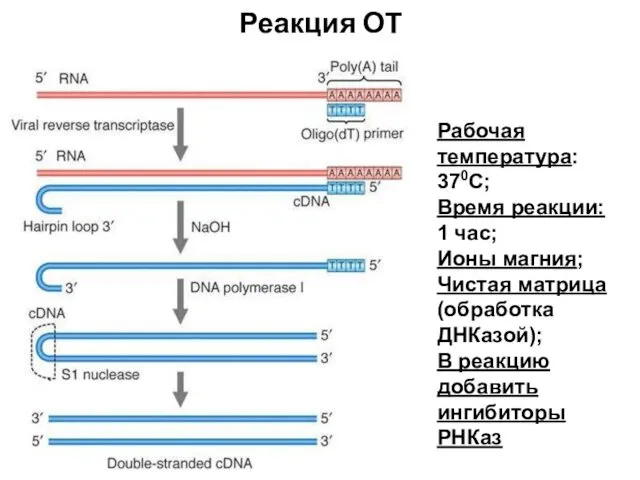
- 70. Реакция ОТ Рабочая температура: 370С; Время реакции: 1 час; Ионы магния; Чистая матрица (обработка ДНКазой); В
- 71. ДНК-полимераза Tth Обратная транскрипция и ПЦР в одной пробирке !!!
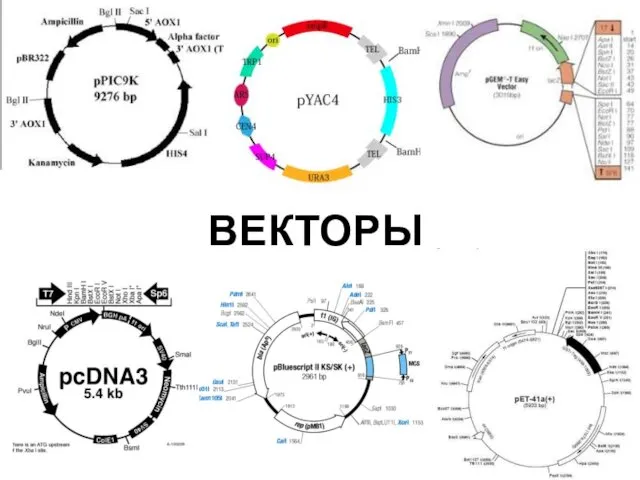
- 72. ВЕКТОРЫ
- 73. Что такое вектор? Вектор – молекула ДНК, используемая в генетической инженерии для передачи генетического материала другой
- 74. Свойства векторов По функциям: Векторы для клонирования Векторы для экспрессии Векторы для трансформации По месту применения:
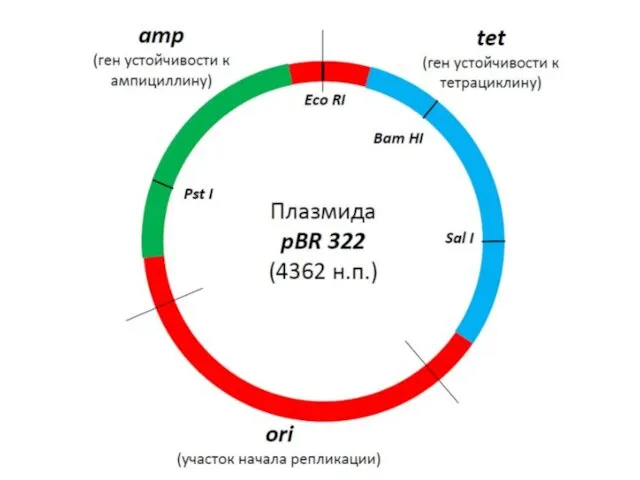
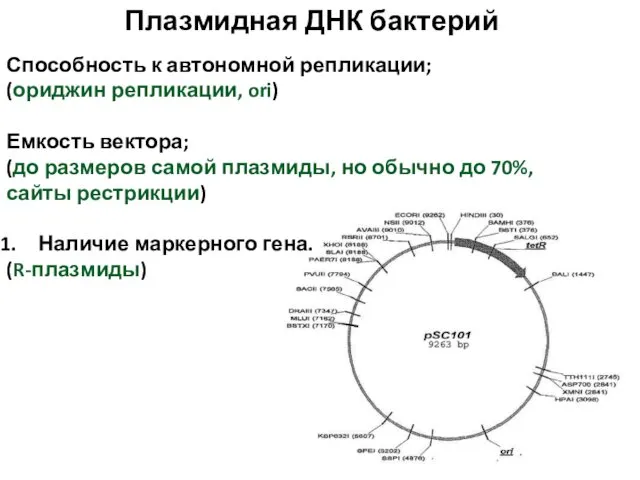
- 75. Плазмидная ДНК бактерий Способность к автономной репликации; (ориджин репликации, ori) Емкость вектора; (до размеров самой плазмиды,
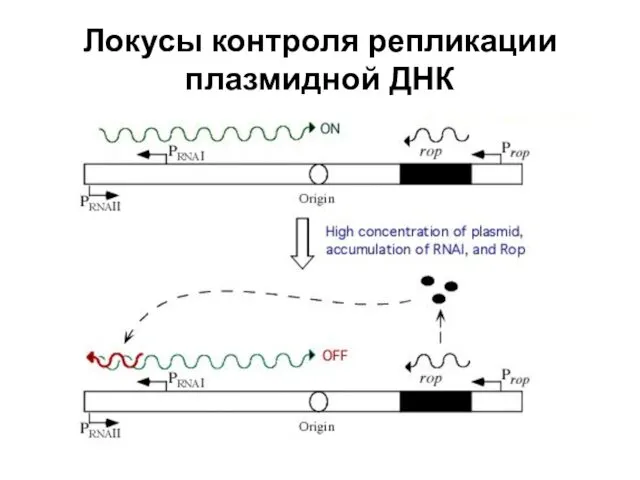
- 76. Локусы контроля репликации плазмидной ДНК
- 77. Создание плазмид с повышенной копийностью _____________________________________________ Плазмида Ori Копийность Классификация _____________________________________________ pUC pMB1* 500 – 700
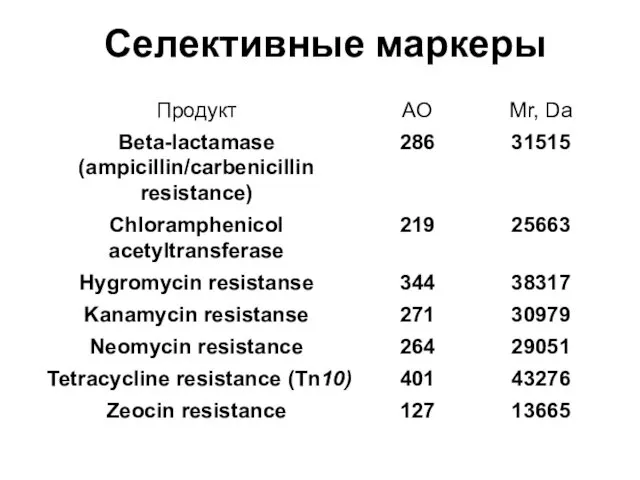
- 78. Селективные маркеры
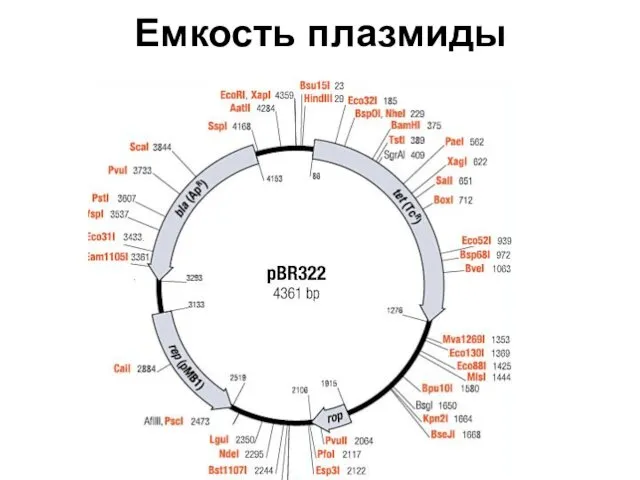
- 79. Емкость плазмиды
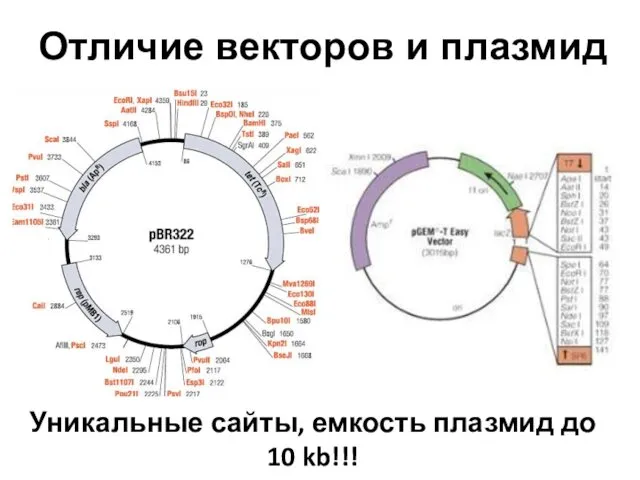
- 80. Отличие векторов и плазмид Уникальные сайты, емкость плазмид до 10 kb!!!
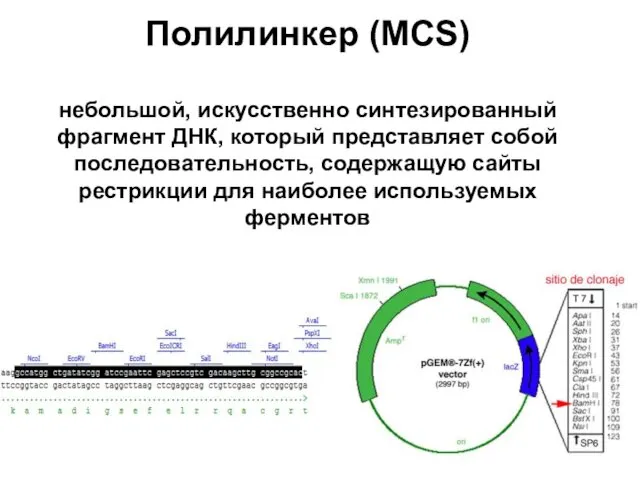
- 81. Полилинкер (MCS) небольшой, искусственно синтезированный фрагмент ДНК, который представляет собой последовательность, содержащую сайты рестрикции для наиболее
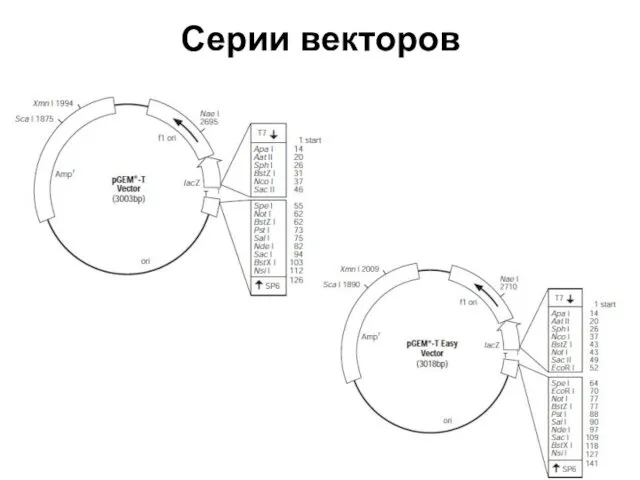
- 82. Серии векторов
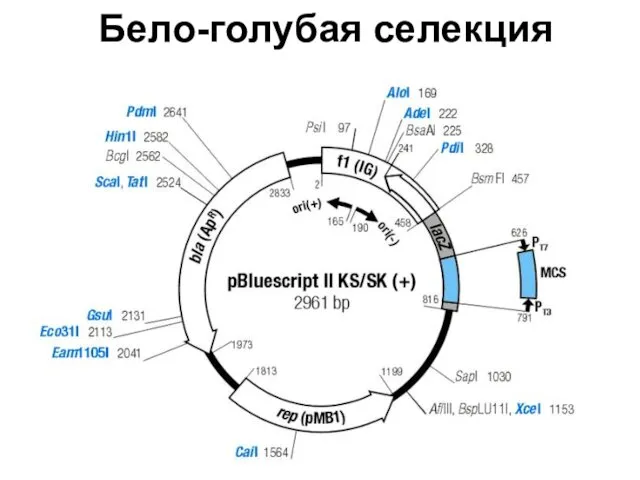
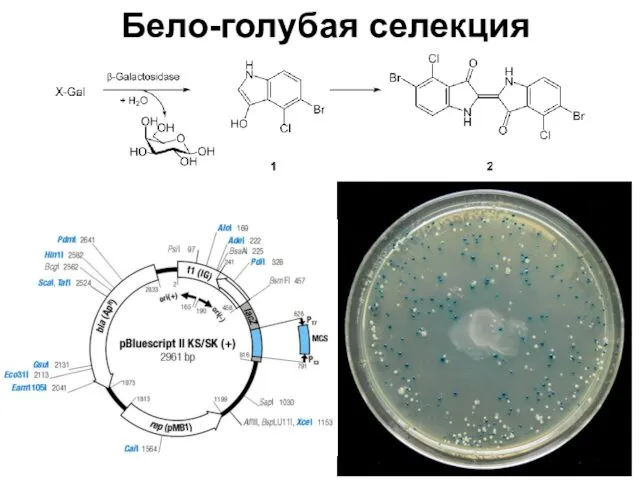
- 83. Бело-голубая селекция
- 84. Бело-голубая селекция ИПТГ – индуктор lac-оперона X-Gal – хромогенный субстрат
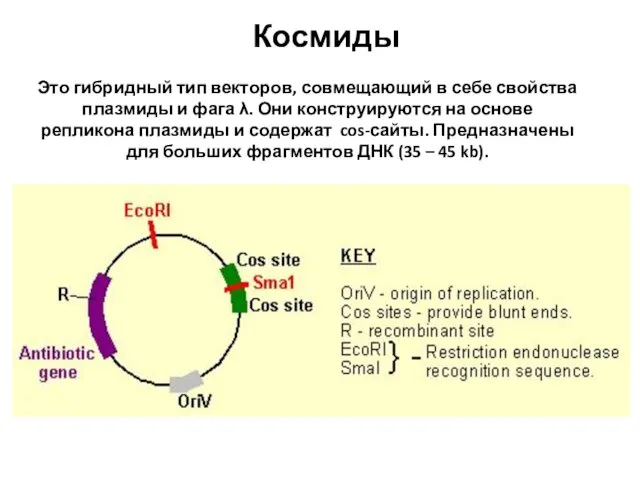
- 85. Космиды Это гибридный тип векторов, совмещающий в себе свойства плазмиды и фага λ. Они конструируются на
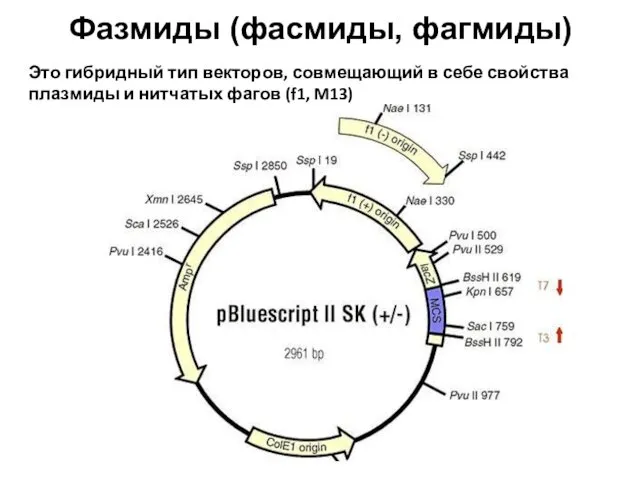
- 86. Фазмиды (фасмиды, фагмиды) Это гибридный тип векторов, совмещающий в себе свойства плазмиды и нитчатых фагов (f1,
- 87. Искусственные хромосомы
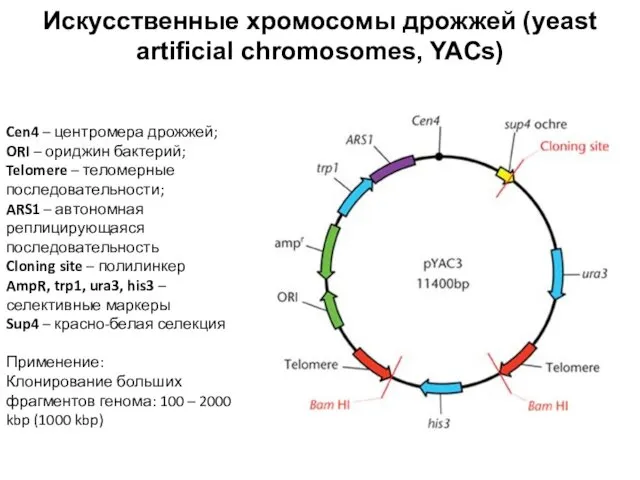
- 88. Искусственные хромосомы дрожжей (yeast artificial chromosomes, YACs) Cen4 – центромера дрожжей; ORI – ориджин бактерий; Telomere
- 89. Создание геномных библиотек
- 90. Геномные библиотеки (банки генов) Геномная библиотека – фрагменты генома, клонированные в фаге λ (фаговые библиотеки) или
- 91. Принцип конструирования геномных библиотек
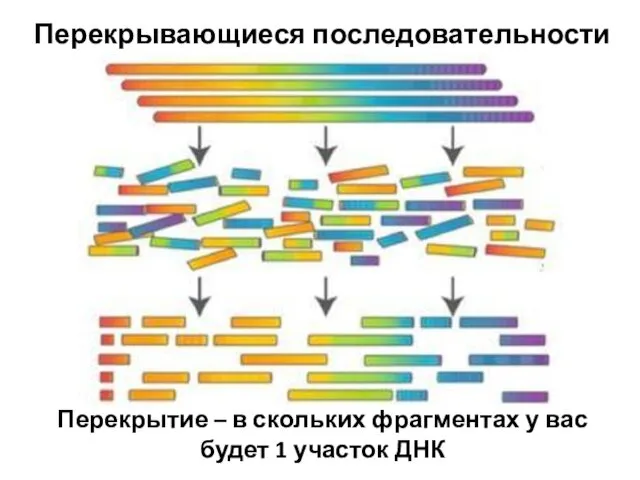
- 92. Перекрывающиеся последовательности Перекрытие – в скольких фрагментах у вас будет 1 участок ДНК
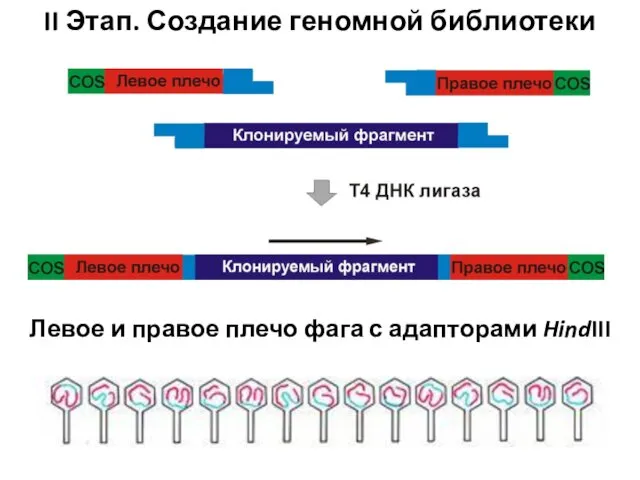
- 93. II Этап. Создание геномной библиотеки Левое и правое плечо фага с адапторами HindIII
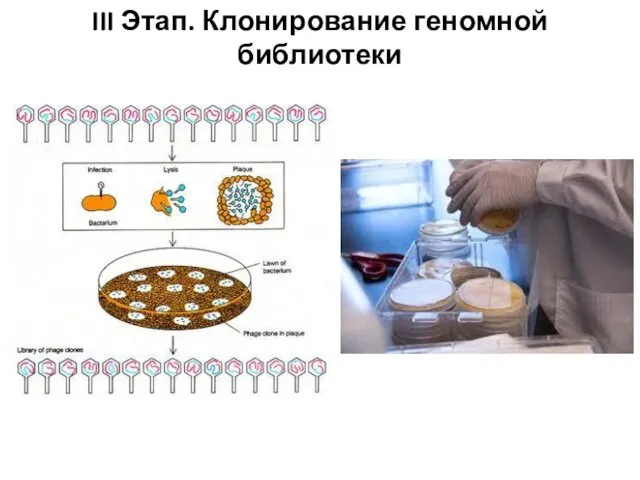
- 94. III Этап. Клонирование геномной библиотеки
- 95. Расчет количества клонов, необходимых для получения геномной библиотеки Где N – количество клонов, P – вероятность
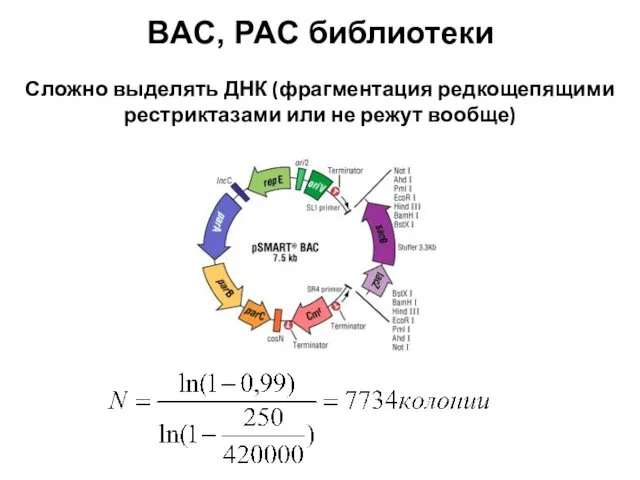
- 96. BAC, PAC библиотеки Сложно выделять ДНК (фрагментация редкощепящими рестриктазами или не режут вообще)
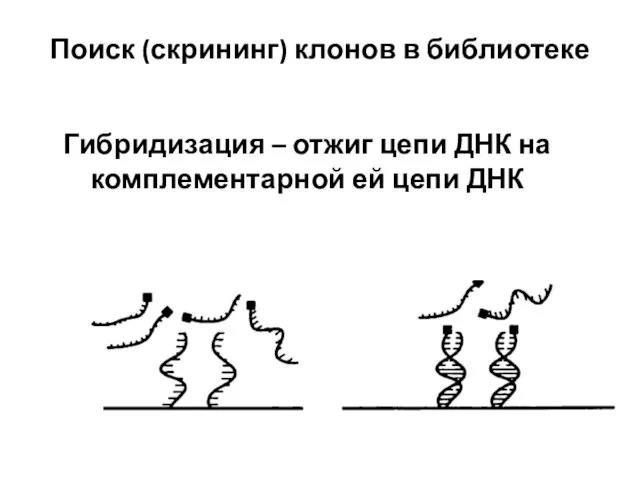
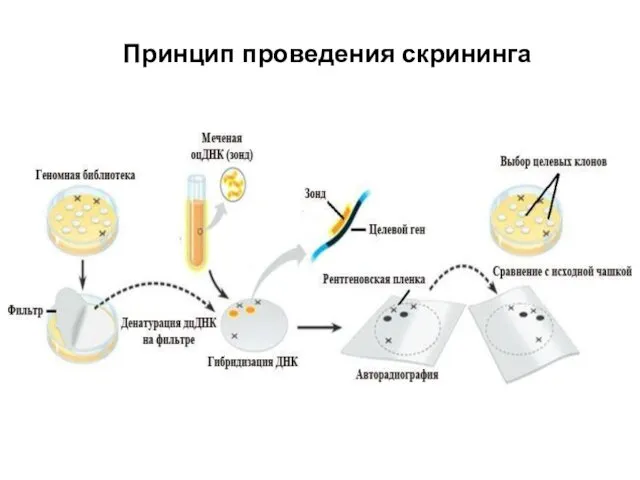
- 97. Поиск (скрининг) клонов в библиотеке Гибридизация – отжиг цепи ДНК на комплементарной ей цепи ДНК
- 98. Принцип проведения скрининга
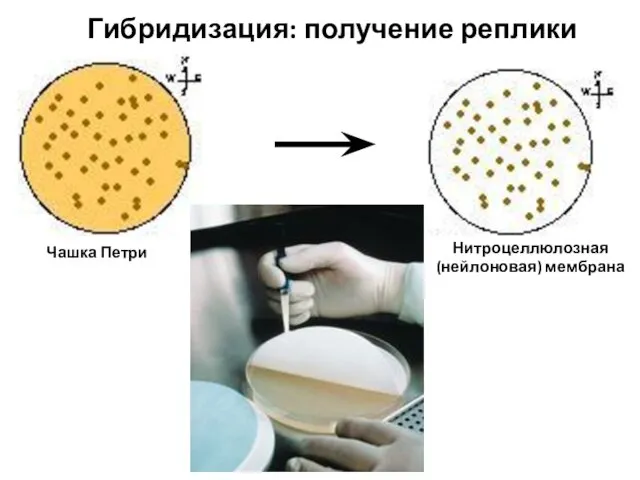
- 99. Гибридизация: получение реплики Чашка Петри Нитроцеллюлозная (нейлоновая) мембрана
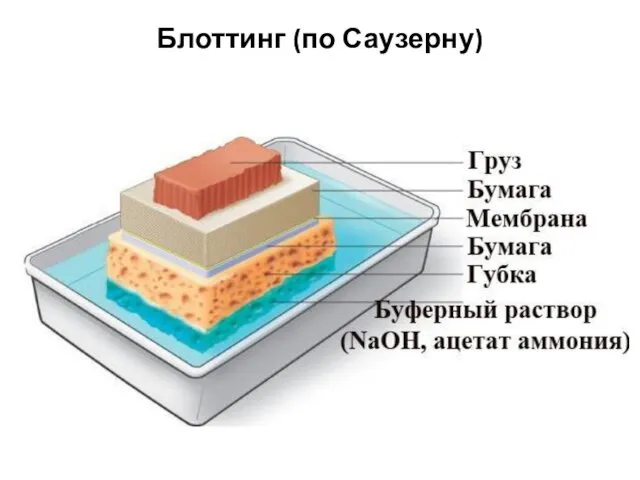
- 100. Блоттинг (по Саузерну)
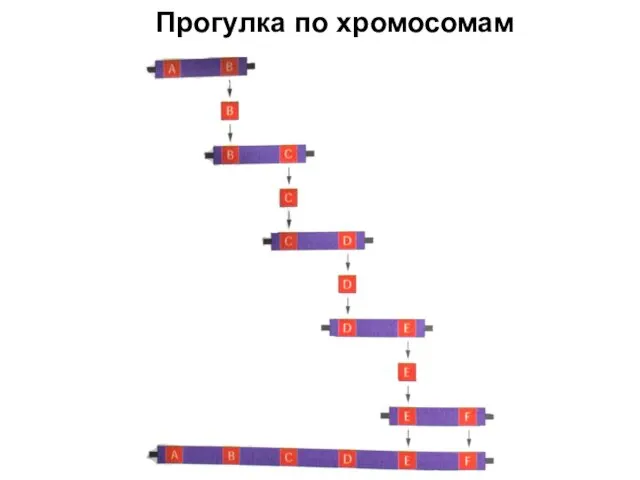
- 101. Прогулка по хромосомам
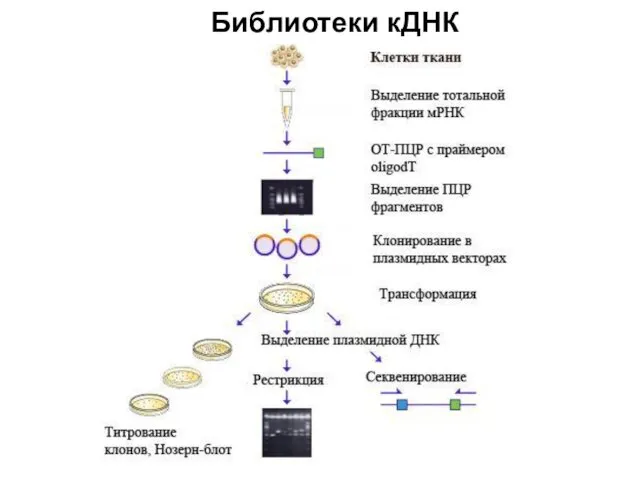
- 102. Библиотеки кДНК
- 103. ТРАНСГЕННЫЕ РАСТЕНИЯ
- 104. 50-е годы XX века Получение культур in vitro - растений «в пробирке»
- 105. 1983 год, первое трансгенное растение Растение табака, устойчивое к канамицину
- 106. 1990 год, первое трансгенное растение, пошедшее «в поля» Растения хлопка, устойчивые к насекомым
- 107. 1994 год, томаты «flavr savr» Устойчивость к бактериальным гнилям
- 108. 1995 год, Monsanto Соя, устойчивая к гербицидам
- 109. Картофель, устойчивый к колородскому жуку Кукуруза, устойчивая к кукурузной огневке, гербицидам Папайя, устойчивая к вирусу кольцевой
- 110. Suntory – голубая трансгенная роза (дигидрокверцитин 5’-гидролаза)
- 111. - трансформация клеток Как получают трансгенные растения? - Получение культур и регенерация культур in vitro
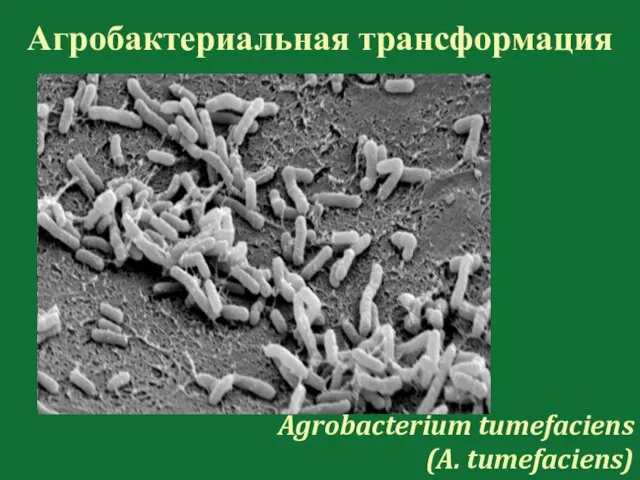
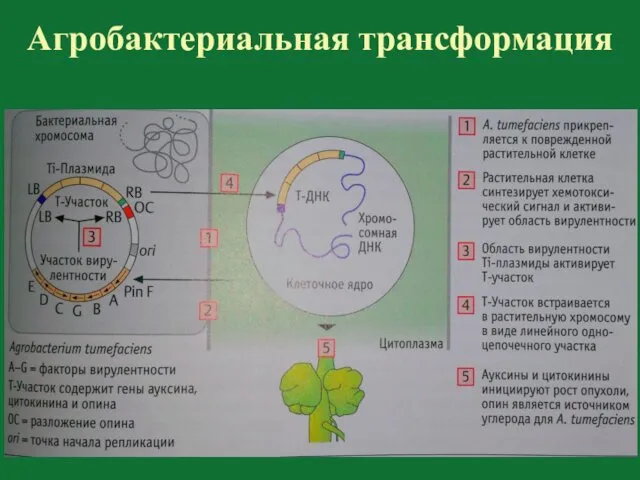
- 112. Агробактериальная трансформация Agrobacterium tumefaciens (A. tumefaciens)
- 113. A. tumefaciens вызывает болезнь корончатых галлов
- 114. Корончатые галлы состоят из дедифференцированных клеток
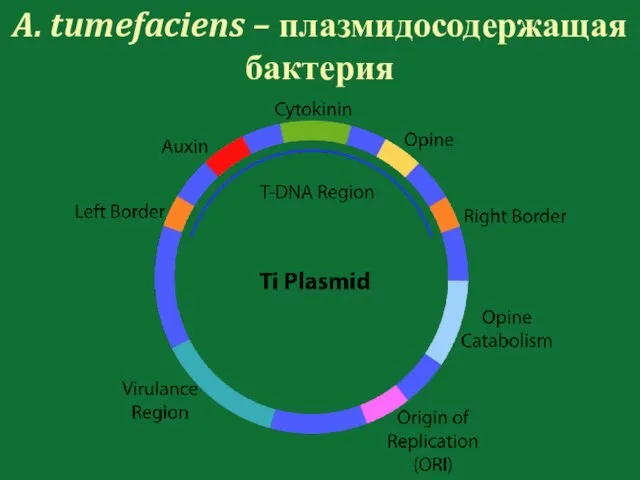
- 115. A. tumefaciens – плазмидосодержащая бактерия
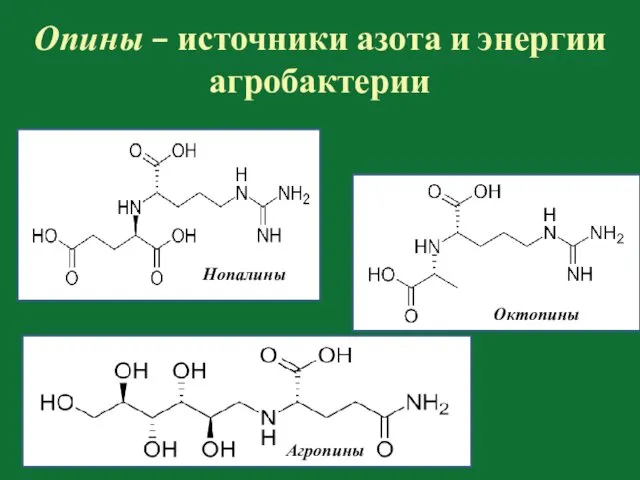
- 116. Опины – источники азота и энергии агробактерии Нопалины Октопины Агропины
- 117. (локус shi) (локус roi)
- 118. Агробактериальная трансформация
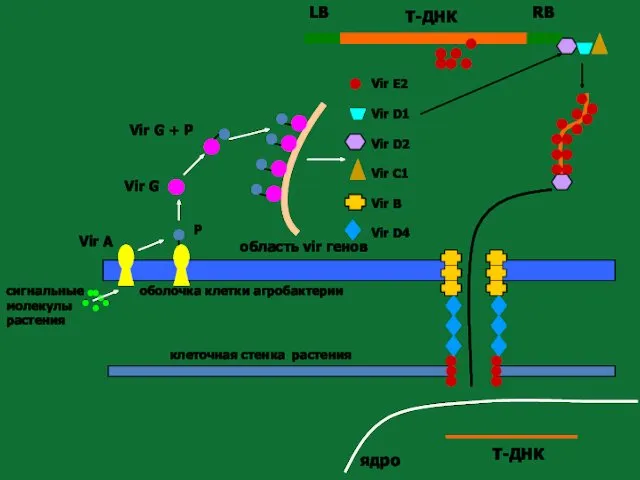
- 119. клеточная стенка растения оболочка клетки агробактерии Vir A сигнальные молекулы растения P Vir G Vir G
- 120. Влияние растительных гормонов на клетку
- 122. Оценка устойчивости трансгенных линий сахарной свеклы к действию гербицида «Баста» КОНТРОЛЬ ТРАНСГЕННЫЕ ЛИНИИ ТРАНСГЕННЫЕ ЛИНИИ ТРАНСГЕННЫЕ
- 123. Получение трансгенного картофеля
- 124. Участок, зарегистрированный МВК ГИД, Краснодар, ВНИИБЗР Контрольные растения ГМ сорт Невский ГМ сорт Луговской
- 125. Контрольные растения, 150 mM NaCl Трансгенные растения, 150 mM NaCl Контрольные растения Трансгенные растения NaCl 25
- 126. РИС (Oryza sativa ) Основной пищевой продукт, производимый в мире Низкое содержание витамина А и железа
- 127. “Золотой” рис с повышенным содержанием β -каротина
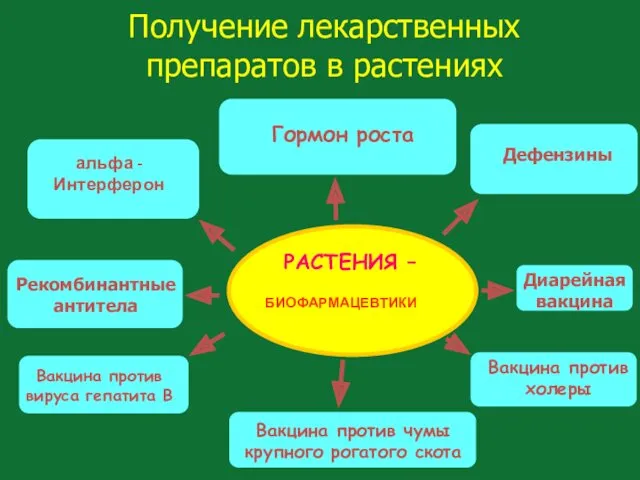
- 128. Получение лекарственных препаратов в растениях РАСТЕНИЯ – БИОФАРМАЦЕВТИКИ
- 130. Скачать презентацию















































 Cargo transportation by road transport
Cargo transportation by road transport Бензоэлектрический агрегат
Бензоэлектрический агрегат Правила конструктивного общения
Правила конструктивного общения Презентация Предметно-развивающая среда группы раннего возраста
Презентация Предметно-развивающая среда группы раннего возраста Патология органов речи
Патология органов речи Словосочетание. Виды словосочетаний
Словосочетание. Виды словосочетаний Топографическая анатомия и оперативная хирургия желудка
Топографическая анатомия и оперативная хирургия желудка Игра Автоматизация звука [Л]
Игра Автоматизация звука [Л] Специфика труда и рынка труда в современном обществе
Специфика труда и рынка труда в современном обществе Публицистический стиль. Функции языка, реализуемые в публицистических текстах. Лексика и фразеология
Публицистический стиль. Функции языка, реализуемые в публицистических текстах. Лексика и фразеология Монастыри Православной Церкви в Америке
Монастыри Православной Церкви в Америке Теория производства
Теория производства Создание Web-страниц
Создание Web-страниц Изобретения в XX-XXI веках
Изобретения в XX-XXI веках Шаблоны презентаций - 9
Шаблоны презентаций - 9 Проект Костюм рыцаря
Проект Костюм рыцаря Теория социального характера Д. Рисмена
Теория социального характера Д. Рисмена Різдвяний вертеп
Різдвяний вертеп Е. Чарушин Теремок
Е. Чарушин Теремок Таблица сложения. Тренажёр Игра в футбол
Таблица сложения. Тренажёр Игра в футбол Возможности электронного журнала
Возможности электронного журнала Символы России. 5 класс
Символы России. 5 класс Архитектура ПК
Архитектура ПК Конструкции котлов. Лекция 4
Конструкции котлов. Лекция 4 Презентация Конкурс пословиц о матери
Презентация Конкурс пословиц о матери Вальдорфская педагогика раннего развития
Вальдорфская педагогика раннего развития Внешняя политика СССР в 30-е годы ХХ века
Внешняя политика СССР в 30-е годы ХХ века Методы измерения и приборное обеспечение радиационно-экологического мониторинга. (Лекция 6)
Методы измерения и приборное обеспечение радиационно-экологического мониторинга. (Лекция 6)