Содержание
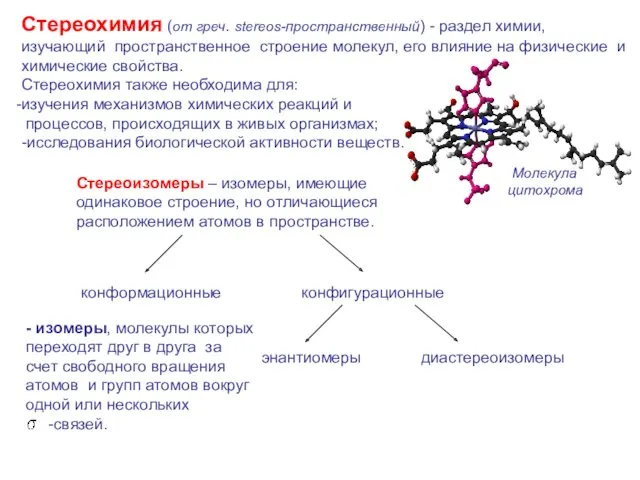
- 2. Стереохимия (от греч. stereos-пространственный) - раздел химии, изучающий пространственное строение молекул, его влияние на физические и
- 3. Энантиомеры – стереоизомеры, относящиеся друг к другу как предмет и несовместимое с ним зеркальное изображение. Хиральность
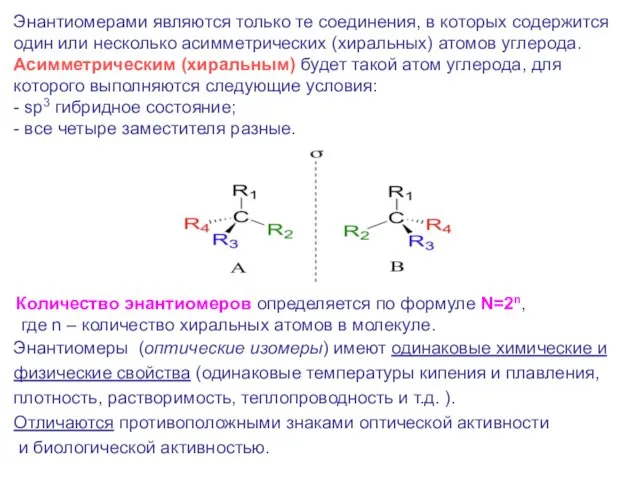
- 4. Энантиомерами являются только те соединения, в которых содержится один или несколько асимметрических (хиральных) атомов углерода. Асимметрическим
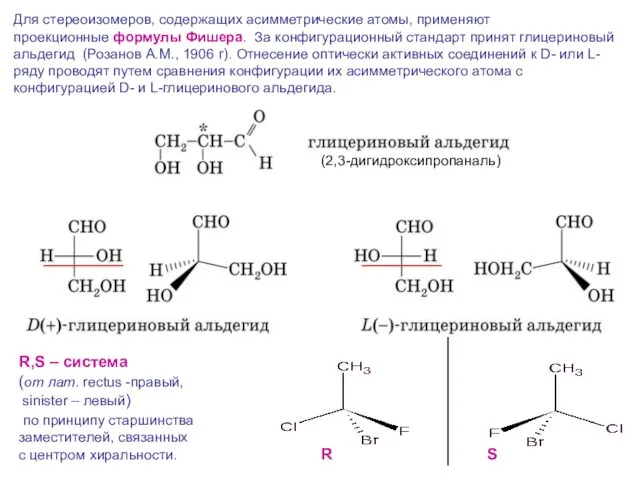
- 5. Для стереоизомеров, содержащих асимметрические атомы, применяют проекционные формулы Фишера. За конфигурационный стандарт принят глицериновый альдегид (Розанов
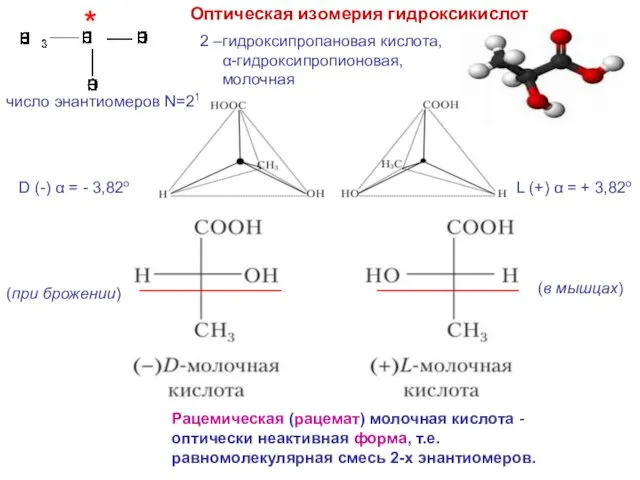
- 6. Оптическая изомерия гидроксикислот * 2 –гидроксипропановая кислота, α-гидроксипропионовая, молочная D (-) α = - 3,82о L
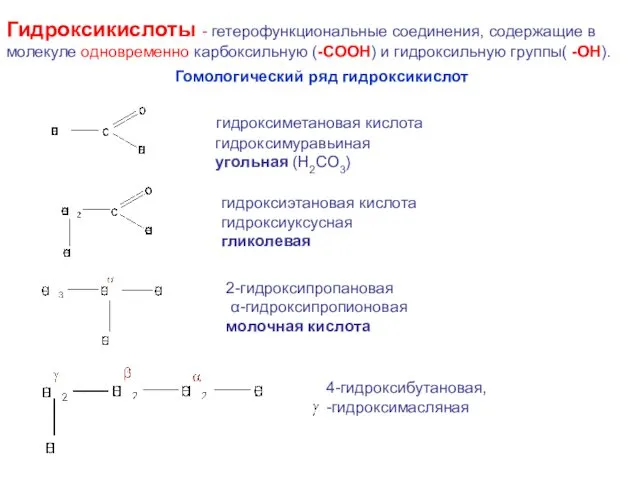
- 7. Гидроксикислоты - гетерофункциональные соединения, содержащие в молекуле одновременно карбоксильную (-СООН) и гидроксильную группы( -ОН). Гомологический ряд
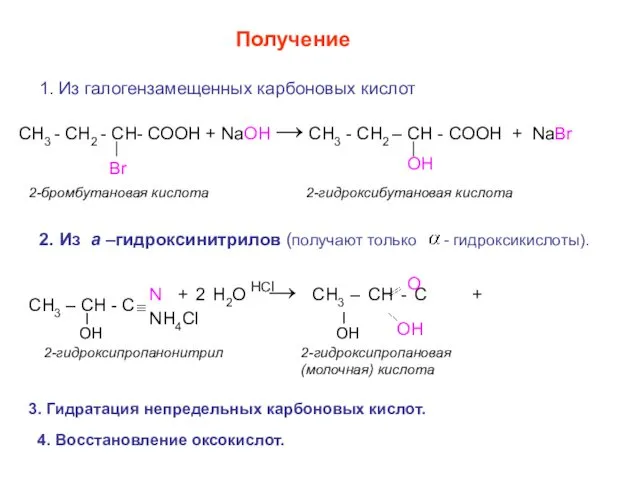
- 8. 1. Из галогензамещенных карбоновых кислот Получение СН3 - СН2 - СН- СООН + NaOH → CH3
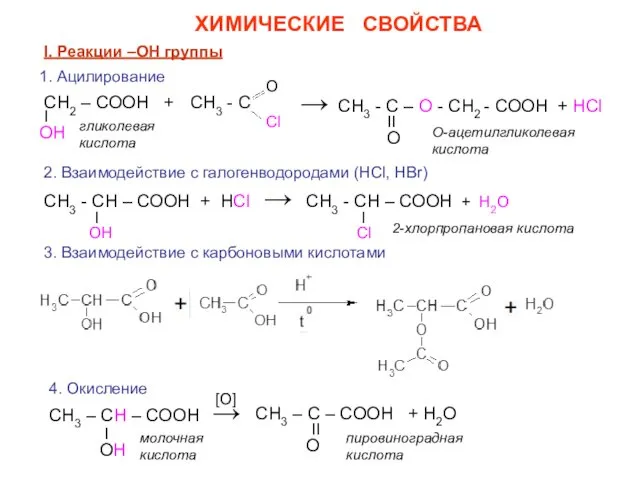
- 9. СН2 – СООН + ХИМИЧЕСКИЕ СВОЙСТВА I. Реакции –ОН группы 1. Ацилирование СН3 - СН –
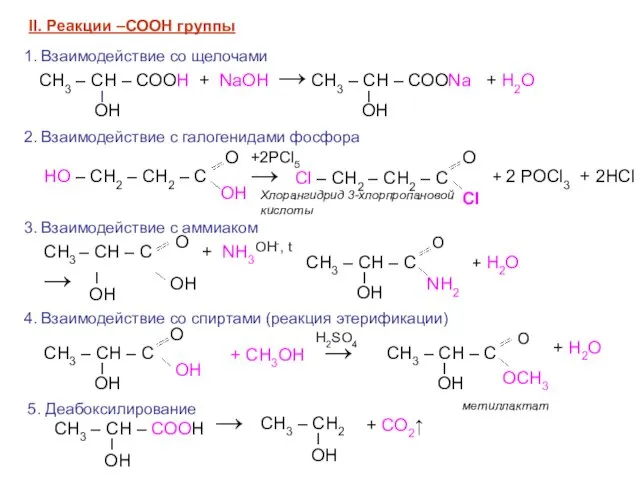
- 10. СН3 – СН – СООН + NaOH → II. Реакции –СООН группы 1. Взаимодействие со щелочами
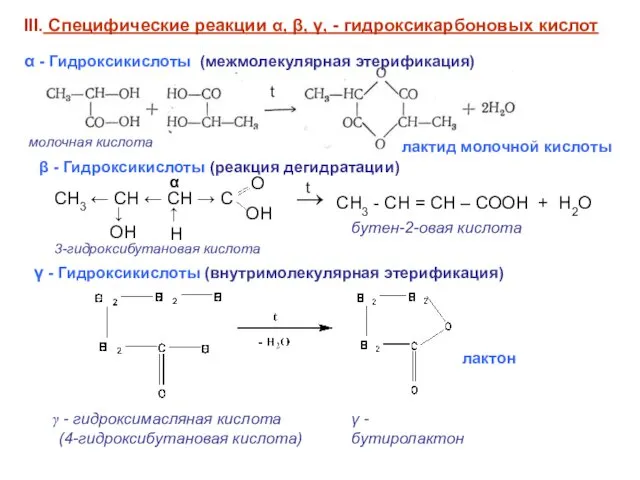
- 11. III. Специфические реакции α, β, γ, - гидроксикарбоновых кислот α - Гидроксикислоты (межмолекулярная этерификация) t лактид
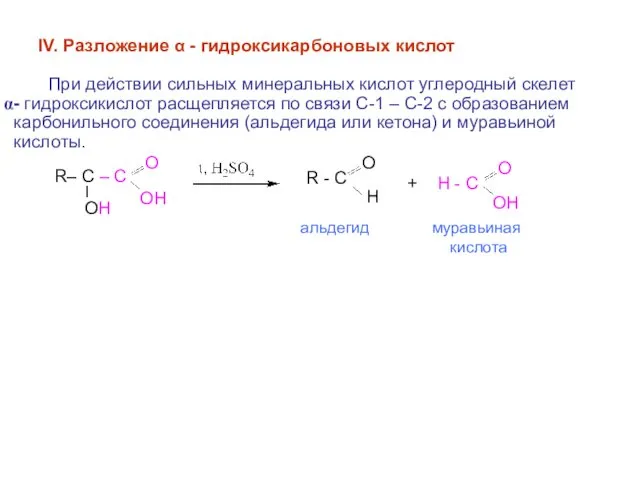
- 12. IV. Разложение α - гидроксикарбоновых кислот При действии сильных минеральных кислот углеродный скелет - гидроксикислот расщепляется
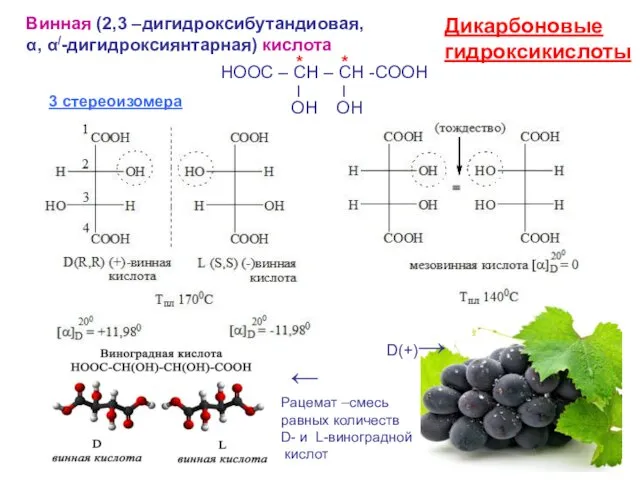
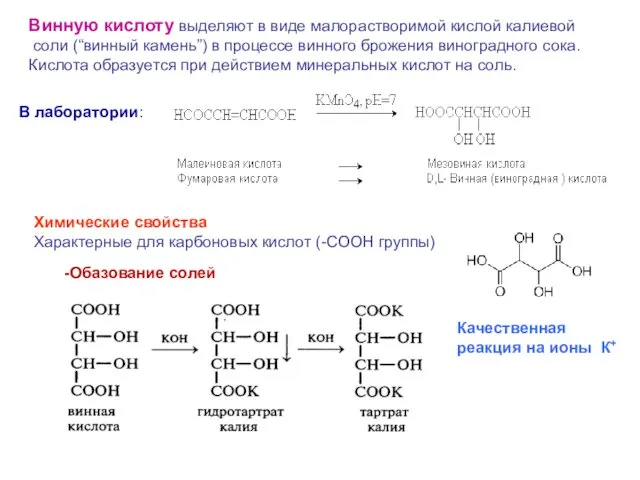
- 13. Винная (2,3 –дигидроксибутандиовая, α, α/-дигидроксиянтарная) кислота НООС – СН – СН -СООН Ι Ι ОН ОН
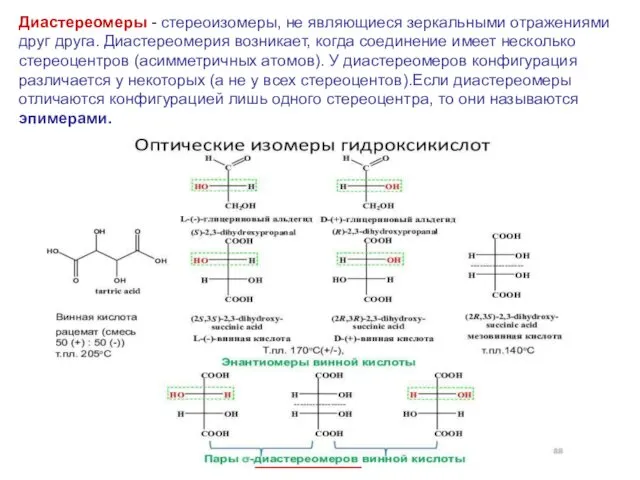
- 14. Диастереомеры - стереоизомеры, не являющиеся зеркальными отражениями друг друга. Диастереомерия возникает, когда соединение имеет несколько cтереоцентров
- 15. Винную кислоту выделяют в виде малорастворимой кислой калиевой соли (“винный камень”) в процессе винного брожения виноградного
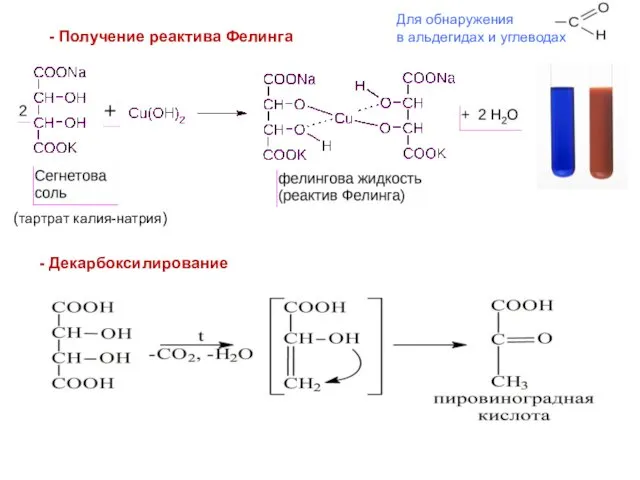
- 16. Для обнаружения в альдегидах и углеводах (тартрат калия-натрия) - Получение реактива Фелинга - Декарбоксилирование
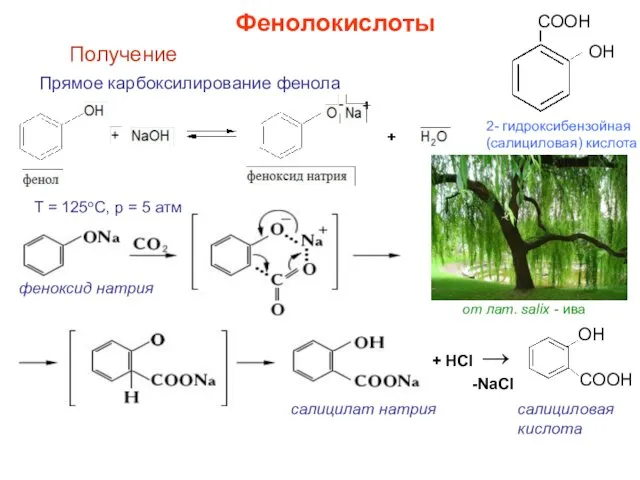
- 17. Прямое карбоксилирование фенола Получение + НСl → -NaСl ОН СООН Т = 125oС, р = 5
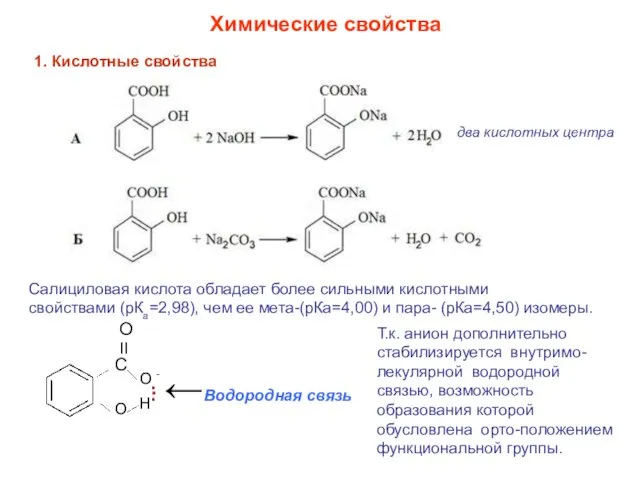
- 18. Химические свойства 1. Кислотные свойства ΙΙ О С О - О Н : ←Водородная связь .
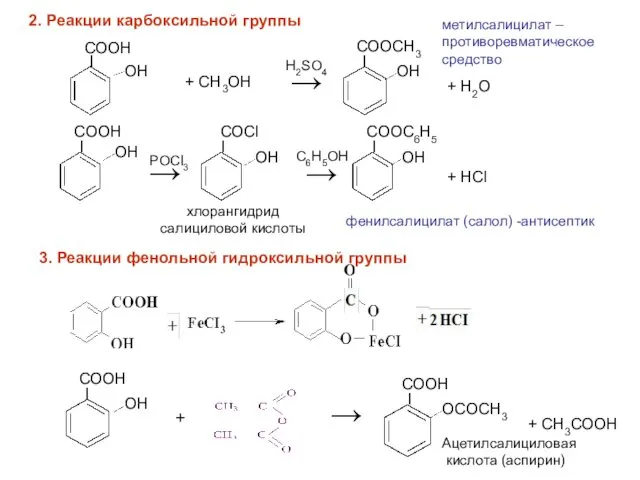
- 19. 2. Реакции карбоксильной группы I СООН ОН + СН3ОН → СООСН3 ОН Ι Ι Ι Ацетилсалициловая
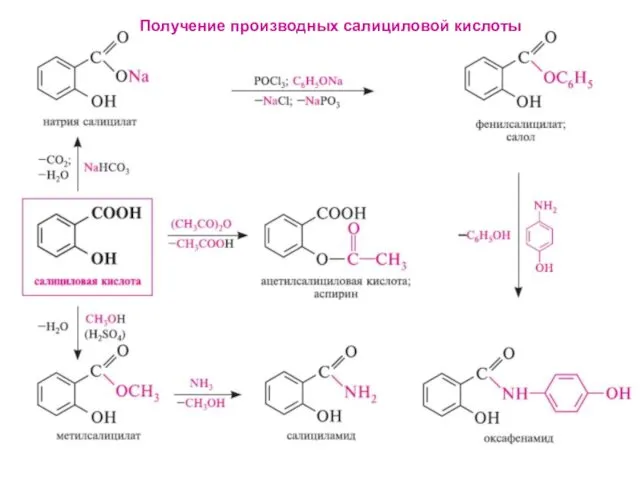
- 20. Получение производных салициловой кислоты
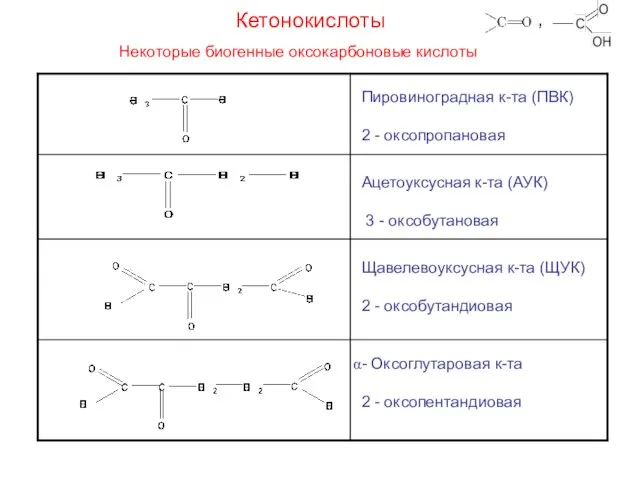
- 21. Кетонокислоты Некоторые биогенные оксокарбоновые кислоты Пировиноградная к-та (ПВК) 2 - оксопропановая Ацетоуксусная к-та (АУК) 3 -
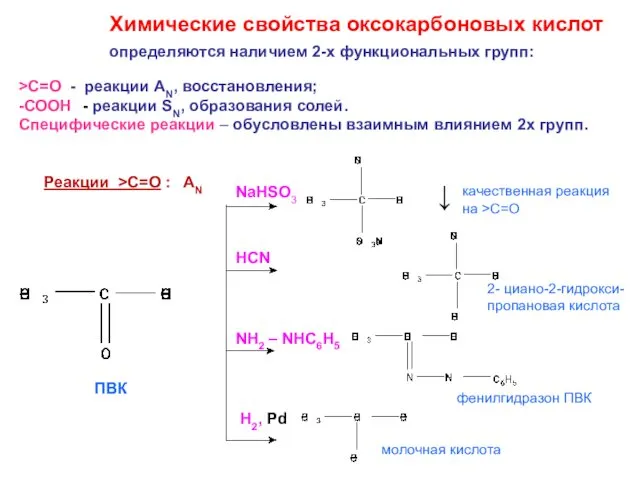
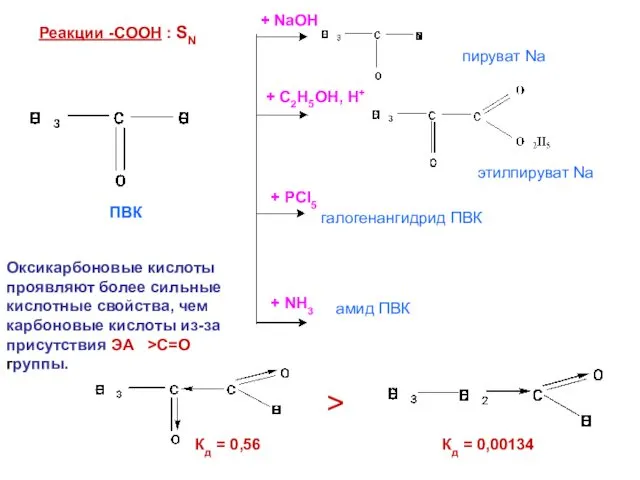
- 22. Химические свойства оксокарбоновых кислот >С=О - реакции АN, восстановления; -СООН - реакции SN, образования солей. Специфические
- 23. Реакции -СООН : SN галогенангидрид ПВК амид ПВК + PCl5 + NaOH + C2H5ОН, Н+ +
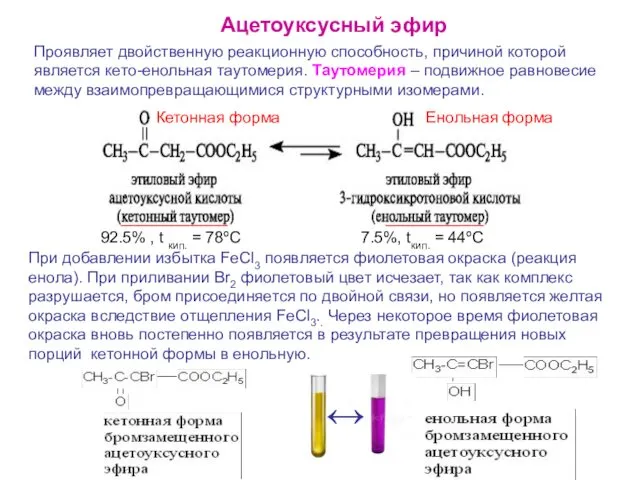
- 24. Ацетоуксусный эфир Проявляет двойственную реакционную способность, причиной которой является кето-енольная таутомерия. Таутомерия – подвижное равновесие между
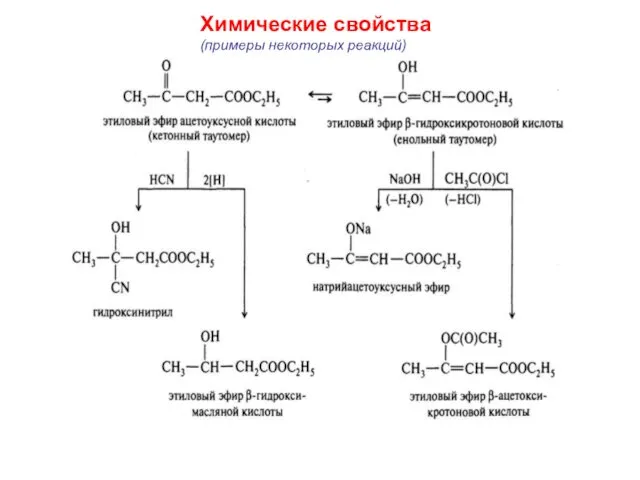
- 25. Химические свойства (примеры некоторых реакций)
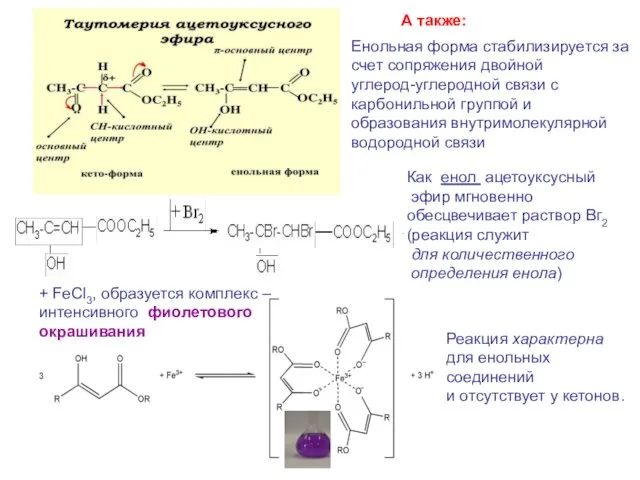
- 26. Енольная форма стабилизируется за счет сопряжения двойной углерод-углеродной связи с карбонильной группой и образования внутримолекулярной водородной
- 28. Скачать презентацию

 Презентация (и дополнительный материал) к игре Своя игра
Презентация (и дополнительный материал) к игре Своя игра Семейства Цветковых растений (6 класс)
Семейства Цветковых растений (6 класс) Лошади в мифах. Текст к лекци
Лошади в мифах. Текст к лекци Картография. Картографичекская генерализация
Картография. Картографичекская генерализация McDonald's. С нами удобно
McDonald's. С нами удобно Международный день детей. Викторина
Международный день детей. Викторина Захист навколишнього середовища від нафти І нафтопродуктів
Захист навколишнього середовища від нафти І нафтопродуктів Презентация к родительскому собранию Ваш ребёнок перестал вас слушаться. Почему?
Презентация к родительскому собранию Ваш ребёнок перестал вас слушаться. Почему? Чуковский
Чуковский Презентация Школа хороших манер.
Презентация Школа хороших манер. Знаменитые люди России
Знаменитые люди России Посвящено дорогим мамам
Посвящено дорогим мамам Кулинария
Кулинария классный час посвящённый здоровому образу жизни 1 класс
классный час посвящённый здоровому образу жизни 1 класс Русская культура в первой половине XVIII века
Русская культура в первой половине XVIII века Роботы в нашей жизни
Роботы в нашей жизни Квалификационный экзамен
Квалификационный экзамен Измерение давления
Измерение давления Мир без нефти. Нефть, газ и альтернативные источники энергии
Мир без нефти. Нефть, газ и альтернативные источники энергии 01 глазами детей
01 глазами детей пасха
пасха Перша та друга Малоросійські колегії
Перша та друга Малоросійські колегії Отношение христианина к природе
Отношение христианина к природе Обобщающий урок игра по предмету Слесарное дело. Урок проводится в форме игрового опроса.
Обобщающий урок игра по предмету Слесарное дело. Урок проводится в форме игрового опроса. Презентации по основам православной культуры
Презентации по основам православной культуры Годівля ремонтного і відгодівельного молодняку великої рогатої худоби
Годівля ремонтного і відгодівельного молодняку великої рогатої худоби Система охлаждения двигателя автомобиля марки ВАЗ 2114
Система охлаждения двигателя автомобиля марки ВАЗ 2114 Общественная мысль, публицистика, литература, пресса
Общественная мысль, публицистика, литература, пресса