Содержание
- 2. ГИДРОЛИЗ от греч. Hydro –вода, Lysis – разложение, распад Гидролиз – это реакция обменного разложения веществ
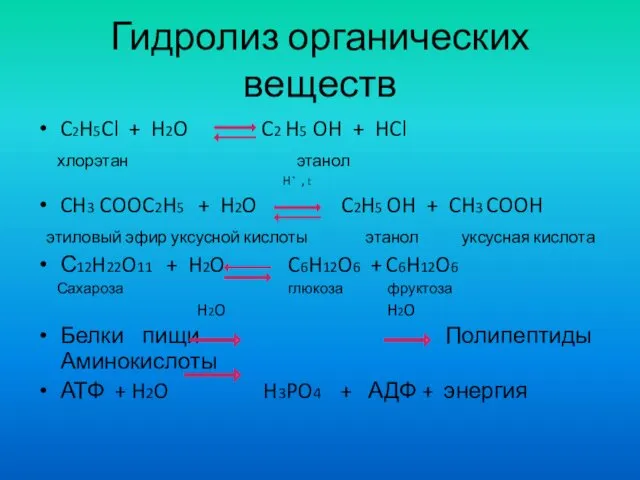
- 3. Гидролиз органических веществ C2H5Cl + H2O C2 H5 OH + HCl хлорэтан этанол H⁺ , t
- 4. Гидролиз бинарных соединений Карбиды металлов: CaC2 + 2H2O Ca(OH)2 +C2H2 Al4C3 + 12H2O 4Al(OH)3 +3CH4 Галогениды
- 5. Гидролиз солей Водные растворы солей имеют разные значения pH и различные типы сред – кислую (pH
- 6. Любую соль можно представить как продукт взаимодействия основания с кислотой. В зависимости от силы основания и
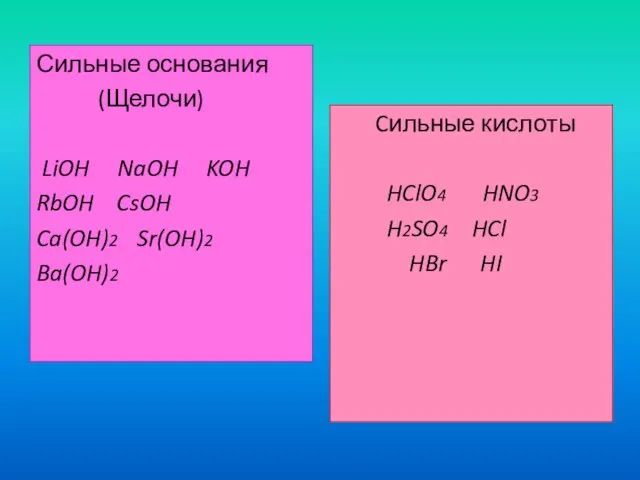
- 7. Сильные основания (Щелочи) LiOH NaOH KOH RbOH CsOH Ca(OH)2 Sr(OH)2 Ba(OH)2 Cильные кислоты HClO4 HNO3 H2SO4
- 8. Гидролиз по аниону (соль образована сильным основанием и слабой кислотой) KNO2 = K⁺ + NO2¯ NO2¯
- 9. Гидролиз по катиону (соль образована слабым основанием и сильной кислотой) Ni(NO3)2 = Ni²⁺ + 2 NO3¯
- 10. Необратимый гидролиз (соли образованы слабым основанием и слабой кислотой) Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
- 11. Изменение направления гидролиза Усиление Добавить воды; Нагреть раствор; Связать один из продуктов гидролиза в труднорастворимое соединение
- 12. Применение гидролиза Основной компонент мыла – это натриевые или калиевые соли высших жирных кислот: стеараты, пальмитаты,
- 13. Контрольный тест 1. Гидролиз солей – это взаимодействие с водой а) катионов или анионов любой (по
- 14. 3. Соль, гидролизуемая по аниону, - это а) Rb2CO3 б) RbCl в) AgCl г) CaCO3 4.
- 16. Скачать презентацию











 Основные классы неорганических веществ
Основные классы неорганических веществ Перпендикулярные прямые
Перпендикулярные прямые Усилитель промежуточной частоты (УПЧ)
Усилитель промежуточной частоты (УПЧ) ООО РеннТек Авто. Малярно-кузовной цех
ООО РеннТек Авто. Малярно-кузовной цех Фонетический разбор
Фонетический разбор Moscow
Moscow Проект Братья Деда Мороза
Проект Братья Деда Мороза Моделирование задач
Моделирование задач ковид
ковид Разработка контроллера Doorbell - сообщений логического уровня Message Passing интерфейса RapidIO
Разработка контроллера Doorbell - сообщений логического уровня Message Passing интерфейса RapidIO Правотворчество: понятие, функции и виды правотворчество
Правотворчество: понятие, функции и виды правотворчество Republic of Belarus, Minsk PUE 3D Techno
Republic of Belarus, Minsk PUE 3D Techno Лекции № 8-9. Поведение потребителя на рынке товаров и услуг
Лекции № 8-9. Поведение потребителя на рынке товаров и услуг Сергей Васильевич Рахманинов 1873 - 1943
Сергей Васильевич Рахманинов 1873 - 1943 Правоприменительная практика при осуществлении государственного контроля в сфере социального обслуживания в Калужской области
Правоприменительная практика при осуществлении государственного контроля в сфере социального обслуживания в Калужской области Нормирование ледовой нагрузки
Нормирование ледовой нагрузки Конструкции одноэтажных промышленных зданий
Конструкции одноэтажных промышленных зданий Участие в конкурсах
Участие в конкурсах Правовые учения представителей социологической юриспруденции
Правовые учения представителей социологической юриспруденции Комнатные цветы Диск
Комнатные цветы Диск Экономика и ее роль в обществе. Экономика: научное представление о хозяйственной деятельности
Экономика и ее роль в обществе. Экономика: научное представление о хозяйственной деятельности Биологические основы паразитизма и трансмиссивных заболеваний
Биологические основы паразитизма и трансмиссивных заболеваний Математика и наше здоровье
Математика и наше здоровье Мир женщины и мужчины. Любовь и влюбленность
Мир женщины и мужчины. Любовь и влюбленность Праздники во всех религиях и их календари
Праздники во всех религиях и их календари По тылам фронтов в Твери и Тверской области
По тылам фронтов в Твери и Тверской области Презентация Женщины войны
Презентация Женщины войны Психогенетика преступного поведения и алкоголизма
Психогенетика преступного поведения и алкоголизма