Содержание
- 2. План Принцип и история метода анализа Классификация методов гравиметрии Основные этапы метода осаждения
- 3. 1. Принцип и история метода анализа Название «гравиметрический» происходит от латинского слова «gravitas» (вес, тяжелый), поэтому
- 4. Торберн Улаф (Олаф) Бергман (швед. Torbern Olof Bergman, 1735–1784) – шведский химик и минералог
- 5. Ключевое значение для развития гравиметрического анализа имело введенное Вильгельмом Фридрихом Оствальдом (1853–1932) понятие произведение растворимости, с
- 6. 2. Классификация методов гравиметрии 2.1. Методы выделения Основаны на выделении определяемого компонента из анализируемого образца в
- 7. 2.2. Методы отгонки В основе метода лежит принцип количественной отгонки определяемого компонента в виде летучего соединения
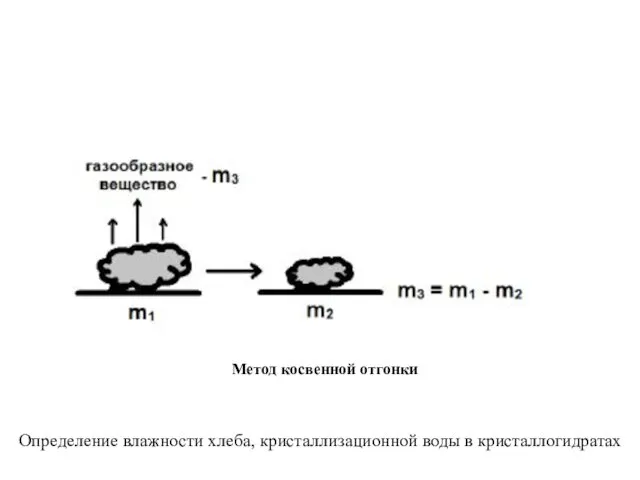
- 8. Метод косвенной отгонки Определение влажности хлеба, кристаллизационной воды в кристаллогидратах
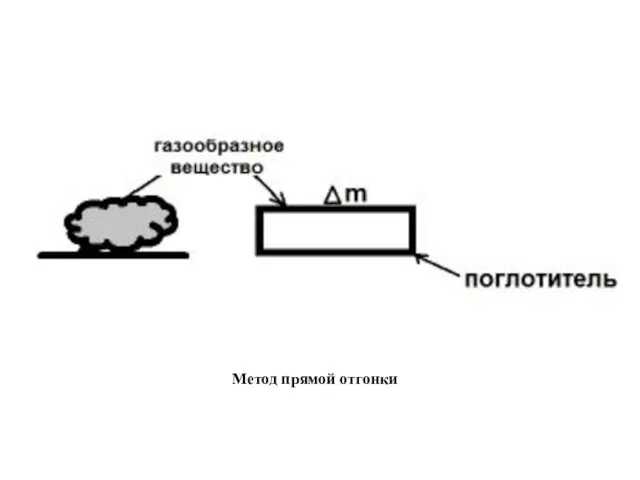
- 9. Метод прямой отгонки
- 10. 2.3. Методы осаждения Основаны на том, что определяемый компонент количественно осаждают химическими способами (т. е. при
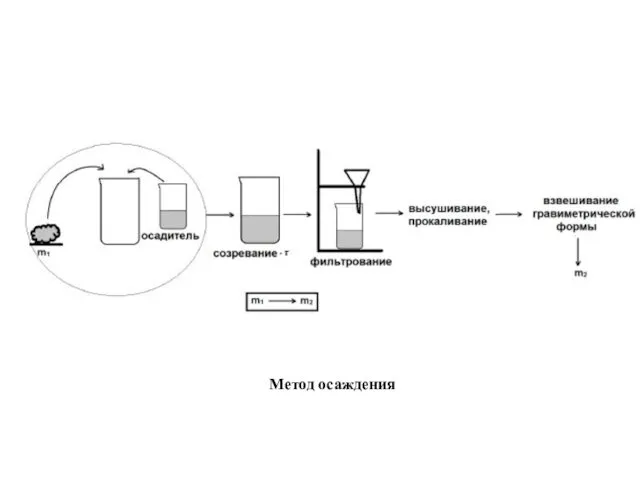
- 11. Метод осаждения
- 12. 3. Основные этапы метода осаждения 1. Выбор осадителя. 2. Расчет массы навески исходной анализируемой пробы. 3.
- 13. 3.1. Выбор осадителя
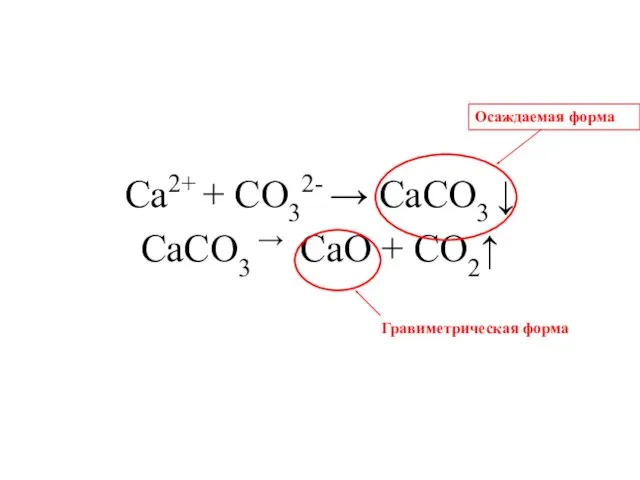
- 14. Ca2+ + CO32- → СaCO3 ↓ СaCO3 → CaO + CO2↑ Осаждаемая форма Гравиметрическая форма
- 15. Критерии выбора осадителя! Наименьшая растворимость осаждаемой формы (осадка при осаждении аналита)
- 16. Произведение растворимости (ПР) – ключевое понятие методов осаждения Правило ПР: произведение концентраций ионов труднорастворимого электролита в
- 17. Условия выпадения осадка ИП ˃ ПР Выпадет ли осадок, если слить равные объемы 0,01 М раствора
- 18. Растворимость осадка Например, находим растворимость AgCl в воде: 1. Записываем уравнение диссоциации хлорида серебра и выражение
- 19. Критерии выбора осадителя! Осаждаемая форма должна быть такой, чтобы легко и полностью переходить в весовую (гравиметрическую
- 20. Критерии выбора осадителя! Осадитель должен быть летуч, чтобы примеси его можно было удалить при прокаливании. Осадитель
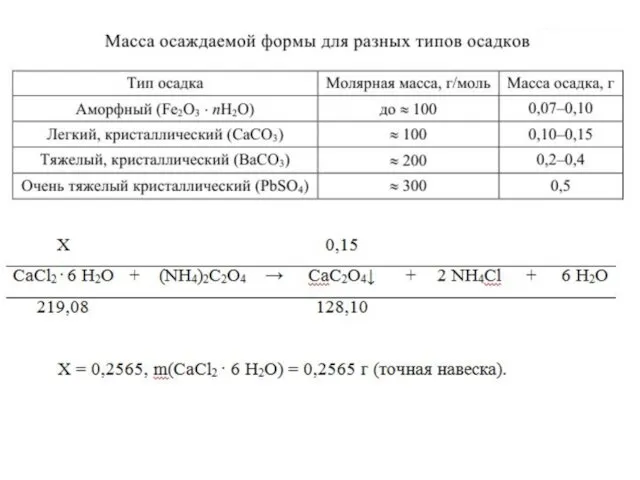
- 21. ПРИМЕР Определите массовую долю Ca (%) в СaCl2 · 6 H2O методом гравиметрии Выбор осадителя. Используя
- 22. 3.2. Расчет массы навески (продолжение примера) (СaCl2 · 6 H2O). Осаждение ионов кальция из раствора лучше
- 24. 3.3. Взвешивание (взятие) навески анализируемого образца (пробы) на аналитических весах
- 25. Количественное перенесение навески в емкость для осаждения
- 26. 3.4. Растворение навески анализируемого образца
- 27. 3.5. Расчет объема раствора (или массы) осадителя
- 28. Мы должны взять такой объем 2 н. раствора оксалата аммония, чтобы в нем содержалось 0,1456 грамма
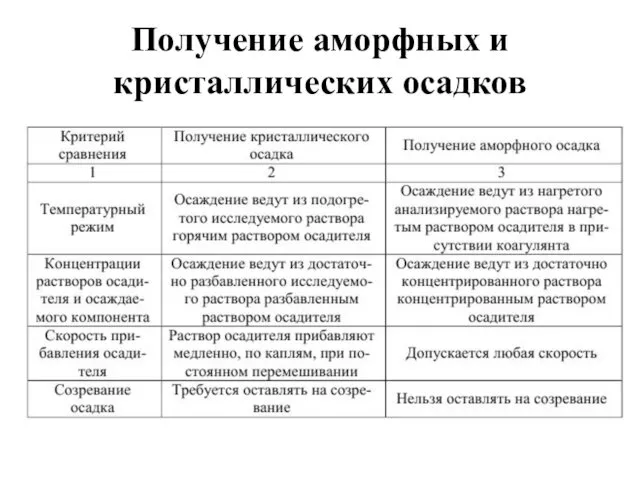
- 29. Получение аморфных и кристаллических осадков
- 30. 3.6. Осаждение, т. е. получение осаждаемой формы определяемого компонента в виде осадка
- 31. 3.7. Фильтрование – черная лента – крупнопористая струтктура, быстрофильтрующие фильтры (диаметр пор ~ 13-15 мкм); –
- 32. Подбор фильтра и фильтрование
- 33. 3.8. Промывание осадка
- 34. 3.9. Высушивание, озоление (превращение фильтра в золу) и при необходимости прокаливание осадка до постоянной массы, т.е.
- 35. Высушивание осадка на фильтре в термостате Складывание фильтра
- 36. Прокаливание тигля в муфельной печи
- 37. 3.10. Расчет результатов анализа, их статистическая обработка и представление
- 38. Предположим, что после прокаливания получилось 0,0657 г оксида кальция. Таким образом реализована схема: СaC2O4 (осаждаемая форма)
- 40. Скачать презентацию































 Сергий Радонежский
Сергий Радонежский Образовательные курсы для начинающих предпринимателей
Образовательные курсы для начинающих предпринимателей Автокөліктерді диагностикалау
Автокөліктерді диагностикалау 80 лет. Юбилей Краснодарского края
80 лет. Юбилей Краснодарского края Презентация. Познавательное развитие по ФГОС в ДОУ. Развитие познавательной деятельности
Презентация. Познавательное развитие по ФГОС в ДОУ. Развитие познавательной деятельности Презентация к урокам кубановедения Традиционная одежда кубанских казаков, 8 класс
Презентация к урокам кубановедения Традиционная одежда кубанских казаков, 8 класс урок-кормораздатчики
урок-кормораздатчики Отчеты и выборы в первичной профсоюзной организации студентов общероссийского профсоюза образования
Отчеты и выборы в первичной профсоюзной организации студентов общероссийского профсоюза образования Презентация Тарантелла
Презентация Тарантелла Java School #18 Opening
Java School #18 Opening Трахеостомия. Показания к проведению трахеостомии
Трахеостомия. Показания к проведению трахеостомии презентация Кубань - красавица на века делами славится.
презентация Кубань - красавица на века делами славится. Видеокарта
Видеокарта Закон Архімеда
Закон Архімеда Вулканические извержения
Вулканические извержения Классный час -урок 1 сентября Москва вчера, сегодня, завтра.
Классный час -урок 1 сентября Москва вчера, сегодня, завтра. Презентация образовательной предпрофессиональной программы по предмету Концертмейстерский класс. Диск
Презентация образовательной предпрофессиональной программы по предмету Концертмейстерский класс. Диск Christmas
Christmas Презентация На помощь Василисе Прекрасной
Презентация На помощь Василисе Прекрасной Шаблоны презентаций 1 сентября
Шаблоны презентаций 1 сентября Разработка конструкции реактора получения карбоксилированных углеродных нанотрубок с рабочим объемом 0,1 м3
Разработка конструкции реактора получения карбоксилированных углеродных нанотрубок с рабочим объемом 0,1 м3 Оборудование ВОРС Стрелец
Оборудование ВОРС Стрелец Коэффициент нефтеотдачи
Коэффициент нефтеотдачи Законы Менделя
Законы Менделя СП при гипертонической болезни
СП при гипертонической болезни Обоснование источников снижения издержек производства и реализации продукции на примере СПК Бересни
Обоснование источников снижения издержек производства и реализации продукции на примере СПК Бересни Презентация К разговору о культуре
Презентация К разговору о культуре презентация к мероприятию 9 мая
презентация к мероприятию 9 мая