Содержание
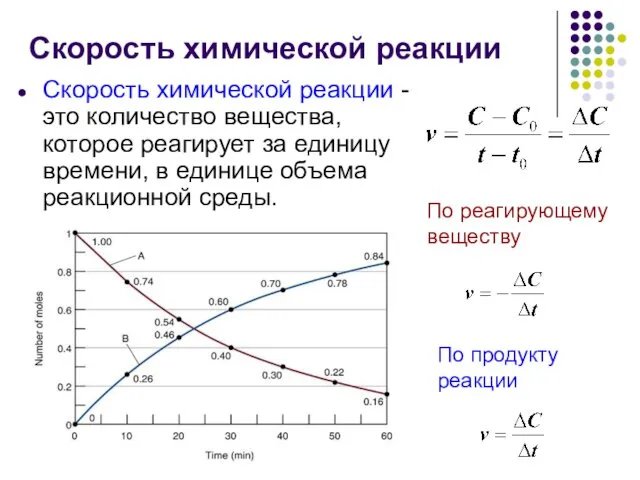
- 2. Скорость химической реакции Скорость химической реакции - это количество вещества, которое реагирует за единицу времени, в
- 3. Механизм химической реакции Механизм химической реакции – это последовательность и количество элементарных актов взаимодействия реагентов (стадий),
- 4. Факторы, влияющие на скорость химической реакции Природа реагирующих веществ. Размер частиц реагирующих веществ. Концентрация реагирующих веществ.
- 5. Зависимость скорости реакции от концентрации aA+bB+cC…→продукты v=kCAх·CBy·CCz…. Константа скорости реакции, k (удельная скорость) равна скорости реакции
- 6. Порядок реакции Показатели степеней x, y, z…называют частными порядками реакции по веществам А, В, С… Их
- 7. Молекулярность реакции Молекулярность реакции – число молекул, участвующих в элементарном акте химического превращения. Мономолекулярные реакции: A→B
- 8. Зависимость скорости реакций от температуры Эмпирическое Правило Вант-Гоффа: при повышении температуры на каждые 10 0С константа
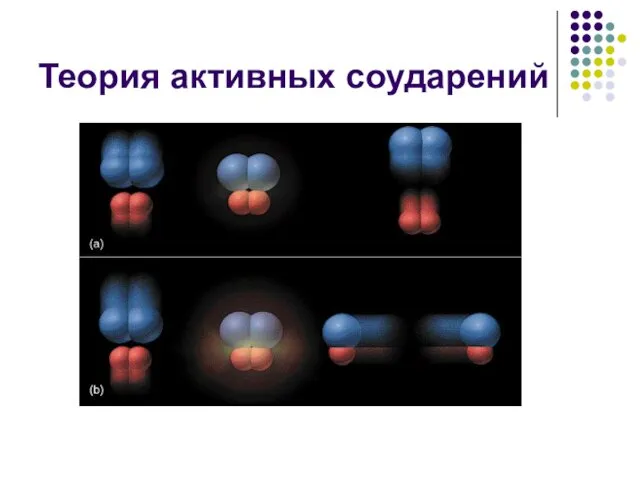
- 9. Теория активных соударений Влияние температуры на скорость химических реакций объясняется теорией активных столкновений (соударений) Аррениуса. Химическая
- 10. Теория активных соударений
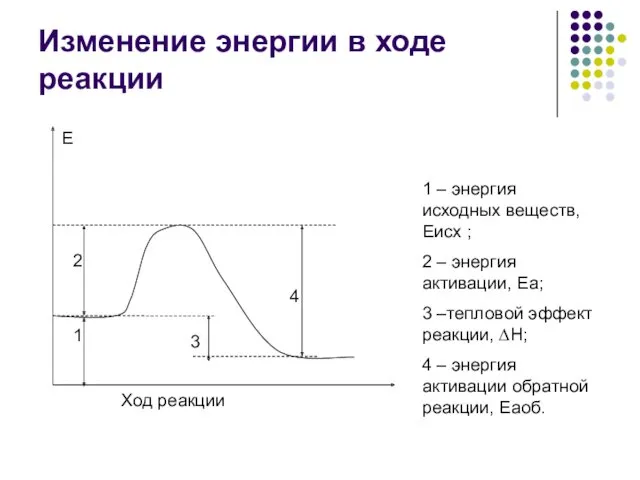
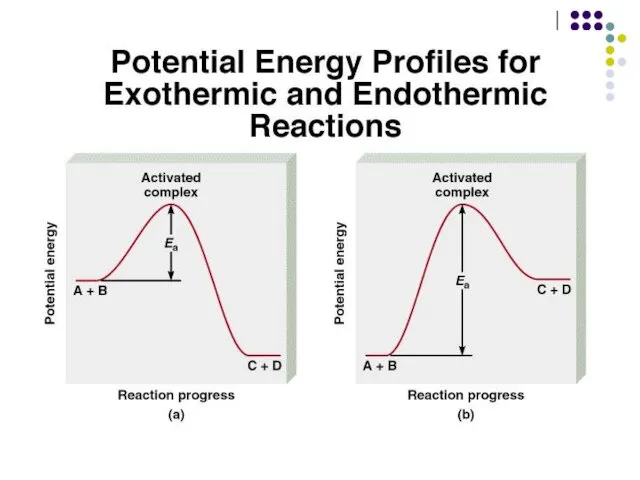
- 11. Изменение энергии в ходе реакции 1 – энергия исходных веществ, Еисх ; 2 – энергия активации,
- 13. Уравнение Аррениуса Уравнение Аррениуса (1889) дает точную зависимость константы скорости реакции (скорости) от температуры и энергии
- 14. Сложные реакции Сложные реакции состоят из двух и более простых реакций (стадий). Обратимые реакции Последовательные реакции
- 15. Кинетика гетерогенных реакций Гомогенные реакции протекают в одной фазе: HCl+NaOH→NaCl+H2O Гетерогенные процессы протекают с участием нескольких
- 16. Катализ Катализом называют явление изменения скорости реакции в присутствии веществ – катализаторов. Катализатор - это вещество,
- 17. Гомогенный катализ Механизм гомогенного катализа объясняется теорией промежуточных соединений. Согласно этой теории катализатор образует с одним
- 18. Ферментативный катализ Ферментативный катализ является одним из видов гомогенного катализа Ферментами называют белки, входящие в состав
- 19. Гетерогенный катализ Процесс гетерогенного катализа состоит из пяти стадий: диффузия исходных веществ к поверхности катализатора; адсорбция
- 20. Большинство химических реакций обратимо, что означает возможность протекания обратной реакции. Химическое равновесие – это состояние, когда
- 21. Константа химического равновесия Закон действующих масс (К. Гульдберг и П. Вааге 1867 г): для обратимого процесса
- 22. Гомогенные и гетерогенные равновесия Гомогенные реакции в газовой фазе: N2+3H2⮀2NH3 Гомогенные реакции в растворах: СH3COOH +C2H5OH
- 23. Смещение химического равновесия Влияние различных факторов на состояние химического равновесия определяется принципом Ле Шателье: Если на
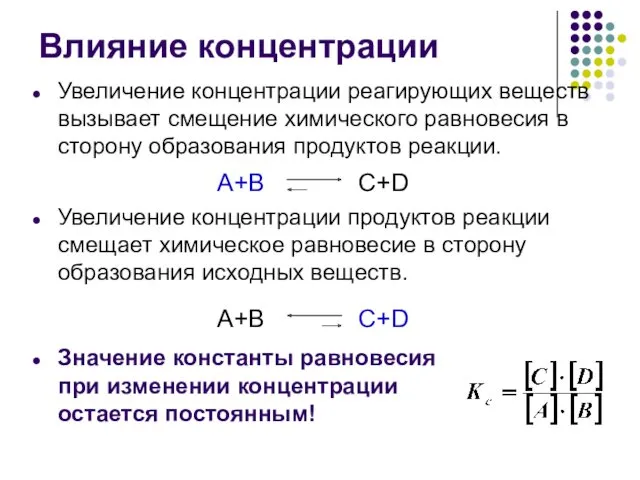
- 24. Влияние концентрации Увеличение концентрации реагирующих веществ вызывает смещение химического равновесия в сторону образования продуктов реакции. Увеличение
- 25. Влияние температуры Повышение температуры вызывает смещение равновесия в сторону эндотермической реакции (∆H>0). Понижение температуры смещает равновесие
- 27. Скачать презентацию



















 Электрический контакт
Электрический контакт бибурок 9 класс
бибурок 9 класс Обложка презентации
Обложка презентации Буровые технологические жидкости. Проектирование и оптимизация качества буровых промывочных и тампонажных растворов. (Лекция 16)
Буровые технологические жидкости. Проектирование и оптимизация качества буровых промывочных и тампонажных растворов. (Лекция 16) Надмолекулярные структуры полимеров (НС)
Надмолекулярные структуры полимеров (НС) Натуральные волокна животного происхождения
Натуральные волокна животного происхождения Проектная деятельность в условиях дошкольного учреждения
Проектная деятельность в условиях дошкольного учреждения Беседа Олимпиада Сочи 2014
Беседа Олимпиада Сочи 2014 Япония - страна восходящего Солнца. Презентация.
Япония - страна восходящего Солнца. Презентация. 8 марта
8 марта Сооружения обработки осадков сточных вод. Механическое обезвоживание осадков
Сооружения обработки осадков сточных вод. Механическое обезвоживание осадков Владимир Маяковский
Владимир Маяковский С праздником женского очарованья!
С праздником женского очарованья! РҚ және оның арналымы. РҚ және А дамуы. Реле. Электроавтоматика
РҚ және оның арналымы. РҚ және А дамуы. Реле. Электроавтоматика История развития волейбола
История развития волейбола семейный клуб Первоклассный родитель
семейный клуб Первоклассный родитель Дизайны клинических испытаний
Дизайны клинических испытаний Черные дыры
Черные дыры Обучающий проект по использованию сетевых сообществ школьниками
Обучающий проект по использованию сетевых сообществ школьниками Подушки EcoGel. Коллекция анатомических подушек
Подушки EcoGel. Коллекция анатомических подушек Возрастная анатомия черепа. Вариантная анатомия черепа
Возрастная анатомия черепа. Вариантная анатомия черепа Моя профессия- учитель-логопед, что означает множество трудов и радостных побед!
Моя профессия- учитель-логопед, что означает множество трудов и радостных побед! Учебная деятельность в младшем школьном возрасте
Учебная деятельность в младшем школьном возрасте Перспективная начальная школа
Перспективная начальная школа Строительство спортивной, пришкольной площадки. Карточка объекта
Строительство спортивной, пришкольной площадки. Карточка объекта Экологический мониторинг. (Глава 12)
Экологический мониторинг. (Глава 12) Проект Символы Тбилисского района
Проект Символы Тбилисского района Корейская Война
Корейская Война