Содержание
- 2. План лекции Химическая кинетика Скорость химических реакций Влияние концентрации на скорость химических реакций Влияние температуры на
- 3. Условия протекания химических реакций Соприкосновение реагирующих веществ. Нагревание. Использование катализатора.
- 4. Сущность химических реакций Сущность химических реакций сводится к разрыву связей в исходных веществах и возникновению новых
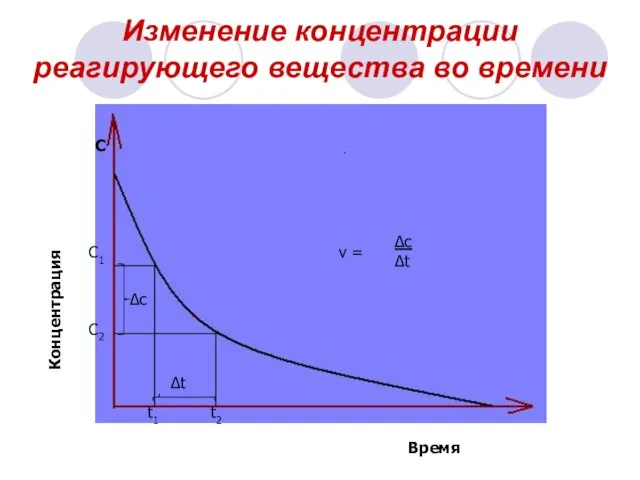
- 5. Изменение концентрации реагирующего вещества во времени С Концентрация Время С1 С2 t1 t2 ∆c ∆t v
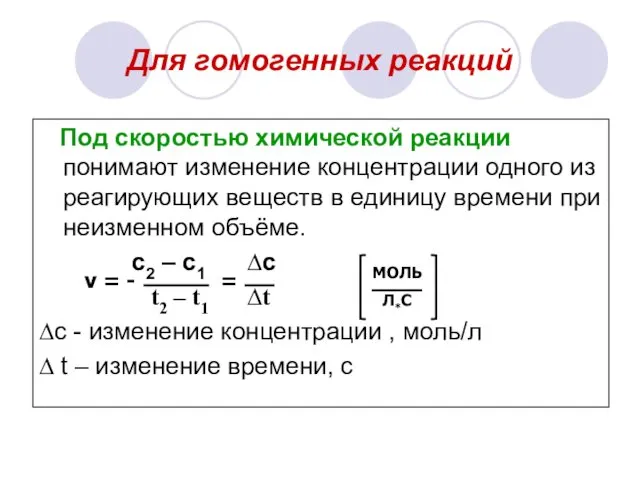
- 6. Для гомогенных реакций Под скоростью химической реакции понимают изменение концентрации одного из реагирующих веществ в единицу
- 7. Факторы, влияющие на скорость реакции Концентрация реагирующих веществ. Температура. Природа реагирующих веществ. Площадь соприкосновения реагирующих веществ.
- 8. Концентрация реагирующих веществ Закон действующих масс (ЗДМ) : скорость химической реакции пропорциональна произведению концентраций реагирующих веществ.
- 9. Cкорость и концентрация Чем больше концентрация реагирующих веществ, тем чаще сталкиваются частицы веществ, а значит скорость
- 10. Температура Правило Вант-Гоффа: при изменении температуры на каждые 100С скорость большинства реакций изменяется в 2 –
- 11. Физический смысл температурного коэффициента Если температурный коэффициент равен 3, это значит, что скорость реакции возрастает в
- 12. Скорость и температура При повышении температуры, увеличивается скорость движения частиц, поэтому они чаще сталкиваются, а значит
- 13. Взаимодействие магния с водой Запишите уравнение реакции взаимодействия магния с водой. Mg+H2O=MgO+H2↑
- 14. Природа реагирующих веществ Металлы I и II групп главных подгрупп взаимодействуют с водой с образованием щёлочи
- 15. Взаимодействие калия с водой
- 16. Взаимодействие кальция с водой
- 17. Природа реагирующих веществ Чем активнее вещество, тем скорость реакции с его участием больше.
- 18. Площадь соприкосновения реагирующих веществ Скорость гетерогенных реакций зависит от площади соприкосновения веществ. Гетерогенные реакции идут только
- 19. Скорость гетерогенных реакций Чем больше поверхность соприкосновения веществ, тем выше скорость реакции.
- 20. Катализатор Катализаторами называются вещества, изменяющие скорость химических реакций. Сам катализатор в реакциях не расходуется и в
- 21. Скорость и катализатор Катализатор увеличивает скорость химической реакции. С12Н22О11=12СО2+11Н2О t
- 22. Механизм каталитических реакций Для реакции: А + В = АВ Механизм: Катализатор взаимодействует с исходным веществом:
- 24. Скачать презентацию



















 экспериментальная деятельность
экспериментальная деятельность Составление технологической карты урока
Составление технологической карты урока Символы древних славян
Символы древних славян ПРЕЗЕНТАЦИЯ Использование информационно-коммуникационных технологий в работе музыкального руководителя
ПРЕЗЕНТАЦИЯ Использование информационно-коммуникационных технологий в работе музыкального руководителя Дошколятам о профессиях
Дошколятам о профессиях дизайн-концепт для сети кинотеатров города
дизайн-концепт для сети кинотеатров города Презентация Такие же как мы
Презентация Такие же как мы Не хочу делать уроки!
Не хочу делать уроки! Спортивная гимнастика
Спортивная гимнастика Творческий проект Поликлиника: какой она должна быть
Творческий проект Поликлиника: какой она должна быть Питание и пищеварение
Питание и пищеварение Новая экономическая политика
Новая экономическая политика Студенттердің тамақтану ерекшелігі мен ұйымдастырылуын бағалау. Ғылыми жоба
Студенттердің тамақтану ерекшелігі мен ұйымдастырылуын бағалау. Ғылыми жоба Методы исследования и диагностики при заболеваниях височно-нижнечелюстного сустава
Методы исследования и диагностики при заболеваниях височно-нижнечелюстного сустава классный час для 2 класса, посв. 20-летию Конституции.
классный час для 2 класса, посв. 20-летию Конституции. Аэропорт Бен-Гурион
Аэропорт Бен-Гурион Алкоголизм. Стадии алкоголизма
Алкоголизм. Стадии алкоголизма Былина - жанр устного народного творчества. Ильины три поездочки
Былина - жанр устного народного творчества. Ильины три поездочки Город-герой Волгоград (Сталинград)
Город-герой Волгоград (Сталинград) Угол. Измерение углов
Угол. Измерение углов С днём рождения
С днём рождения Психологические особенности ребенка дошкольного возраста
Психологические особенности ребенка дошкольного возраста Взаимодействие логопеда со специалистами ДОУ
Взаимодействие логопеда со специалистами ДОУ Анна Ахматова (1889-1966)
Анна Ахматова (1889-1966) Электроснабжение очистных (подготовительных) работ участка шахты ОАО Распадская
Электроснабжение очистных (подготовительных) работ участка шахты ОАО Распадская Методы очистки сточных вод
Методы очистки сточных вод Этапы развития речи ребенка
Этапы развития речи ребенка Автомобильные дороги, аэродромы и объекты транспортной инфраструктуры
Автомобильные дороги, аэродромы и объекты транспортной инфраструктуры