Содержание
- 2. Кислоты - это сложные вещества, молекулы которых состоят из атомов водорода и кислотного остатка.
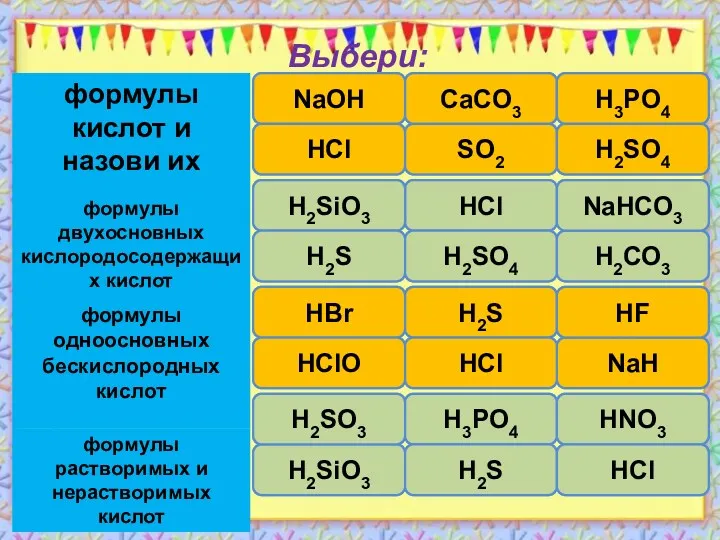
- 3. Выбери: правильно ошибка ошибка ошибка правильно правильно NaОH HCl CaCO3 SO2 H3PO4 H2SO4 правильно ошибка ошибка
- 4. Цели: Познакомиться с химическими свойствами кислот в свете ТЭД Развивать умения и навыки записи молекулярных, полных
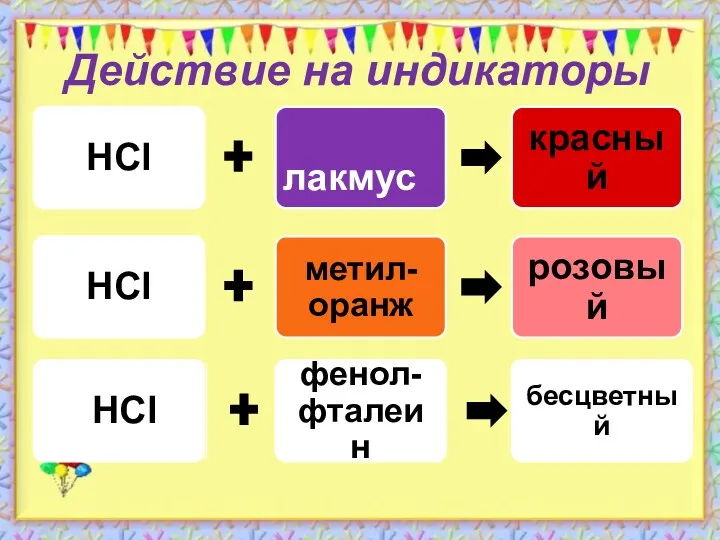
- 6. Действие на индикаторы
- 7. Взаимодействие с металлами Li K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd
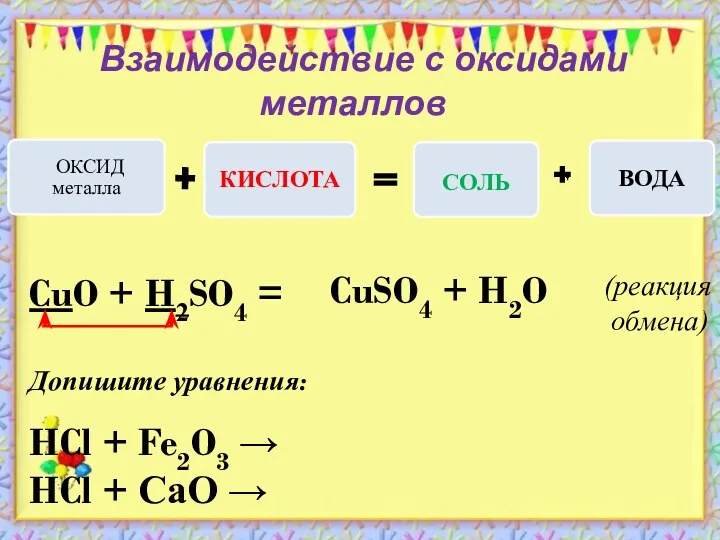
- 8. Взаимодействие с оксидами металлов Допишите уравнения: HCl + Fe2O3 → HCl + СаО → CuO +
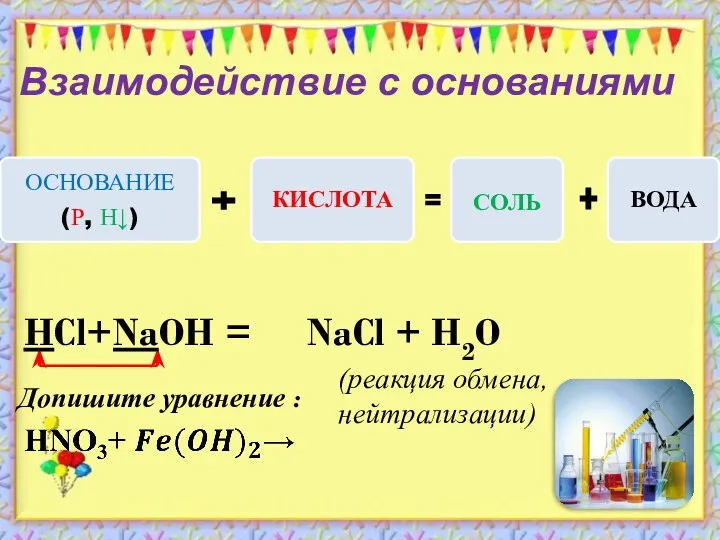
- 9. Взаимодействие с основаниями (реакция обмена, нейтрализации) Допишите уравнение : HCl+NaOH = NaCl + H2O
- 10. Взаимодействие с солями Условия: в результате реакции должны получиться газ ↑, осадок ↓ или вода. HСl
- 11. С какими из перечисленных соединений будет взаимодействовать раствор серной кислоты? Составьте уравнения возможных химических реакций, укажите
- 13. Скачать презентацию






 Инфузии и основы гемотрансфузиологии. Возможные осложнения. Кровезаменители. Тема 7
Инфузии и основы гемотрансфузиологии. Возможные осложнения. Кровезаменители. Тема 7 Вечная слава
Вечная слава Инновационные технологии и технические средства для высокоскоростного железнодорожного движения в Российской Федерации
Инновационные технологии и технические средства для высокоскоростного железнодорожного движения в Российской Федерации Расчетные методы определения необходимой площади и толщины предохранительной мембраны
Расчетные методы определения необходимой площади и толщины предохранительной мембраны Искусство витража. 5 класс
Искусство витража. 5 класс Победители и призеры конкурсов различного уровня
Победители и призеры конкурсов различного уровня 20231102_izmeneniya_ege_2022
20231102_izmeneniya_ege_2022 Прикольные коты
Прикольные коты Презентация Сорок сороков Диск
Презентация Сорок сороков Диск Сикстинская капелла
Сикстинская капелла Предмети, мақсади ва вазифалари
Предмети, мақсади ва вазифалари Коммерческое предложение для ПАО Газпром. Гусеничный бульдозер ДСТ-Урал ТМ10.11 ГСТ10
Коммерческое предложение для ПАО Газпром. Гусеничный бульдозер ДСТ-Урал ТМ10.11 ГСТ10 Закон о занятости населения в Российской Федерации
Закон о занятости населения в Российской Федерации Факторы и условия, повышающие эффективность тренировочной и соревновательной деятельности
Факторы и условия, повышающие эффективность тренировочной и соревновательной деятельности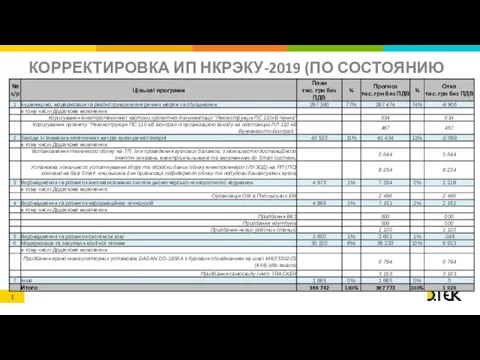 Формат статуса ИП для ООЭ КОЭ
Формат статуса ИП для ООЭ КОЭ Игра Совет мудрейших (часть 1)
Игра Совет мудрейших (часть 1)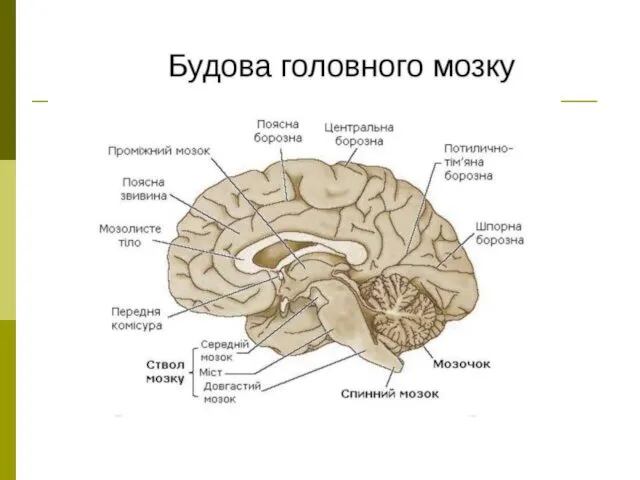 Довгастий мозок та вароліїв міст
Довгастий мозок та вароліїв міст Ласкаво просимо до Черкас
Ласкаво просимо до Черкас Miami hotels
Miami hotels МОЁ ПОРТФОЛИО
МОЁ ПОРТФОЛИО Родительское собрание на тему: Как помочь ребенку стать внимательным.
Родительское собрание на тему: Как помочь ребенку стать внимательным. Урок по этнографии коренных народов Западной Сибири
Урок по этнографии коренных народов Западной Сибири Фотоальбом-презентация Учимся играя
Фотоальбом-презентация Учимся играя Как помочь детям стать внимательнее
Как помочь детям стать внимательнее Средства профилактики болезней нервной системы
Средства профилактики болезней нервной системы Подборка презентаций
Подборка презентаций Кролики – хобби или бизнес?
Кролики – хобби или бизнес? Переработка мусора
Переработка мусора