Содержание
- 2. Смысл изучения истории химии раскрывают слова Д. И. Менделеева: "Знание готовых выводов, без сведений о способах
- 3. Менделеев в 1882 г. определяет химию как "учение об элементах и их соединениях". Современное определение химии
- 4. Целью химии на всех этапах ее развития является получение веществ с заданными свойствами. История химии –
- 5. При хронологическом подходе, историю химии подразделяют на несколько периодов. 1. Предалхимический период: до III в.н.э. 2.
- 6. 1. Предалхимический период: до III в.н.э. Теория и практика знаний о веществе развиваются независимо друг от
- 7. Греческая натурфилософия VII-V вв. до н.э. Фалес Милетский (VII-VIвв.до н.э.) возводил все многообразие явлений и вещей
- 8. Греческая натурфилософия VII-V вв. до н.э. Гераклит Эфесский (VI-Vвв. до н.э) пытался объяснить явления природы, постулируя
- 9. Наибольшее влияние на дальнейшее развитие науки оказало учение Аристотеля. Согласно этой концепци все вещества образованы сочетанием
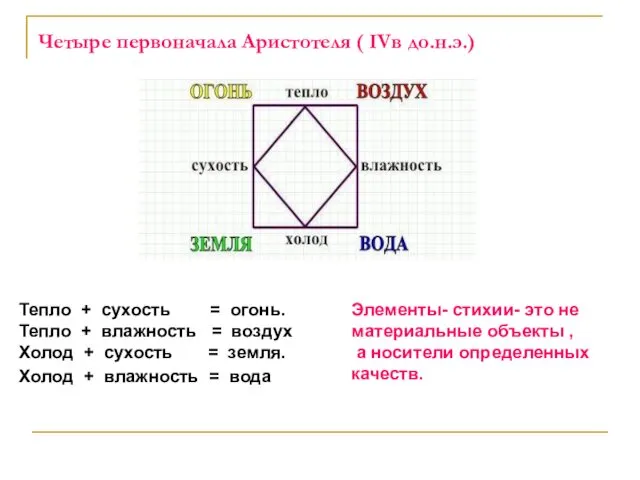
- 10. Четыре первоначала Аристотеля ( IVв до.н.э.) Тепло + сухость = огонь. Тепло + влажность = воздух
- 11. Введение понятия атома. Представление о том, что вещество состоит из отдельных очень малых неделимых частиц -
- 12. 2. Алхимический период: IIIIII —XVII вв. н.э. Весь алхимический период — это время поисков философского камня,
- 13. Арабская алхимия. Теоретической основой арабской алхимии по-прежнему являлось учение Аристотеля. Однако развитие алхимической практики потребовало создания
- 14. Европейская алхимия Среди крупнейших алхимиков европейского этапа можно отметить Альберта Великого (1200-1280гг., Роджера Бэкона (1214 -
- 15. Техническая химия и ятрохимия. Начиная с эпохи Возрождения, в всё большее значение в алхимии стало приобретать
- 16. Парацельс утверждал, что задача алхимии — изготовление лекарств; при этом медицина Парацельса основывалась на ртутно-серной теории.
- 17. 3. Период становления ( объединения): XVII XVII—XVIII вв. Основоположником научной революции и новой химии, считается Роберт
- 18. К выдающимся достижениям научной мысли М. В. Ломоносова относится его молекулярно-кинетическая теория тепла. В своей работе
- 19. Теория флогистона. В первой половине XVIII века немецкий химик Г. Э. Шталь предложил для объяснения процесса
- 20. Химическая революция Процесс превращения химии в современную науку завершился открытиями французского ученого Антуана Лорана Лавуазье. (1743-1794гг.Париж).
- 21. А. Лавуазье (таблица простых тел),
- 22. 4. Период количественных законов: конец XVIII — середина XIX в. Закон кратных отношений (англичанин Джон Дальтон,
- 23. Таблица относительных атомных весов Дж. Дальтона (1803 год)
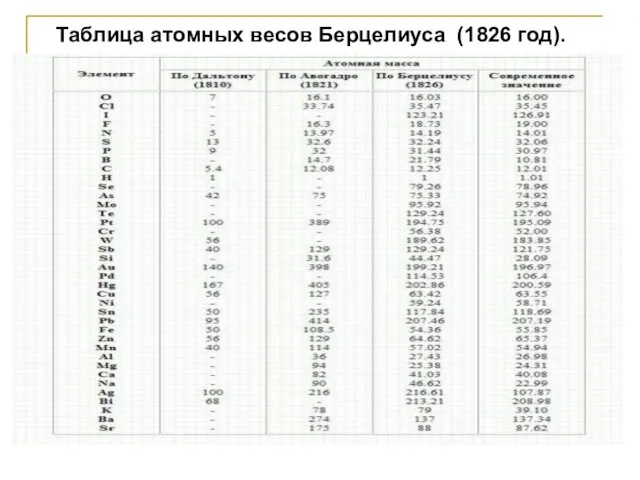
- 24. Таблица атомных весов Берцелиуса (1826 год).
- 25. Химия во второй половине XIX в Для данного периода характерно стремительное развитие науки: были созданы периодическая
- 26. Закон триад И.В. Деберейнера 1829 год Дёберейнеру удалось установить первые закономерности в изменении свойств элементов. Он
- 27. Химия во второй половине XIX в 5. Период классической химии: 1860 г. – конец XIX в.
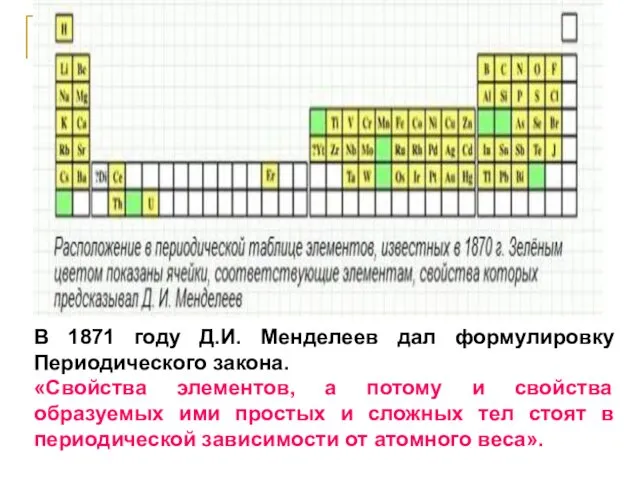
- 28. В 1871 году Д.И. Менделеев дал формулировку Периодического закона. «Свойства элементов, а потому и свойства образуемых
- 29. А.М. Бутлеров (теория химического строения органических соединений) 1861 год Возникновение органической химии как самостоятельной науки можно
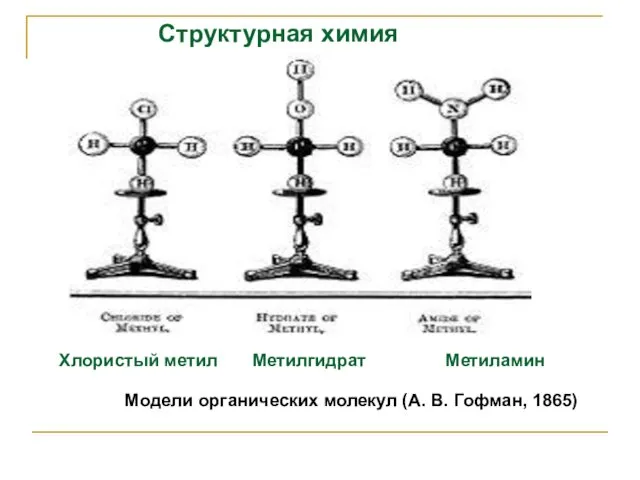
- 30. Структурная химия Хлористый метил Метилгидрат Метиламин Модели органических молекул (А. В. Гофман, 1865)
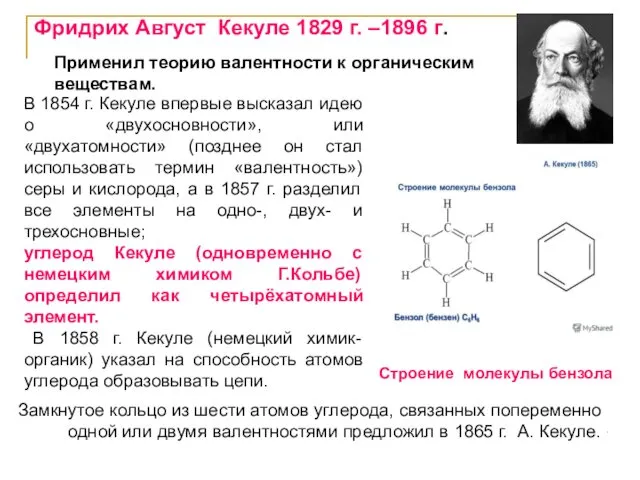
- 31. Строение молекулы бензола Применил теорию валентности к органическим веществам. В 1854 г. Кекуле впервые высказал идею
- 33. Скачать презентацию

























 Консультация для воспитателей Малые формы активного отдыха дошкольников
Консультация для воспитателей Малые формы активного отдыха дошкольников Русский космизм как антитеза жесткого разграничения человека и природы
Русский космизм как антитеза жесткого разграничения человека и природы Ткани и волокна
Ткани и волокна Масленица
Масленица Технология производства пекорино
Технология производства пекорино Типы экологических взаимодействий
Типы экологических взаимодействий Кислородные соединения азота
Кислородные соединения азота Анализ текста В.А. Солоухина Трава
Анализ текста В.А. Солоухина Трава Преждевременные роды. Грудной период и его характеристика
Преждевременные роды. Грудной период и его характеристика Пространственно развивающая среда -как условие успешной адаптации детей к условиям детского сада
Пространственно развивающая среда -как условие успешной адаптации детей к условиям детского сада Компания ALStyle Россия
Компания ALStyle Россия Приготування концентрату квасного сусла
Приготування концентрату квасного сусла Творческий проект по изготовлению плечевого изделия с цельнокроеным рукавом
Творческий проект по изготовлению плечевого изделия с цельнокроеным рукавом Різноманітність комах та хребетних тварин луки
Різноманітність комах та хребетних тварин луки Решение дробных рациональных уравнений. Алгебра 8 класс
Решение дробных рациональных уравнений. Алгебра 8 класс Говорящие фамилии в произведениях
Говорящие фамилии в произведениях Акция - Спасите ёжика!. ГБДОУ детский сад № 113 Выборгского района Санкт-Петербурга
Акция - Спасите ёжика!. ГБДОУ детский сад № 113 Выборгского района Санкт-Петербурга Разметка заготовок из тонколистового металла и проволоки
Разметка заготовок из тонколистового металла и проволоки Проект Smart Water у Шеньчжені
Проект Smart Water у Шеньчжені Артикуляционная гимнастика в стихах и картинках (презентация)
Артикуляционная гимнастика в стихах и картинках (презентация) Past Simple Tense
Past Simple Tense Общая неврология. Часть 1
Общая неврология. Часть 1 Оборудования для производства керамзита
Оборудования для производства керамзита Власть, влияние, лидерство
Власть, влияние, лидерство Что такое гигиена
Что такое гигиена Все дело в тоне
Все дело в тоне Акции. Бытхимия
Акции. Бытхимия Презентации
Презентации