Содержание
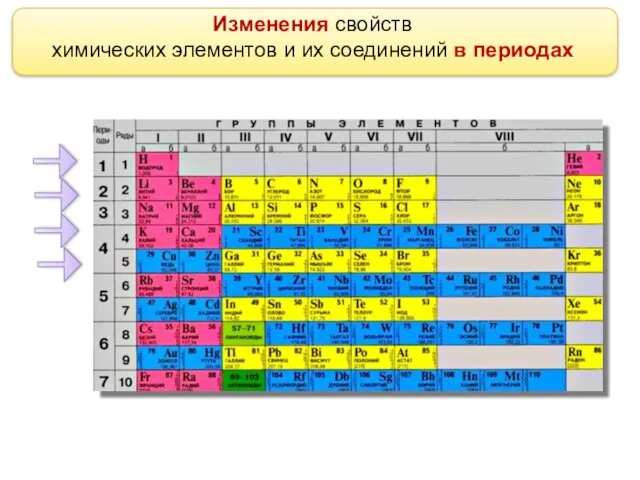
- 2. Изменения свойств химических элементов и их соединений в периодах
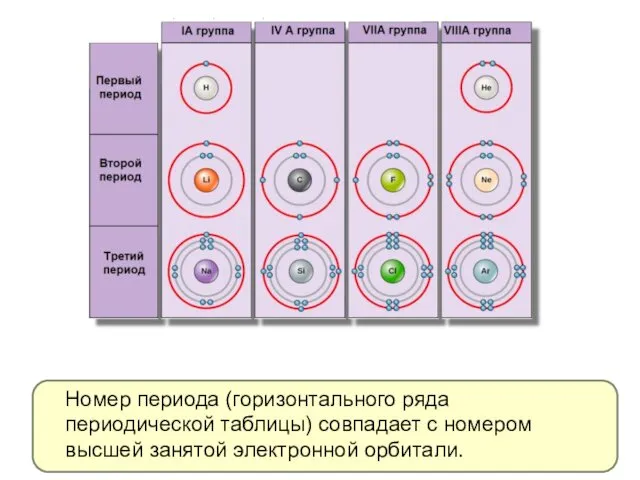
- 3. Номер периода (горизонтального ряда периодической таблицы) совпадает с номером высшей занятой электронной орбитали.
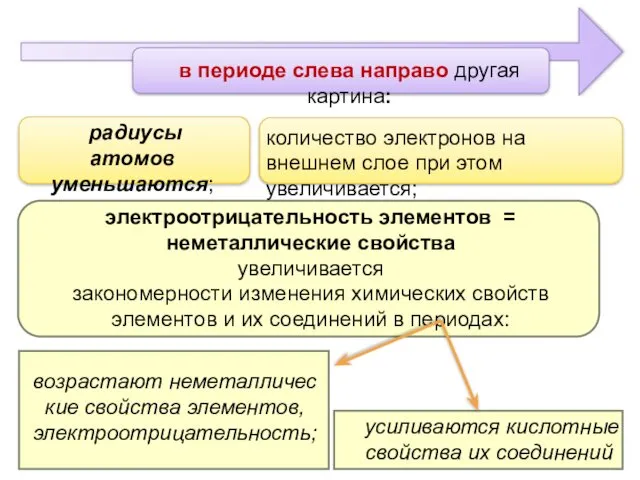
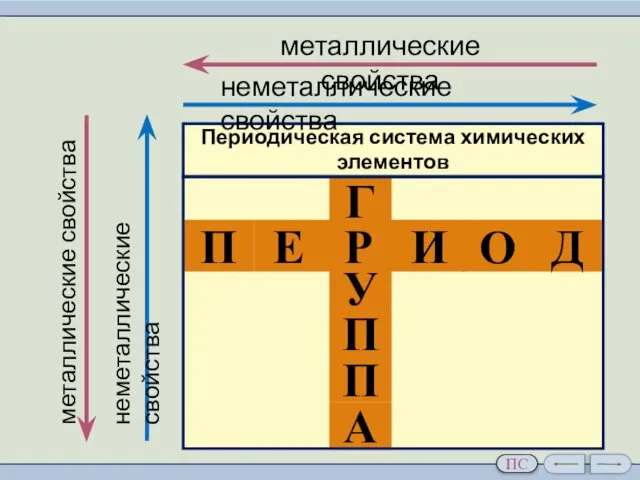
- 4. в периоде слева направо другая картина: усиливаются кислотные свойства их соединений радиусы атомов уменьшаются; количество электронов
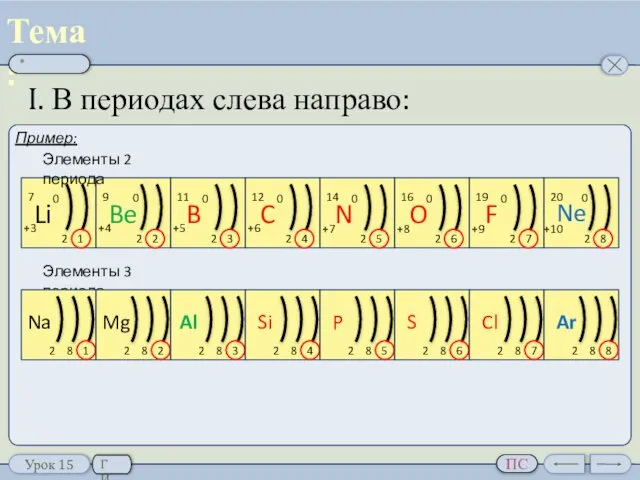
- 6. I. В периодах слева направо: Пример: 1 2 1 2 3 4 5 6 Элементы 2
- 7. I. В периодах слева направо: Пример: Элементы 2 периода Элементы 3 периода Периодическое изменение свойств элементов.
- 8. I. В периодах слева направо: Периодическое изменение свойств элементов.
- 9. Периодическое изменение свойств элементов.
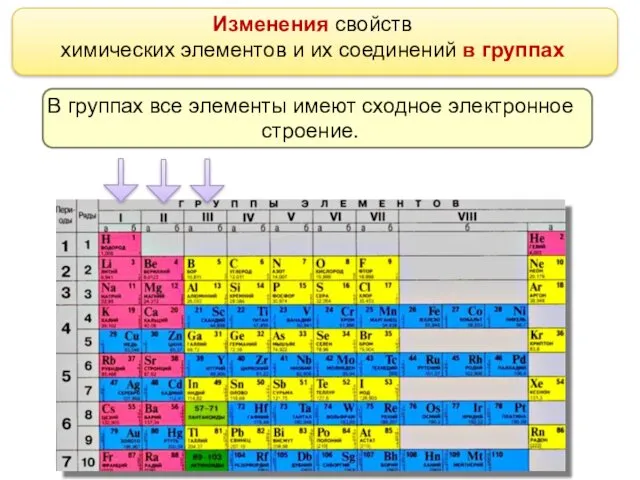
- 10. Изменения свойств химических элементов и их соединений в группах В группах все элементы имеют сходное электронное
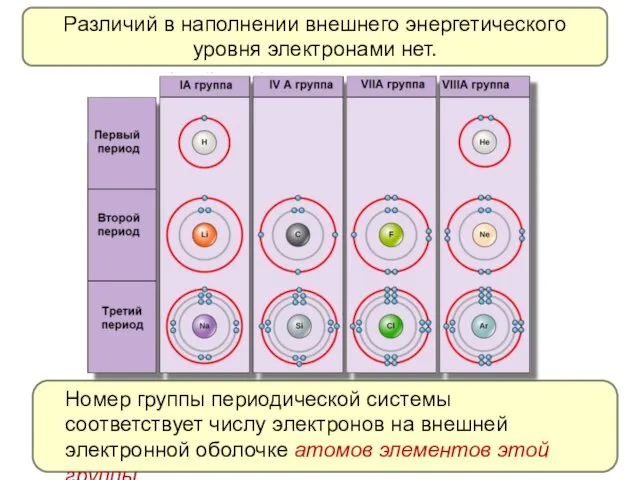
- 11. Различий в наполнении внешнего энергетического уровня электронами нет. Номер группы периодической системы соответствует числу электронов на
- 12. Меняется размер атома - сверху вниз в группе радиусы атомов увеличиваются! Периодический закон Д. И. Менделеева:
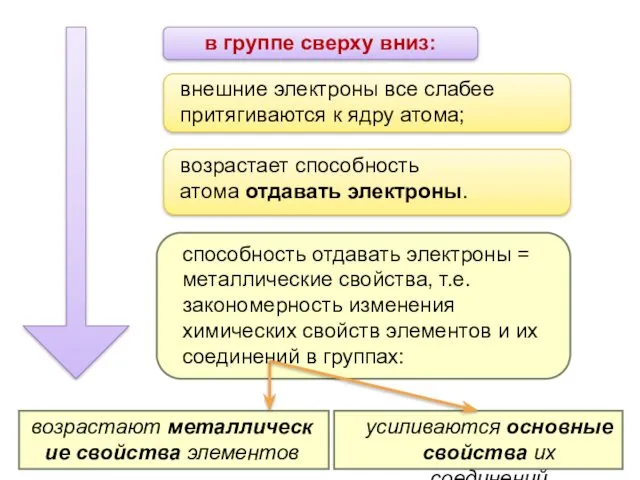
- 13. в группе сверху вниз: усиливаются основные свойства их соединений внешние электроны все слабее притягиваются к ядру
- 14. II. В группах сверху вниз: Периодическое изменение свойств элементов. Элементы IV A группы Элементы V A
- 15. II. В группах сверху вниз: Периодическое изменение свойств элементов. Плакат
- 17. Обобщение: Периодическое изменение свойств элементов. Свойства химических элементов периодически повторяются, так как периодически повторяется строение внешних
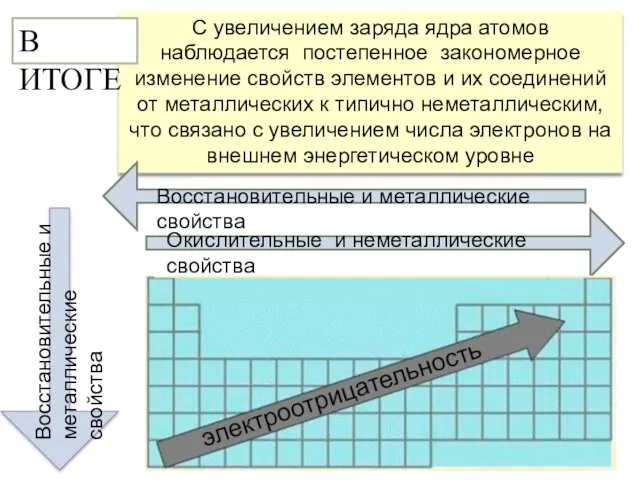
- 18. С увеличением заряда ядра атомов наблюдается постепенное закономерное изменение свойств элементов и их соединений от металлических
- 19. Zn Cr Al Sn Pb Mn Fe Be Есть еще элементы, которые образуют так называемые амфотерные
- 20. В ряду Li → Ве → В → С А усиливаются восстановительные свойства простых веществ Б
- 21. 3. Электронную конфигурацию 1s(2)2s(2)2р(6)3s(2)Зр(6)4S(0) имеет ион А Ca(0) Б Al(3+) В Cs(+) Г K(+)
- 22. 4. В каком ряду кислотность соединений возрастает А Cr(0), Cr(3+), Cr(+6) Б Mn(+6), Mn(+4), Mn(+2) В
- 23. 2. Усиление металлических свойств элементов представлено в ряду: А N → Р → As Б S
- 24. 5. Как изменяются кислотные свойства оксидов хрома в ряду: CrO - Cr2O3 - CrO3 А основной
- 25. 6. Даны элементы: F, O, N, Cl. Какие утверждения верны? А в заданном ряду элементов электроотрицательность
- 26. 7. Наиболее выражены металлические свойства у: А фософра Б азота В рубидия Г водорода
- 27. 8. Только амфотерные оксиды указаны в ряду: А Na2O, ZnO, CuO Б ZnO, Al2O3, Cr2O3 В
- 28. 9. Выберите правильное утверждение: А - в ряду элементов: Na – Si – Cl неметалличность простых
- 29. 10. Соединения элемента с порядковым номером 20 А простое вещество проявляет металлические свойства Б оксид элемента
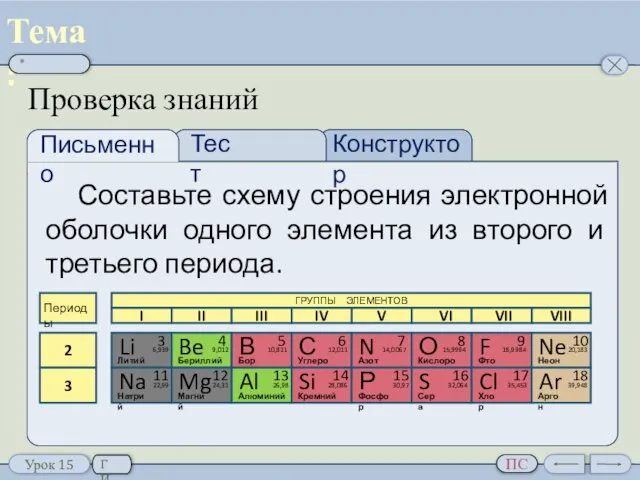
- 30. Проверка знаний Составьте схему строения электронной оболочки одного элемента из второго и третьего периода. Периодическое изменение
- 32. Скачать презентацию



















 Обработка и оценка результатов исследования
Обработка и оценка результатов исследования Острые проблемы промышленного развития и инвестиционной деятельности
Острые проблемы промышленного развития и инвестиционной деятельности Групповая работа. Команды по 4 ученика
Групповая работа. Команды по 4 ученика Опасные места в доме и его окрестностях
Опасные места в доме и его окрестностях Мой край родной - мой Дагестан !
Мой край родной - мой Дагестан ! Камиль Амирханов. Индивидуальное и корпоративное сопровождение по личной эффективности
Камиль Амирханов. Индивидуальное и корпоративное сопровождение по личной эффективности Промышленное рыболовство
Промышленное рыболовство Отряд ЮИД в ДОУ
Отряд ЮИД в ДОУ Рисунки на спилах
Рисунки на спилах Новая классификация медицинской помощи
Новая классификация медицинской помощи Презентация Поле чудес
Презентация Поле чудес Презентация мероприятия совместной деятельности детей и взрослого, проводимого с использованием ЭОР на тему Автоматизация звука [Ж].
Презентация мероприятия совместной деятельности детей и взрослого, проводимого с использованием ЭОР на тему Автоматизация звука [Ж]. Назначение, состав кабельных линий, типы кабелей. Тема 11
Назначение, состав кабельных линий, типы кабелей. Тема 11 Презентация Праздник урожая
Презентация Праздник урожая Натрий. Открытие натрия
Натрий. Открытие натрия Любовь в жизни Печорина. Женские образы и их роль в раскрытии характера Печорина в романе М.Ю. Лермонтова Герой нашего времени
Любовь в жизни Печорина. Женские образы и их роль в раскрытии характера Печорина в романе М.Ю. Лермонтова Герой нашего времени Презентация по теме Олимпийские игры в Сочи Диск
Презентация по теме Олимпийские игры в Сочи Диск Техника и технология ручной дуговой сварки (наплавки, резки) покрытыми электродами
Техника и технология ручной дуговой сварки (наплавки, резки) покрытыми электродами Программа саморазвития в процессе обучения на 1 курсе. Гараева
Программа саморазвития в процессе обучения на 1 курсе. Гараева Экологическое воспитание дошкольников
Экологическое воспитание дошкольников Угольная промышленность России
Угольная промышленность России Русский фольклор
Русский фольклор Решение систем линейных уравнений способом сложения
Решение систем линейных уравнений способом сложения Моя семья - моё богатство
Моя семья - моё богатство Контрасты цвета по А. С. Зайцеву
Контрасты цвета по А. С. Зайцеву Поняття про технології точного землеробства
Поняття про технології точного землеробства внеурочная деятельность - занятие по краеведению Моя малая родина (конспект+ презентация)
внеурочная деятельность - занятие по краеведению Моя малая родина (конспект+ презентация) Гипотензивные средства _2020
Гипотензивные средства _2020