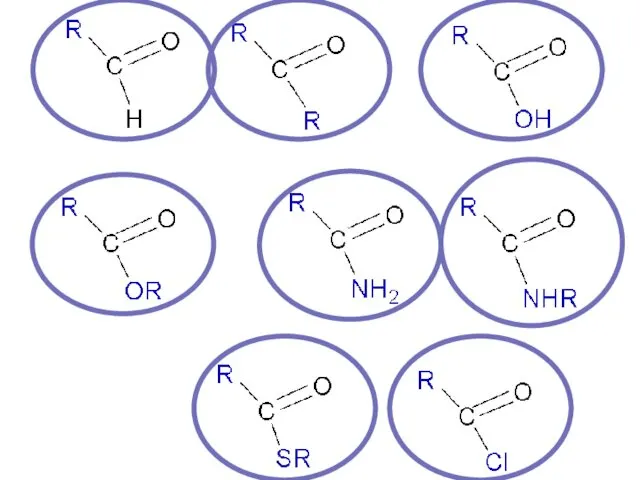
Содержание
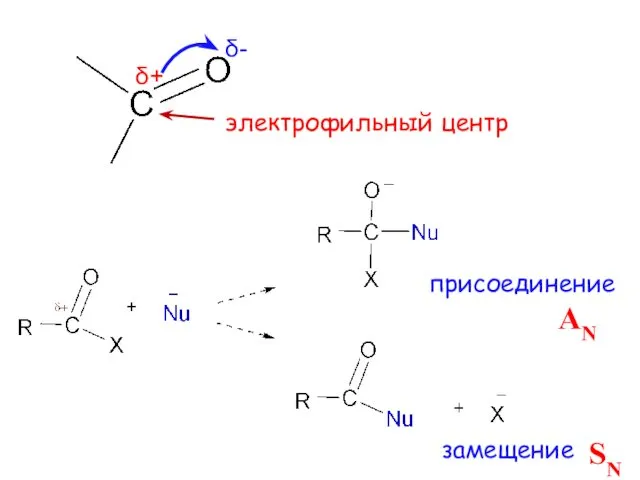
- 3. δ+ присоединение замещение δ- электрофильный центр AN SN
- 4. Реакционная способность альдегидов и кетонов
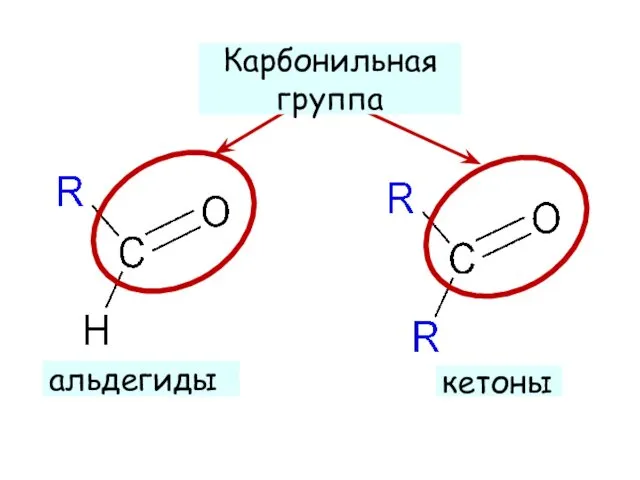
- 5. альдегиды кетоны Карбонильная группа
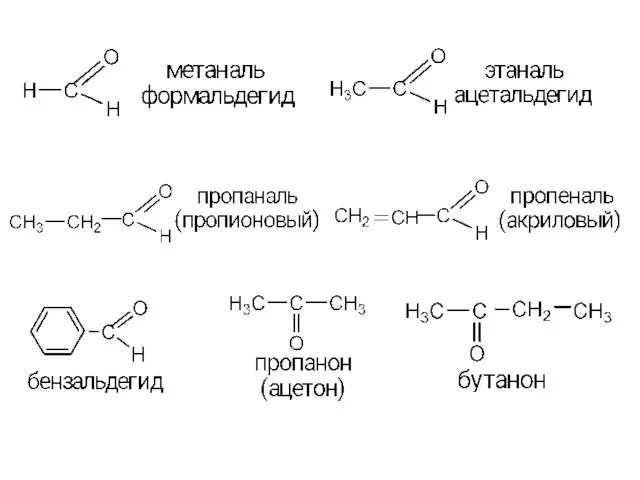
- 7. низшие альдегиды и кетоны хорошо растворимы в воде ацетон летуч Физические свойства
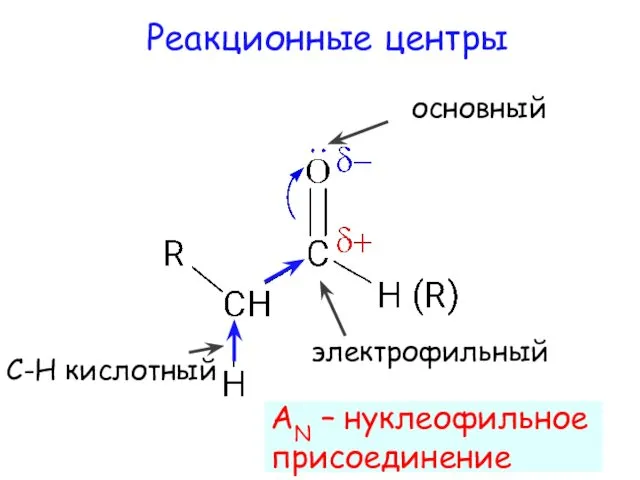
- 8. электрофильный Реакционные центры основный С-Н кислотный AN – нуклеофильное присоединение
- 9. Скорость реакций AN зависит: 1) от величины положительного заряда на атоме углерода карбонильной группы 2) пространственной
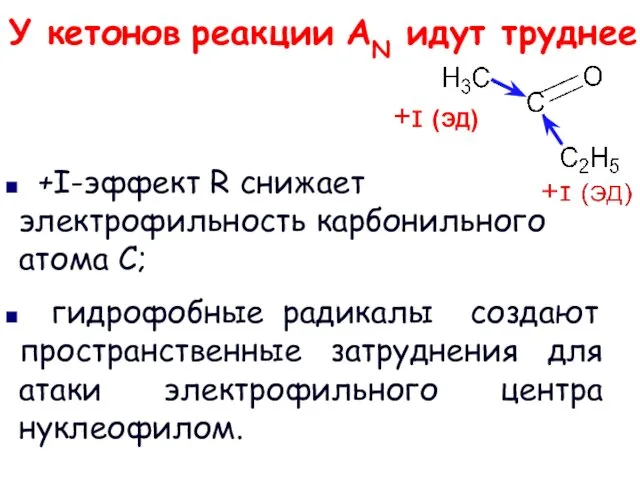
- 10. У кетонов реакции AN идут труднее +I-эффект R снижает электрофильность карбонильного атома С; гидрофобные радикалы создают
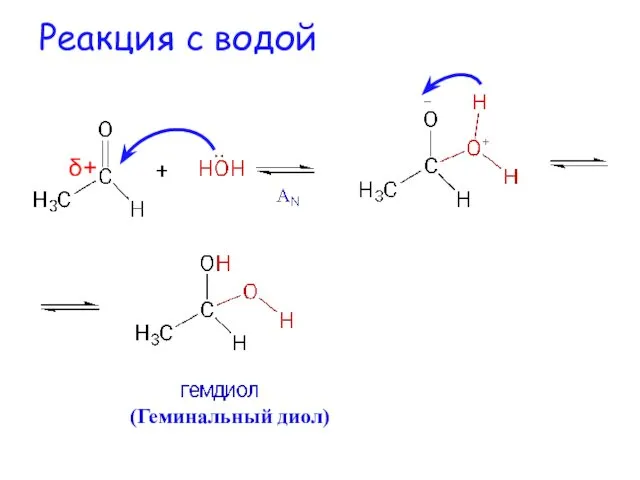
- 11. Реакция с водой δ+ (Геминальный диол)
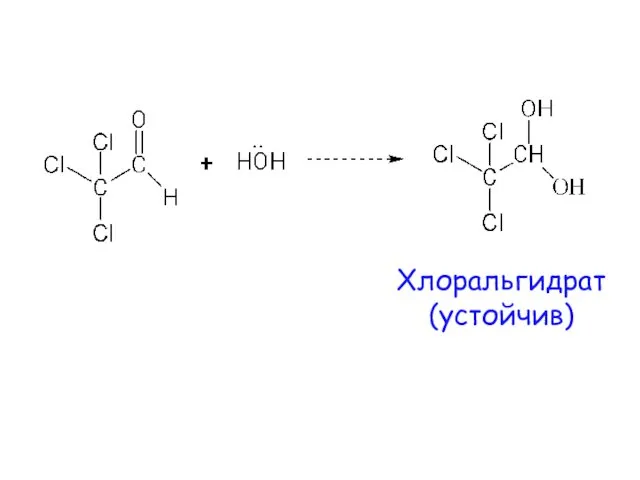
- 12. Хлоральгидрат (устойчив)
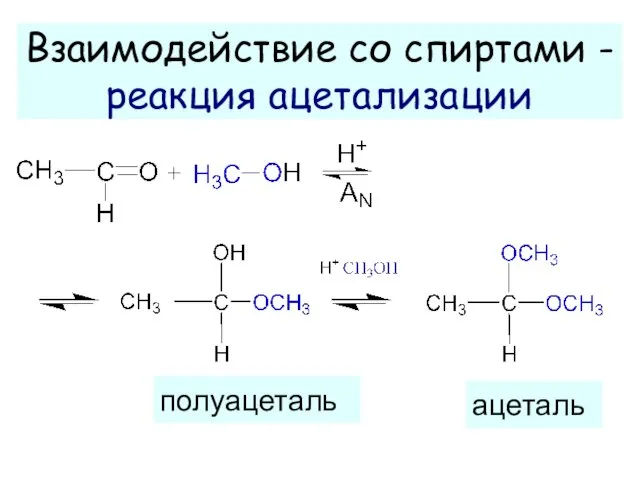
- 13. Взаимодействие со спиртами - реакция ацетализации полуацеталь ацеталь
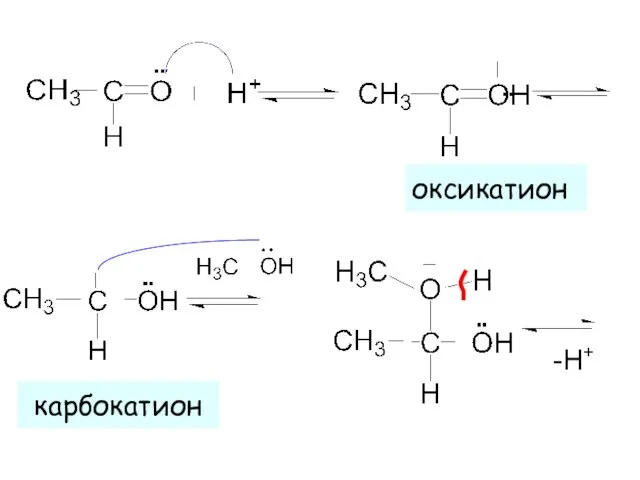
- 14. оксикатион карбокатион -H+ ▪▪ ▪▪
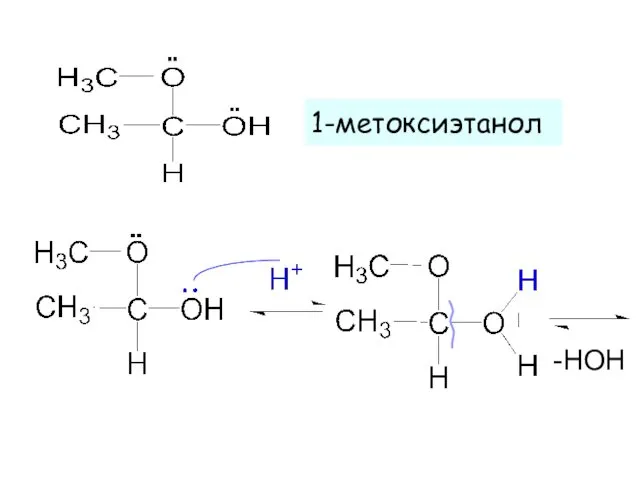
- 15. 1-метоксиэтанол -HOH
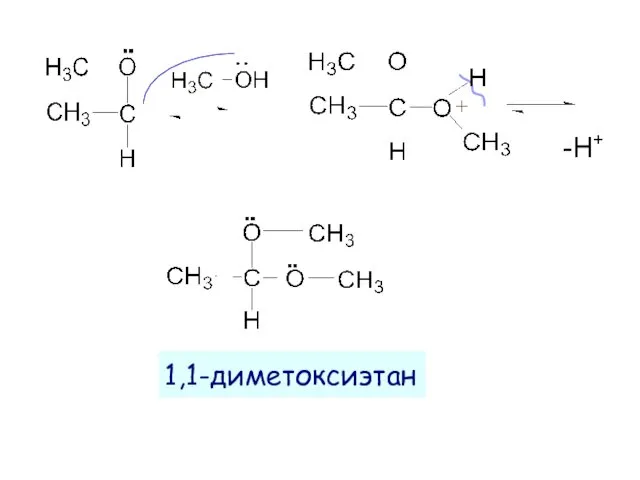
- 16. 1,1-диметоксиэтан -H+
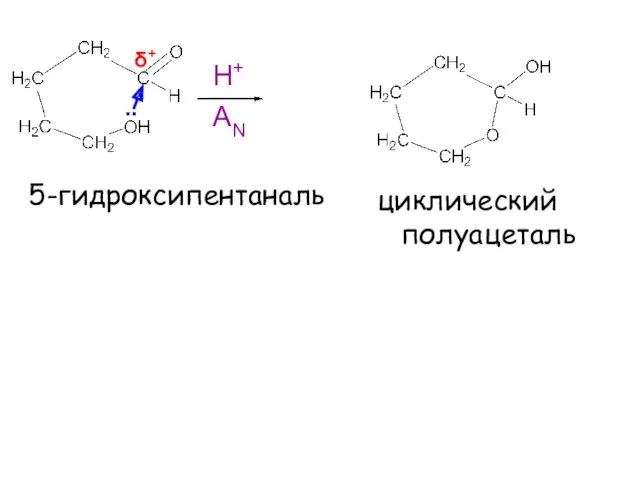
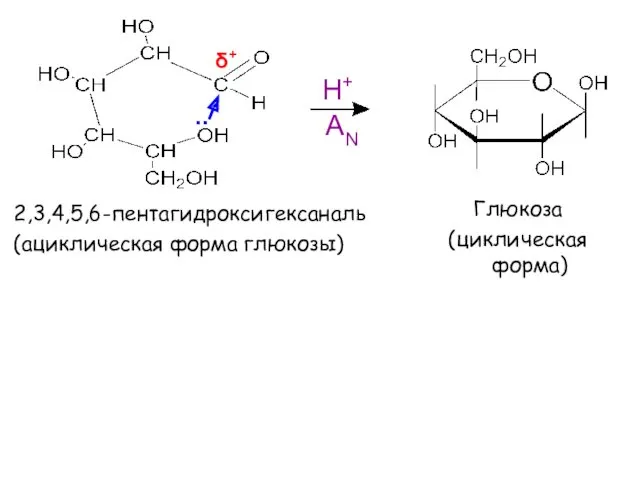
- 17. Реакция ацетализациии лежит в основе образования циклических форм моносахаридов
- 18. 5-гидроксипентаналь Н+ .. δ+ циклический полуацеталь AN
- 19. Глюкоза (циклическая форма) Н+ .. δ+ 2,3,4,5,6-пентагидроксигексаналь (ациклическая форма глюкозы) AN
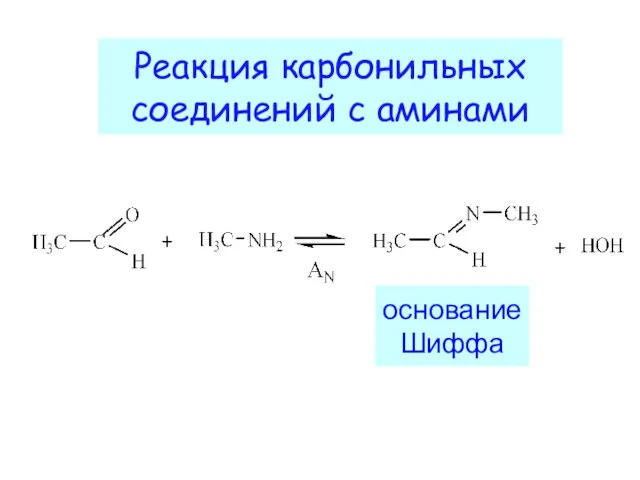
- 20. Реакция карбонильных соединений с аминами основание Шиффа
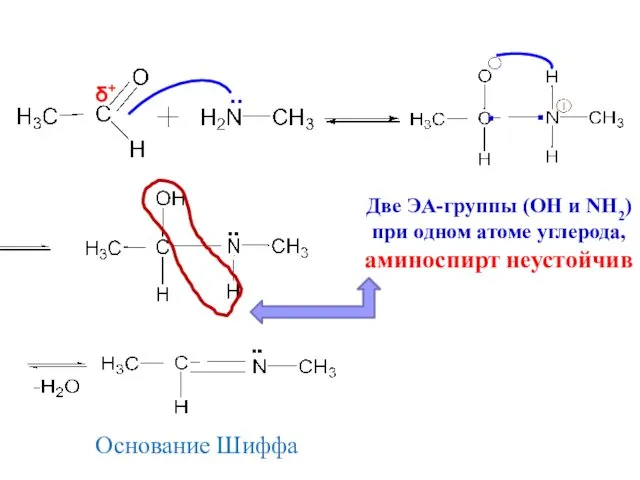
- 21. δ+ .. ▪ ▪ Две ЭА-группы (ОН и NH2) при одном атоме углерода, аминоспирт неустойчив Основание
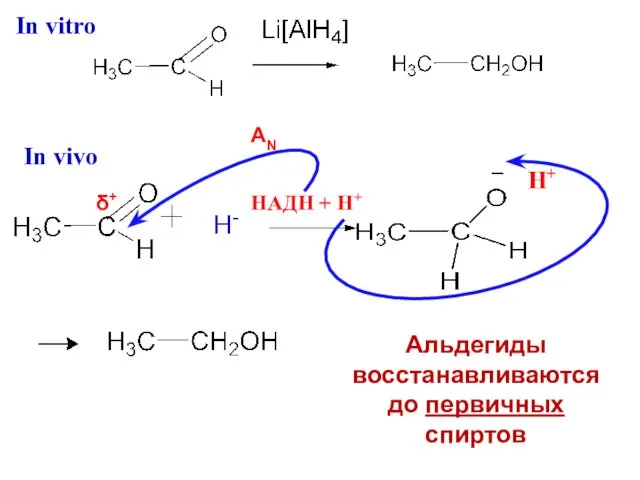
- 22. in vitro - с участием Li[AlH4] in vivo - с участием фермента НАДН + Н+ Восстановление
- 23. δ+ AN Н+ Альдегиды восстанавливаются до первичных спиртов НАДН + Н+ In vitro In vivo
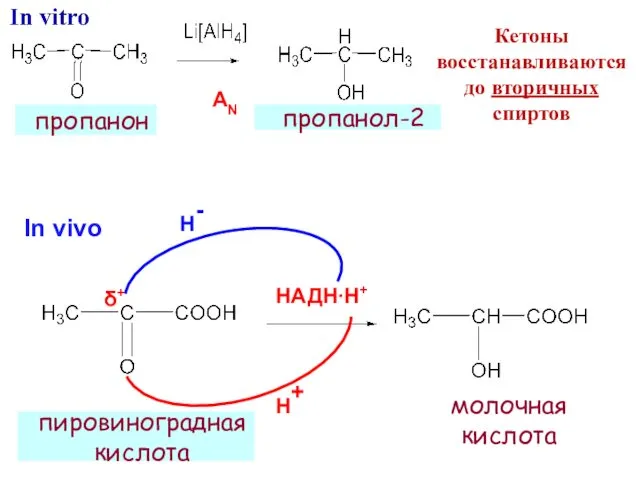
- 24. НАДН∙Н+ Н- Н+ In vivo пировиноградная кислота δ+ пропанол-2 пропанон AN молочная кислота Кетоны восстанавливаются до
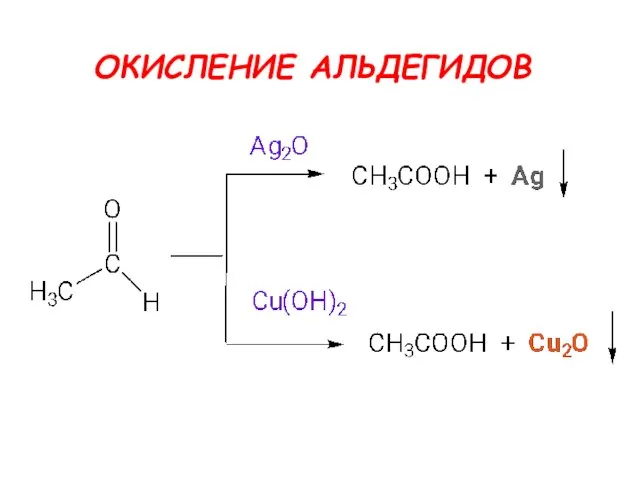
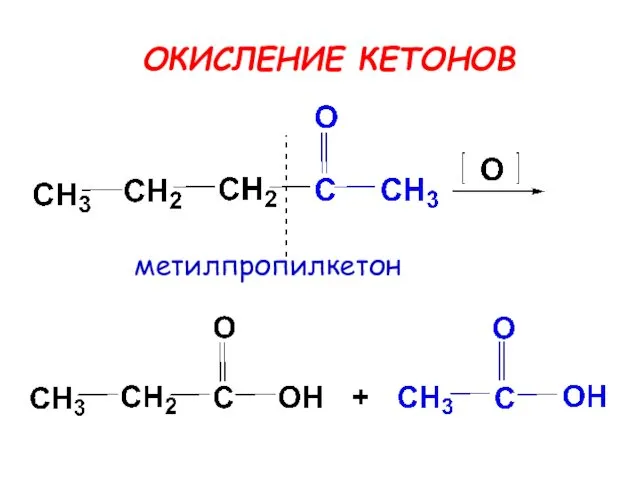
- 25. ОКИСЛЕНИЕ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ альдегиды окисляются легко, до карбоновых кислот кетоны - трудно, с разрывом С-С связей
- 26. ОКИСЛЕНИЕ АЛЬДЕГИДОВ
- 27. ОКИСЛЕНИЕ КЕТОНОВ метилпропилкетон
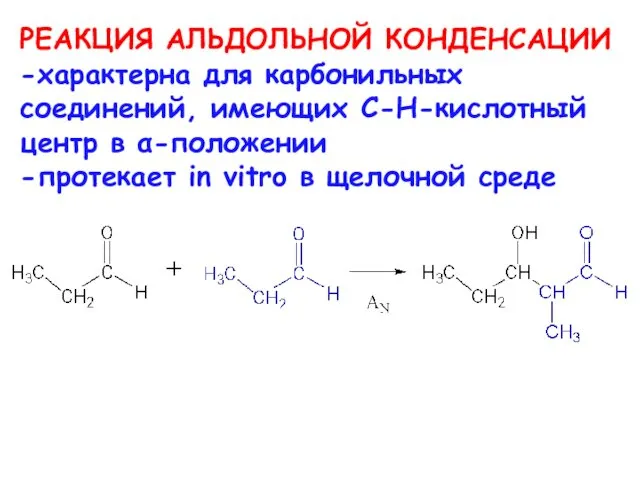
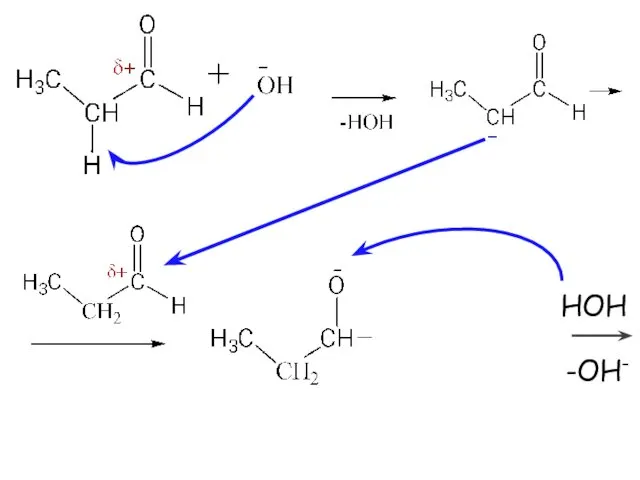
- 28. РЕАКЦИЯ АЛЬДОЛЬНОЙ КОНДЕНСАЦИИ -характерна для карбонильных соединений, имеющих C-H-кислотный центр в α-положении -протекает in vitro в
- 29. НОН -ОН-
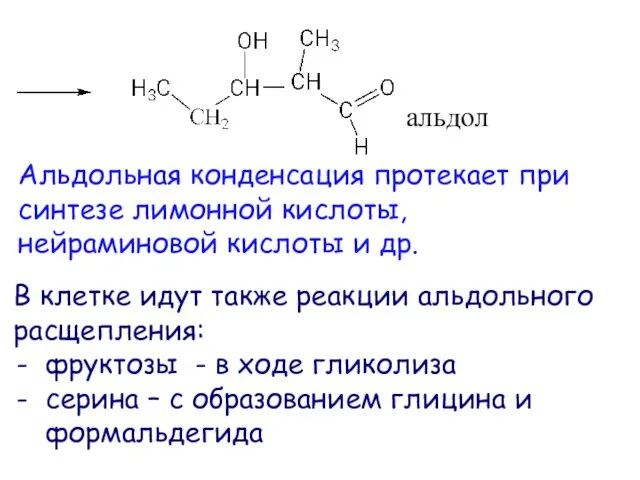
- 30. альдол Альдольная конденсация протекает при синтезе лимонной кислоты, нейраминовой кислоты и др. В клетке идут также
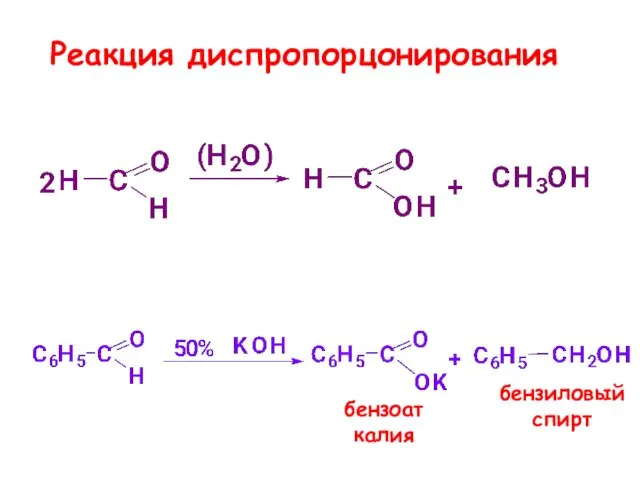
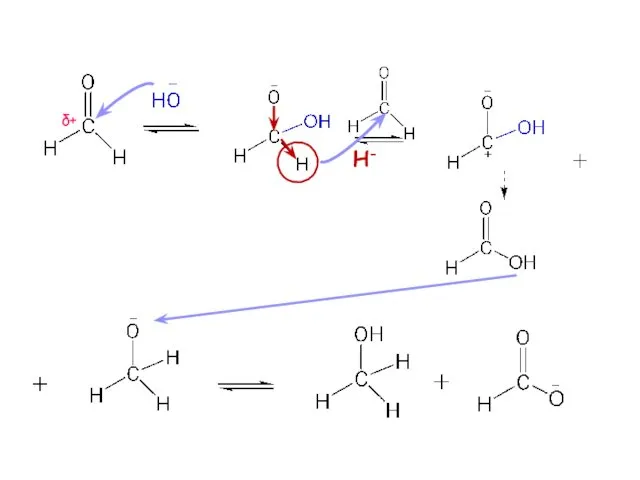
- 31. Реакция диспропорцонирования характерна для альдегидов, не имеющих С-Н-кислотного центра в α-положении протекает in vitro в щелочной
- 32. Реакция диспропорцонирования бензоат калия бензиловый спирт
- 34. δ+ H-
- 35. Формалин – 40% р-р формальдегида -используется для консервирования анатомических препаратов -как дезинфицирующее средство -вызывает денатурацию белков
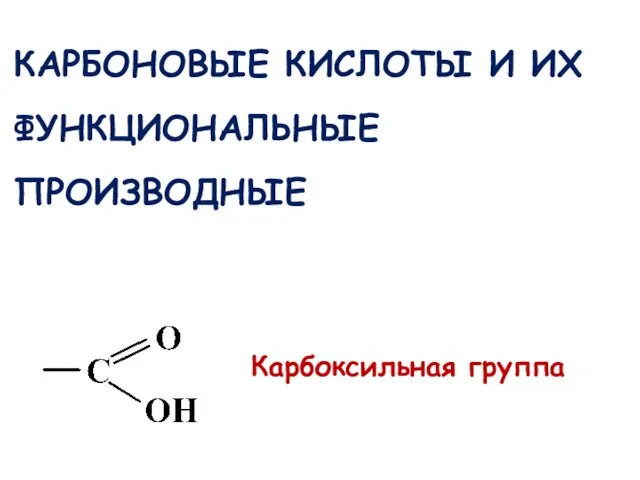
- 36. КАРБОНОВЫЕ КИСЛОТЫ И ИХ ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ Карбоксильная группа
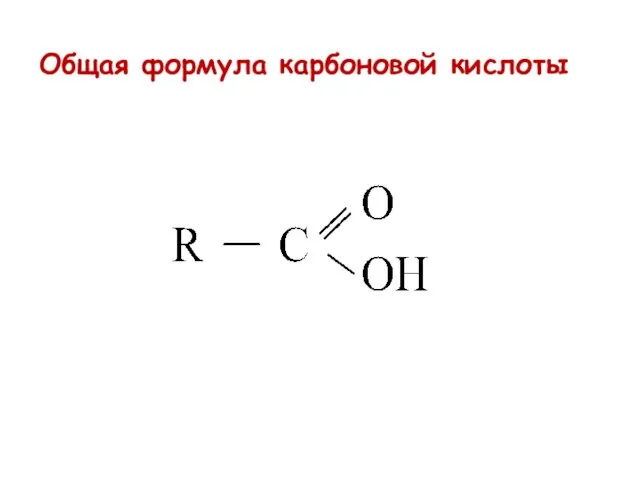
- 37. Общая формула карбоновой кислоты
- 38. Низшие кислоты (муравьиная, уксусная, пропионовая) бесцветные жидкости, хорошо растворимы в воде Кислоты с числом 4-9 атомов
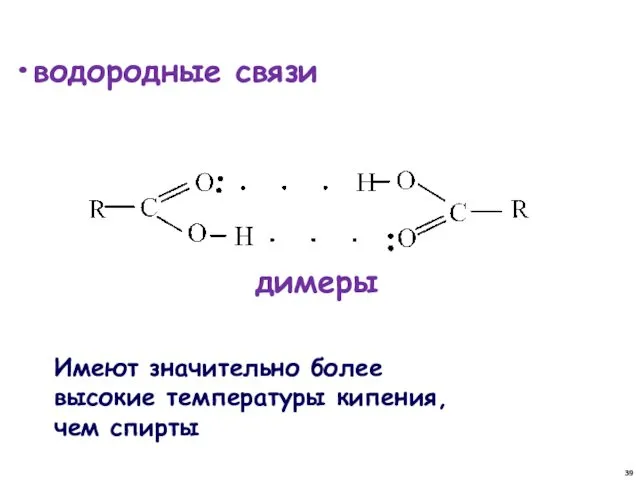
- 39. водородные связи димеры Имеют значительно более высокие температуры кипения, чем спирты
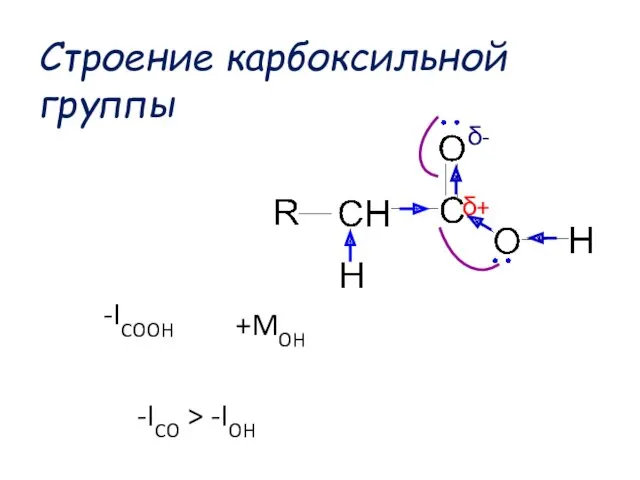
- 40. -ICO > -IOH +MOH δ+ δ- -ICOOH Строение карбоксильной группы
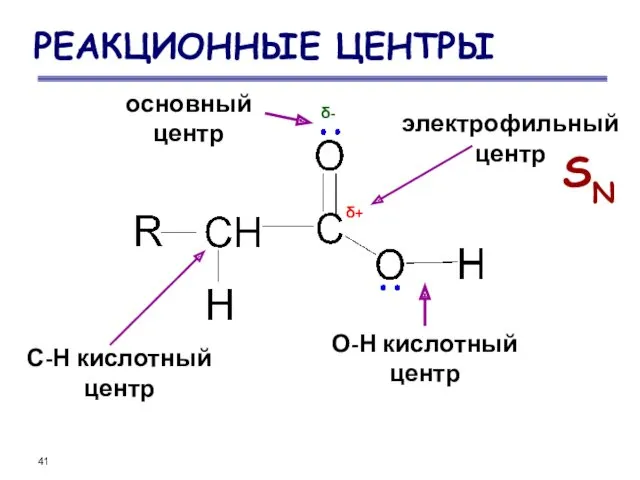
- 41. РЕАКЦИОННЫЕ ЦЕНТРЫ основный центр электрофильный центр О-Н кислотный центр С-Н кислотный центр SN δ+ δ-
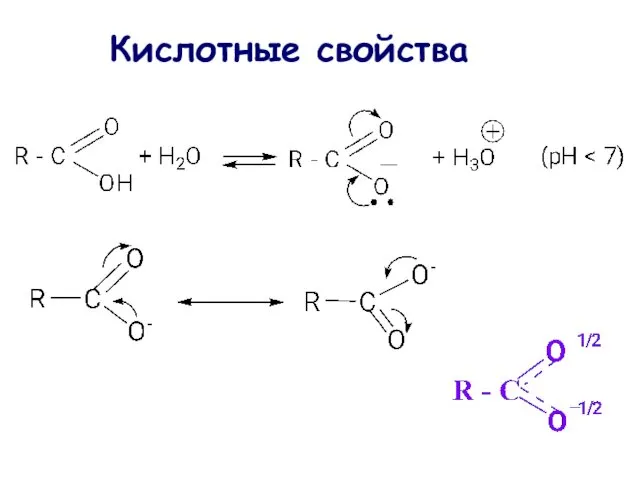
- 42. Кислотные свойства
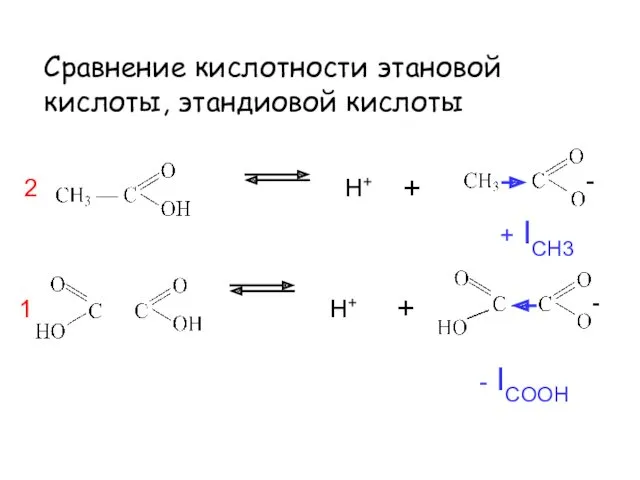
- 43. Сравнение кислотности этановой кислоты, этандиовой кислоты H+ H+ + + - ICOOH + ICH3 1 2
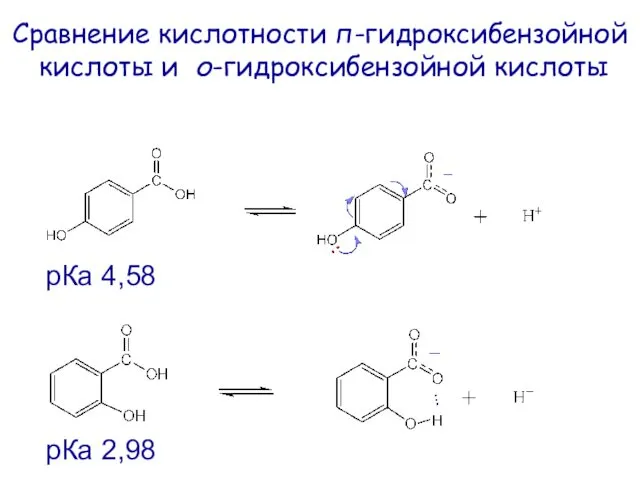
- 44. Сравнение кислотности п-гидроксибензойной кислоты и о-гидроксибензойной кислоты рКа 4,58 рКа 2,98
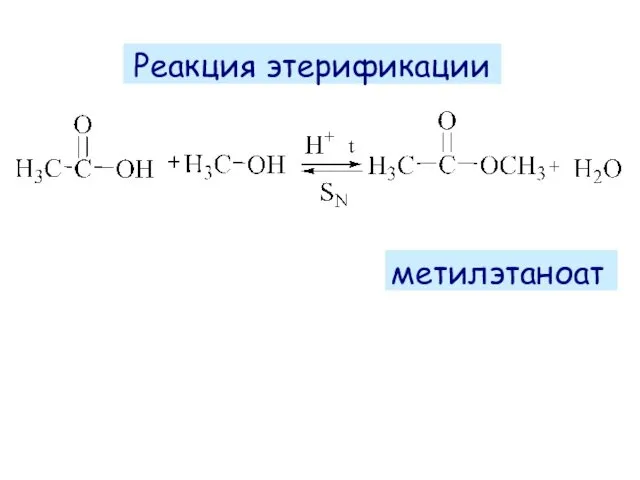
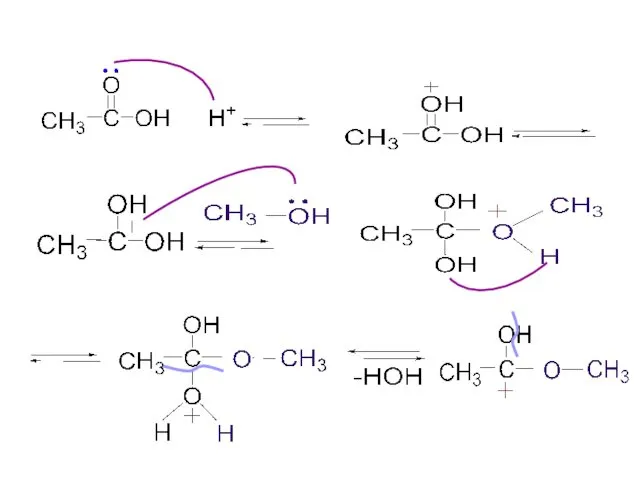
- 45. Реакция этерификации метилэтаноат
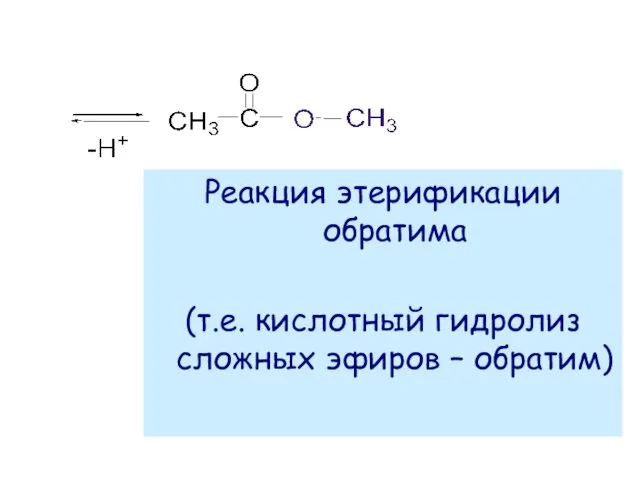
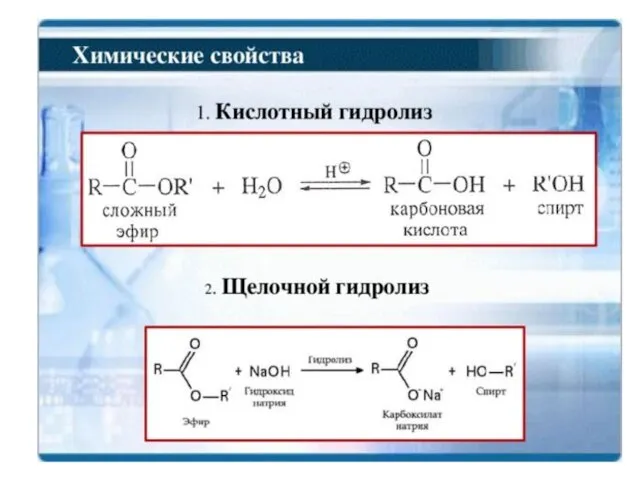
- 47. Реакция этерификации обратима (т.е. кислотный гидролиз сложных эфиров – обратим)
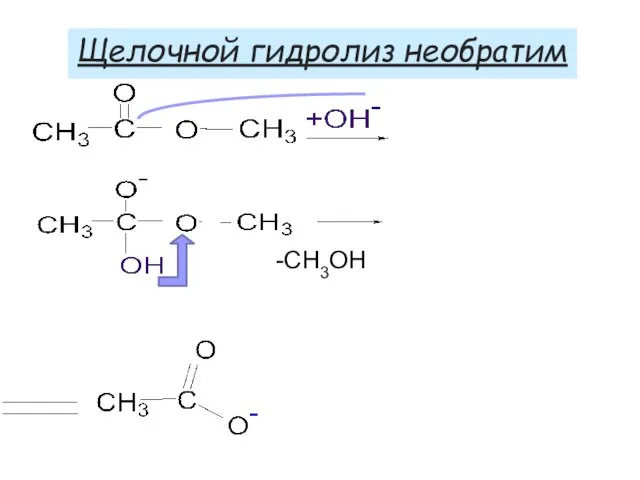
- 49. -СН3ОН Щелочной гидролиз необратим
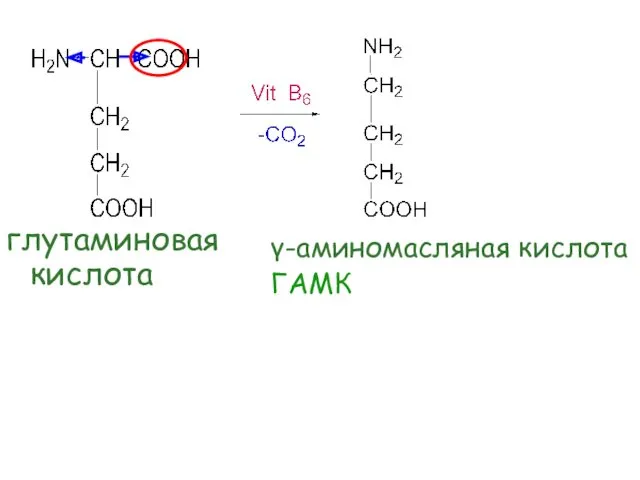
- 50. Реакции декарбоксилирования Отщепление СО2 Характерны для карбоновых кислот, содержащих в α- положении электроноакцептор
- 51. γ-аминомасляная кислота ГАМК глутаминовая кислота
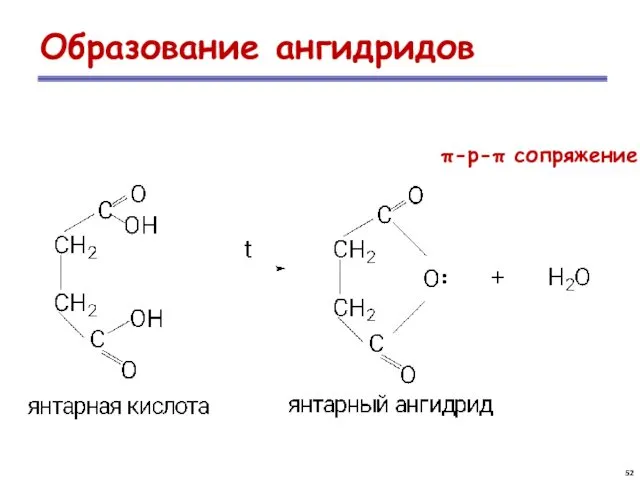
- 52. Образование ангидридов π-р-π сопряжение ..
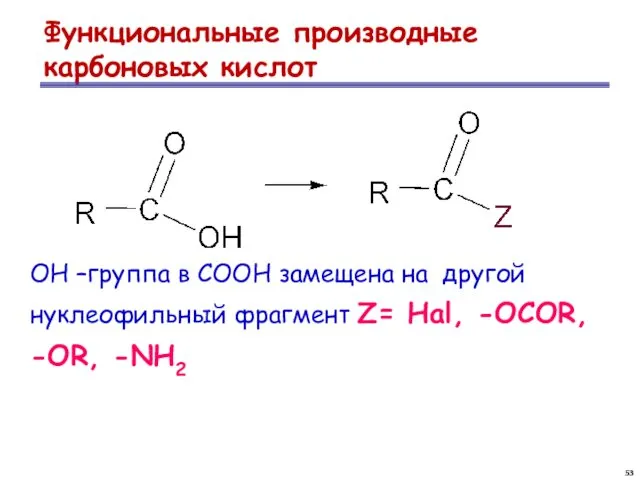
- 53. Функциональные производные карбоновых кислот ОН –группа в СООН замещена на другой нуклеофильный фрагмент Z= Hal, -OCOR,
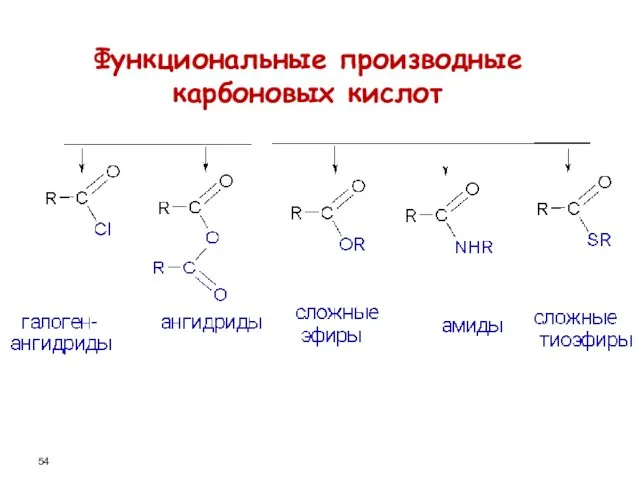
- 54. Функциональные производные карбоновых кислот
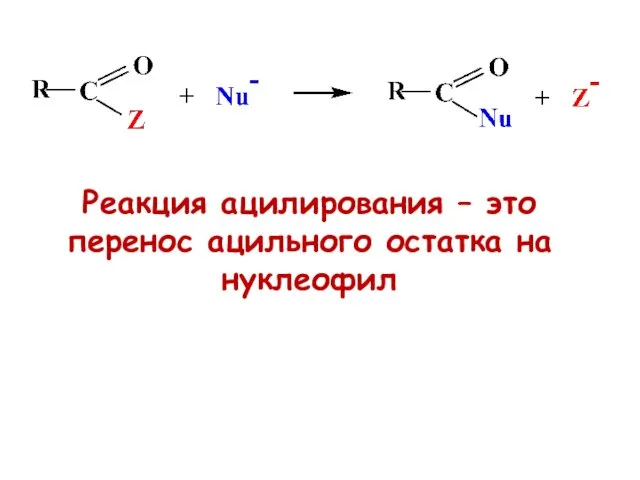
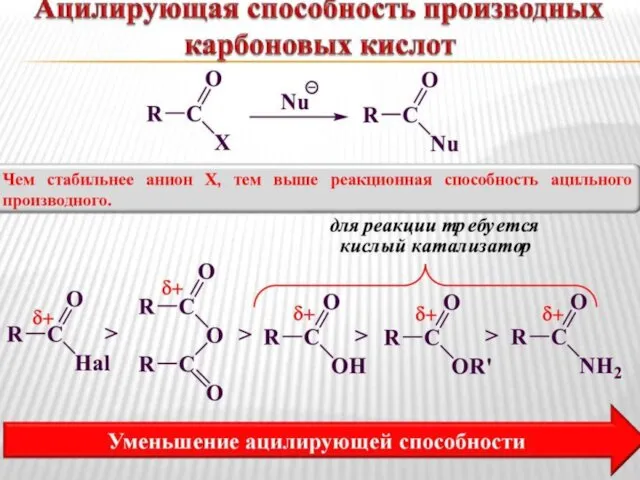
- 55. Реакция ацилирования – это перенос ацильного остатка на нуклеофил
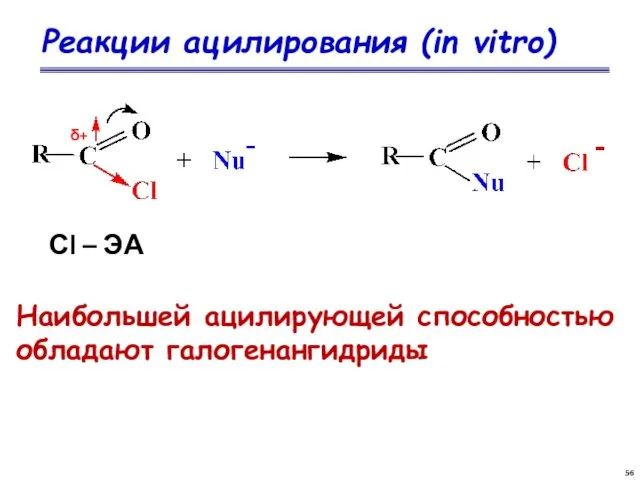
- 56. Реакции ацилирования (in vitro) δ+ Сl – ЭА Наибольшей ацилирующей способностью обладают галогенангидриды
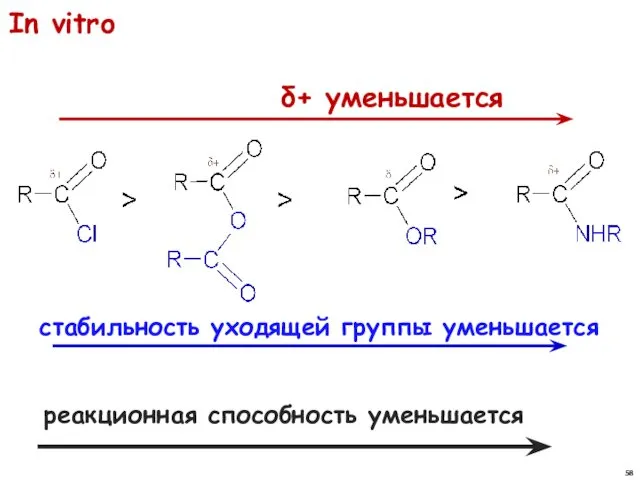
- 57. Величиной эффективного положительного заряда на атоме углерода карбонильной группы Стабильностью уходящей группы Реакционная способность в реакциях
- 58. реакционная способность уменьшается In vitro δ+ уменьшается стабильность уходящей группы уменьшается
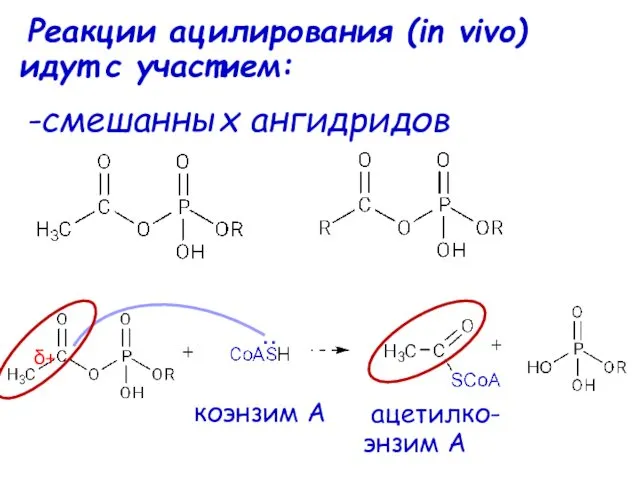
- 60. Реакции ацилирования (in vivo) идут с участием: -смешанных ангидридов δ+ .. ацетилко- энзим А коэнзим А
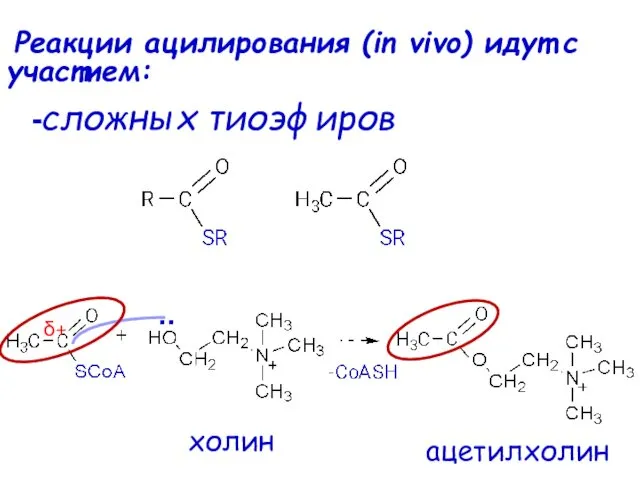
- 61. Реакции ацилирования (in vivo) идут с участием: -сложных тиоэфиров .. δ+ холин ацетилхолин
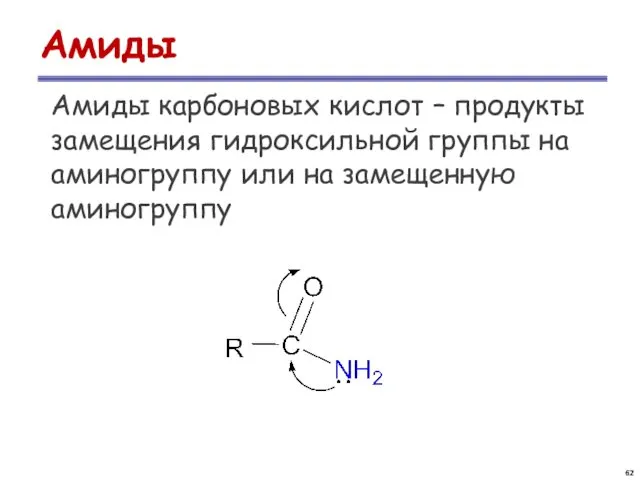
- 62. Амиды Амиды карбоновых кислот – продукты замещения гидроксильной группы на аминогруппу или на замещенную аминогруппу
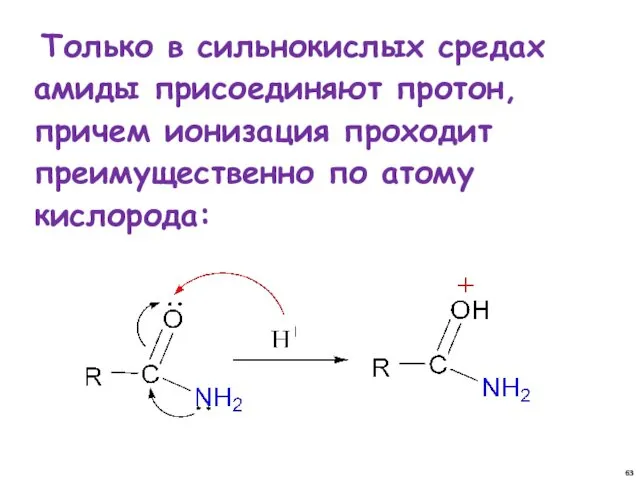
- 63. Только в сильнокислых средах амиды присоединяют протон, причем ионизация проходит преимущественно по атому кислорода:
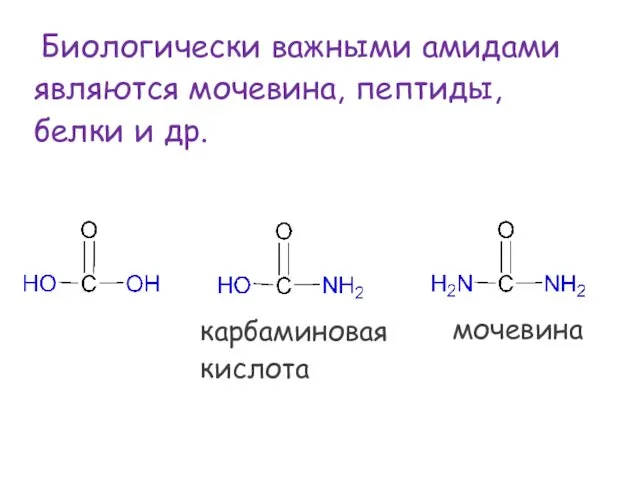
- 64. Биологически важными амидами являются мочевина, пептиды, белки и др. карбаминовая кислота мочевина
- 66. Скачать презентацию




![in vitro - с участием Li[AlH4] in vivo - с](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/35627/slide-21.jpg)







 Восточные славяне в древности
Восточные славяне в древности СПЕЦИФИКА_ПОДАЧИ_НОВОСТНОГО_КОНТЕНТА_НА_СОВРЕМЕННОМ_ТЕЛЕВИДЕНИИ
СПЕЦИФИКА_ПОДАЧИ_НОВОСТНОГО_КОНТЕНТА_НА_СОВРЕМЕННОМ_ТЕЛЕВИДЕНИИ Проектирование зданий с использованием нетрадиционных источников энергии (биогаза)
Проектирование зданий с использованием нетрадиционных источников энергии (биогаза) Права ребёнка в англо-говорящих странах и в России
Права ребёнка в англо-говорящих странах и в России Интернет в жизни старшеклассника: за или против
Интернет в жизни старшеклассника: за или против Акустическая система
Акустическая система Жидкие лекарственные формы
Жидкие лекарственные формы Методика профессионального обучения как наука и учебный предмет
Методика профессионального обучения как наука и учебный предмет ПО СТРАНИЦАМ ИСТОРИИ РОССИЙСКОЙ ХИМИЧЕСКОЙ НАУКИ
ПО СТРАНИЦАМ ИСТОРИИ РОССИЙСКОЙ ХИМИЧЕСКОЙ НАУКИ Использование ТКМ на уроках химии.Тема занятия Влияет ли строение вещества на его физические свойства? 11 класс
Использование ТКМ на уроках химии.Тема занятия Влияет ли строение вещества на его физические свойства? 11 класс Технохимический контроль при производстве плодов кориандра
Технохимический контроль при производстве плодов кориандра Сочинение по картине Г.Г. Нисского Февраль. Подмосковье. 5 класс
Сочинение по картине Г.Г. Нисского Февраль. Подмосковье. 5 класс Контрольно-измерительные материалы. Русский язык 3 класс. Состав слова
Контрольно-измерительные материалы. Русский язык 3 класс. Состав слова Деление круглых сотен. 3 класс
Деление круглых сотен. 3 класс Podstawy hotelarstwa
Podstawy hotelarstwa Использование технических средств обучения (ТСО) в процессе преподавания психологии
Использование технических средств обучения (ТСО) в процессе преподавания психологии Материалы и оборудование для капиллярного контроля сварных соединений. Капиллярный метод неразрушающего контроля
Материалы и оборудование для капиллярного контроля сварных соединений. Капиллярный метод неразрушающего контроля Топонимика Карелии
Топонимика Карелии Работа процессора с трехадресной адресацией
Работа процессора с трехадресной адресацией Психопаталогия Саморукова
Психопаталогия Саморукова Клинический случай. Клещевой сыпной тиф, средней степени тяжести
Клинический случай. Клещевой сыпной тиф, средней степени тяжести Сертификация продуктов и услуг
Сертификация продуктов и услуг История создания микроволновой печи
История создания микроволновой печи Права и обязанности супругов в исламе
Права и обязанности супругов в исламе Motor Sich
Motor Sich Викторина по сказке Г.Х.Андерсена Бузинная матушка
Викторина по сказке Г.Х.Андерсена Бузинная матушка Презентация к уроку природоведения 5 класс Какие условия необходимы для реакции горения
Презентация к уроку природоведения 5 класс Какие условия необходимы для реакции горения Великие флотоводцы. Презентация.
Великие флотоводцы. Презентация.