Слайд 2

Кислоты
Высшим оксидам неметаллов соответствуют следующие кислоты
Слайд 3
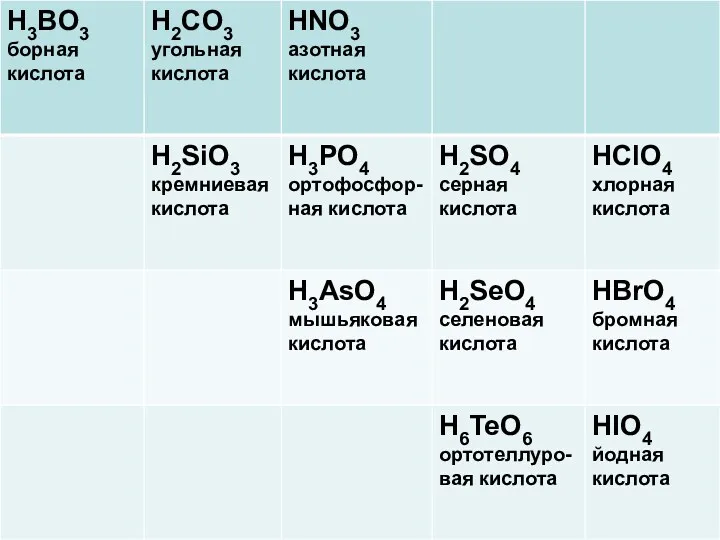
Высшим оксидам неметаллов соответствуют следующие кислоты
Слайд 4
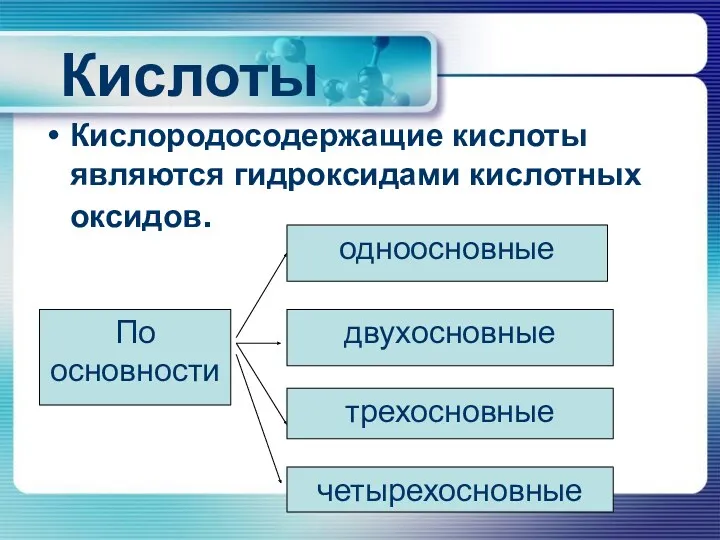
Кислоты
Кислородосодержащие кислоты являются гидроксидами кислотных оксидов.
По основности
одноосновные
двухосновные
трехосновные
четырехосновные
Слайд 5
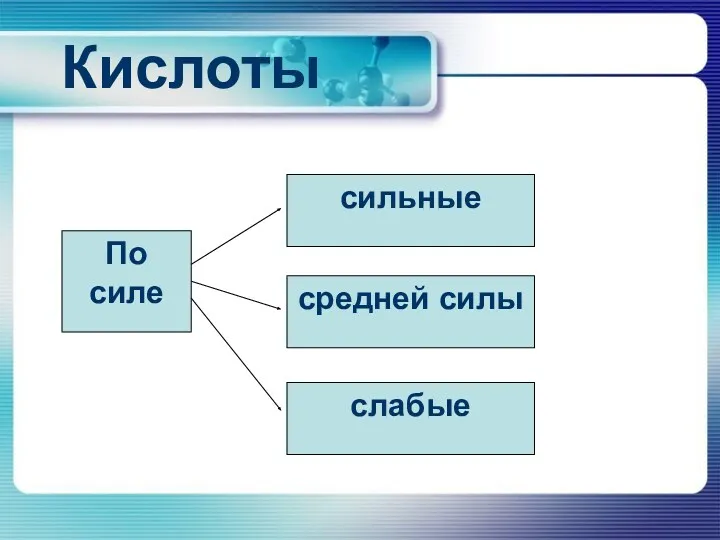
Кислоты
По силе
сильные
средней силы
слабые
Слайд 6
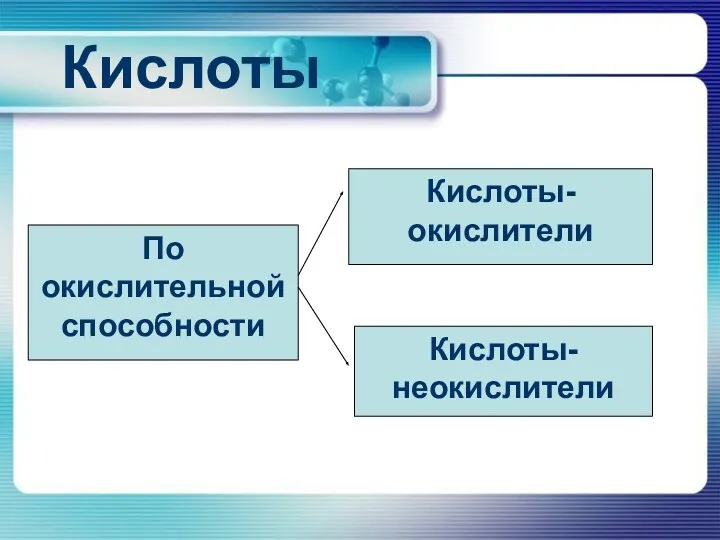
Кислоты
По окислительной способности
Кислоты-окислители
Кислоты-неокислители
Слайд 7
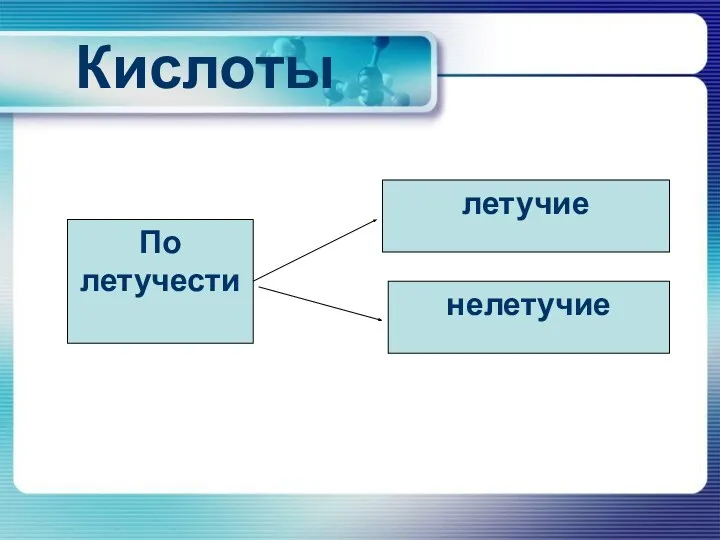
Кислоты
По летучести
летучие
нелетучие
Слайд 8
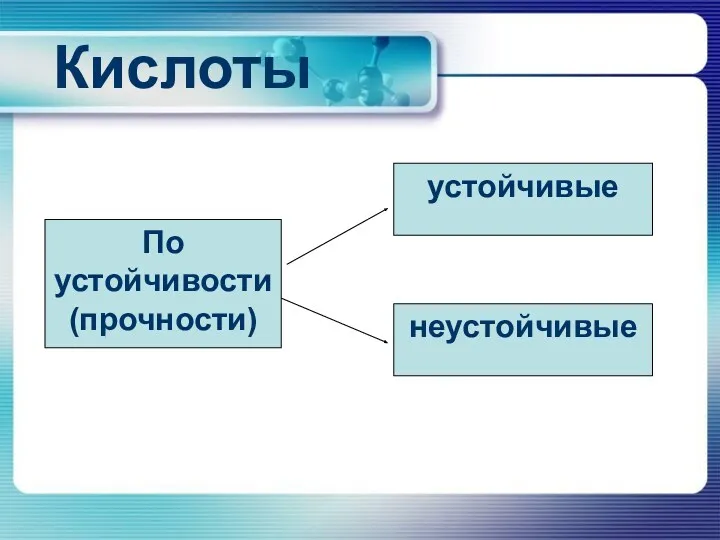
Кислоты
По устойчивости (прочности)
устойчивые
неустойчивые
Слайд 9

Кислоты
Физические свойства
По агрегатному состоянию:
большинство кислот жидкости
некоторые растворы газов в воде
(H2CO3, H2SO3)
некоторые твердые вещества (H3PO4, H3BO3, HIO4)
Слайд 10

Кислоты
Почти все кислоты хорошо растворимы в воде кроме H2SiO3
При растворении в
воде метакислоты переходят в ортокислоты
HPO3 + H2O =
Слайд 11

Кислоты
Общие химические свойства кислот:
Попробуйте вспомнить и перечислите все химические свойства. Приведите
пример на каждое свойство (молекулярные и ионные уравнения).
Слайд 12

Кислоты
Кислоты-неокислители взаимодействуют с металлами стоящими в ряду напряжений до водорода и
образуется водород и соль металла с низшей С.О.
Слайд 13

Кислоты
Кислоты-окислители (H2SO4, HNO3) в водном растворе вступают в реакции практически со
всеми металлами (кр.Au, Pt ). В качестве окислителя выступает анион кислотного остатка. В результате этих реакций образуются соль металла в высшей С.О., вода и продукт восстановления кислоты.
Слайд 14

Кислоты
Почти все кислоты разлагаются при нагревании.
Если при разложении не происходит ОВР,
то продуктами разложения являются вода и кислотный оксид(или кислота с меньшим содержанием H2O)
Слайд 15

Кислоты
Если разложение ОВР, то продукты разнообразны:
4HNO3 = 4NO2 + O2 +
2H2O
3HNO2 = HNO3 + 2NO + H2O
3HClO = 2HCl + HClO3
4H3PO3 = 3H3PO4 + PH3
Слайд 16

Кислоты
С неметаллами реагируют только кислоты обладающими сильными окислительными свойствами.
При их
взаимодействии неметалл окисляется до соответствующей кислоты(или ее ангидрида), а кислота восстанавливается до газообразного оксида.
H2SO4 (конц)- SO2 HNO3(конц)- NO2
HNO3(разб)- NO
Слайд 17

Кислоты
S + HNO3 (разб) =
S + HNO3 (конц) =
C + HNO3
(конц) =
S + H2SO4 (конц) =
P + HNO3 (конц) =
P + HNO3 (разб) =
Слайд 18

Кислоты
Кислоты-окислители могут реагировать с безкислородными кислотами, обладающими восстановительными свойствами
H2SO4 (конц) +
2HBr = Br2 + SO2 + 2H2O
H2SO4 (конц) + 8HI = 4I2 + H2S + 4H2O
H2SO4 (конц) + H2S = S + SO2 + 2H2O
8HNO3 (конц) + H2S = H2SO4 + 8NO2 + H2O

















 Аффилиативное поведение
Аффилиативное поведение ЭРА-ГЛОНАСС: общая информация. Государственная система экстренного реагирования при авариях
ЭРА-ГЛОНАСС: общая информация. Государственная система экстренного реагирования при авариях Праздник Святой Троицы
Праздник Святой Троицы Бинарный урок математика-химия
Бинарный урок математика-химия Управление качеством
Управление качеством Опасные вещества в быту и правила обращения с ними
Опасные вещества в быту и правила обращения с ними презентация проверяемая безударная гласная
презентация проверяемая безударная гласная Чернобыль. Чернобыльская авария
Чернобыль. Чернобыльская авария Урок на тему Обобщение и систематизация знаний по теме Атомы химических элементов, 8 класс
Урок на тему Обобщение и систематизация знаний по теме Атомы химических элементов, 8 класс Экономика природопользования. Источники информации
Экономика природопользования. Источники информации Понятие и виды уголовных наказаний (2)
Понятие и виды уголовных наказаний (2) Образовательные ткани (меристемы)
Образовательные ткани (меристемы) МАНУАЛ ПО СОЗДАНИЮ БЛОГА
МАНУАЛ ПО СОЗДАНИЮ БЛОГА Игровые компьютеры. Специфика выбора
Игровые компьютеры. Специфика выбора Как помочь ребёнку стать внимательным?
Как помочь ребёнку стать внимательным? Стан навколишнього середовища на Закарпатті
Стан навколишнього середовища на Закарпатті Цветы мне нежно улыбались
Цветы мне нежно улыбались Урок 20 Заполнение основной надписи и печать в КОМПАС
Урок 20 Заполнение основной надписи и печать в КОМПАС Край мой родной.
Край мой родной. Фрагмен урока ОРКСЭ.
Фрагмен урока ОРКСЭ. Актуальные вопросы профилактики, диагностики коронавирусной инфекции COVID-19
Актуальные вопросы профилактики, диагностики коронавирусной инфекции COVID-19 Грузовое судно танкер
Грузовое судно танкер Военно-патриотический новый год
Военно-патриотический новый год Логістична діяльність підприємства
Логістична діяльність підприємства Абстрактные типы данных в С++ (ADT)
Абстрактные типы данных в С++ (ADT) Операция Боари. Конкурс Урология
Операция Боари. Конкурс Урология Гетероциклические соединения
Гетероциклические соединения Тематический день Что мы знаем про огонь?
Тематический день Что мы знаем про огонь?